



知识清单04 物质的量(含答案) 2025年高考化学一轮复习知识清单
展开这是一份知识清单04 物质的量(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单04物质的量教师版2025年高考化学一轮复习知识清单docx、知识清单04物质的量学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共30页, 欢迎下载使用。
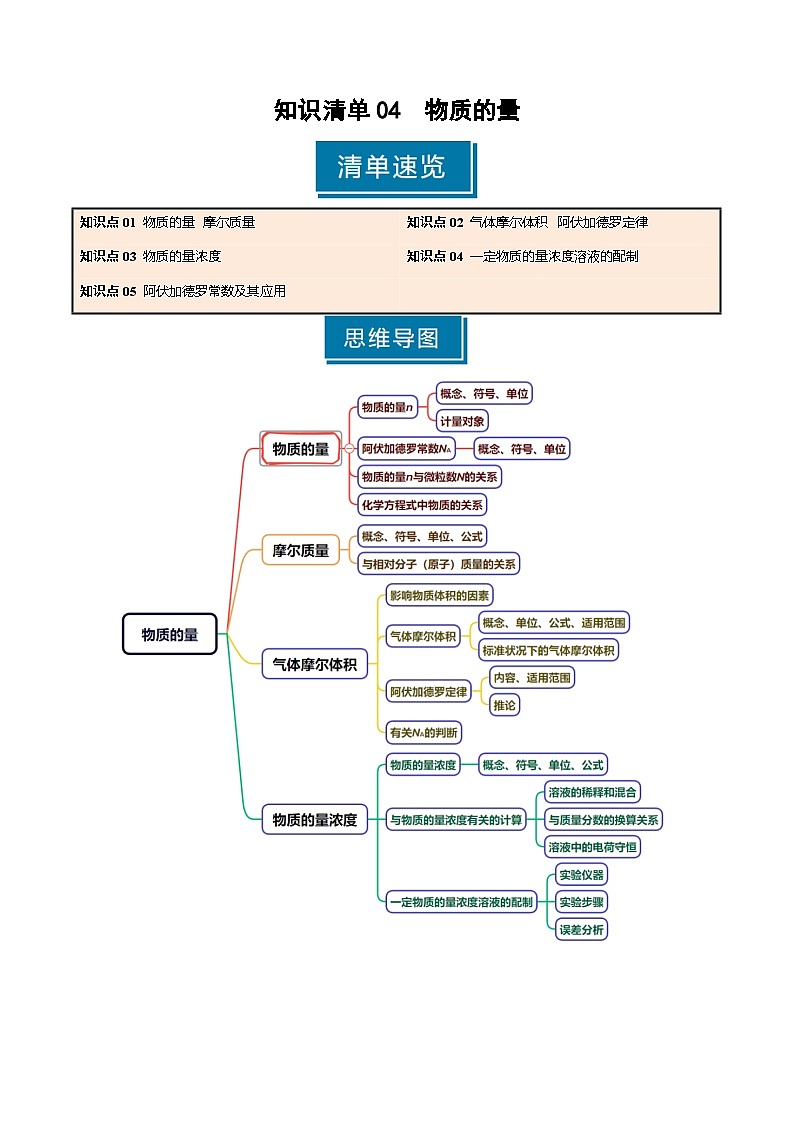
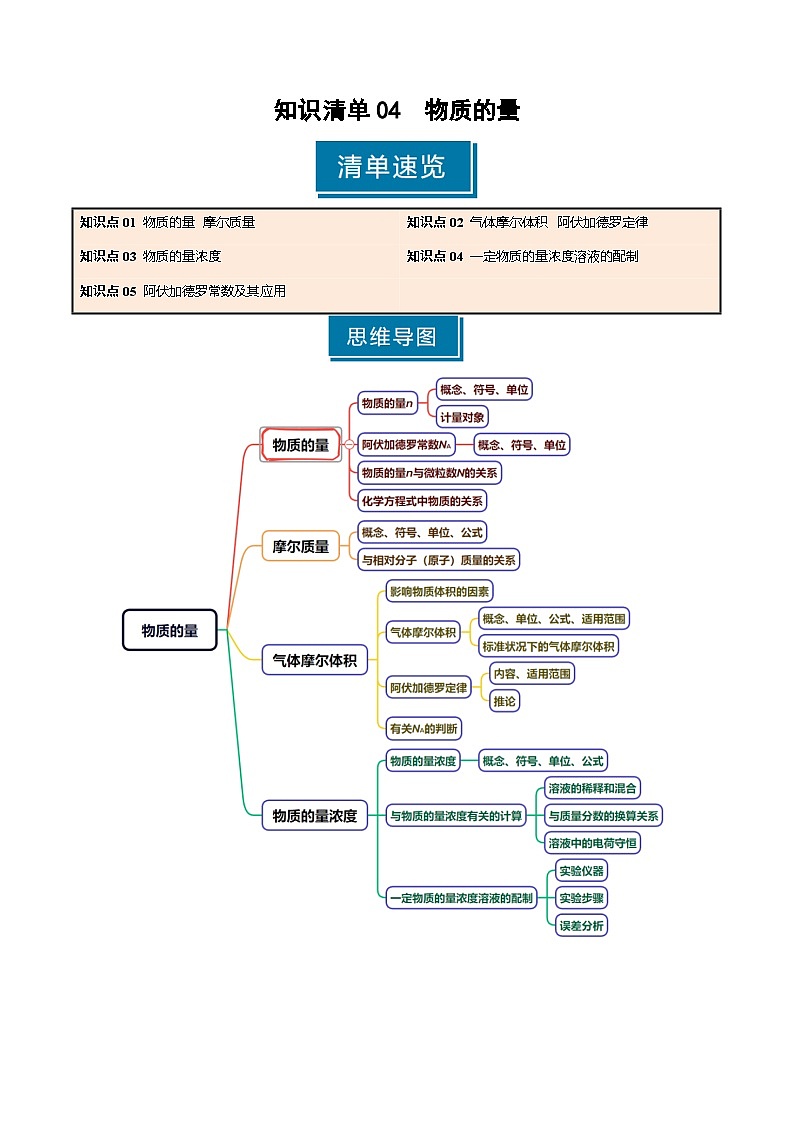
知识点01 物质的量 摩尔质量
1.物质的量
(1)概念:物质的量是国际单位制中的七个基本物理量之一,用来表示一定数目微粒的__________。符号为_______,单位是__________。
(2)物质的量的规范表示方法
(3)计量对象:ml可以计量微观粒子(包括_____________________________________________等)。
2.阿伏加德罗常数
(1)国际上规定,1ml粒子__________所含的粒子数约为6.02×1023。
(2)阿伏加德罗常数:1ml任何粒子的__________叫做阿伏加德罗常数。
符号:_______,通常用______________表示。
(3)物质的量、阿伏加德罗常数与微粒数目的关系:n=_______ 或N=________或NA=________
推论:微粒之间的物质的量之比等于微粒的___________之比。
3.摩尔质量
(1)概念:______________的物质所具有的质量称为该物质的摩尔质量。符号为_______。
(2)常用单位:______________。
(3)数值:当粒子或物质的摩尔质量以____________为单位时,在数值上等于该粒子的相对分子(或原子)质量。
(4)公式:n=_______
(5)摩尔质量的计算
①根据物质的质量(m)和物质的量(n):M=_______。
②已知一个分子的质量时:M=______________。
③根据标准状况下气体的密度ρ:M=______________。
④根据气体的相对密度:D= eq \f(ρ1,ρ2) = _______。
⑤对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……,a%、b%、c%……指混合物中各成分的物质的量分数(或体积分数)。
(1)物质的量是表示微粒数目多少的物理量( )
(2)1 ml任何物质都含有6.02×1023个分子( )
(3)硫酸的摩尔质量为98 g( )
(4)2 ml H2O的摩尔质量是1 ml H2O的摩尔质量的2倍( )
(5)1 ml O2的质量与它的相对分子质量相等( )
物质的量、质量和微粒数之间的计算
(1)含6.02×1023个中子的 eq \\al(\s\up1(7),\s\d1(3)) Li的质量是_____ g。
(2)4 g D2和20 g 18O2的单质化合时最多能生成_____ g D eq \\al(\s\up1(18),\s\d1(2)) O。
(3)若12.4 g Na2X中含有0.4 ml钠离子,Na2X的摩尔质量是__________,X的相对原子质量是_____。
(4)0.5 ml H2SO4分子中氢原子数目为个__________个,氧原子数目为__________个。
(5)含有1.806×1024个电子的OH- 的物质的量为 ;0.5 ml H2O分子中所含质子数与________________个NH3中所含质子数相等。
(6)一个NO分子的质量是a g ,一个NO2分子的质量是b g,设NA是阿伏加德罗常数的值,则氧元素的摩尔质量是_________________。
知识点02 气体摩尔体积 阿伏加德罗定律
1.气体摩尔体积
(1)概念:一定温度和压强下______________的气体所占的体积,符号为_______。
(2)常用单位:______________。
(3)公式:n=_______ V=_______ Vm=_______
(4)标准状况下的气体摩尔体积
标准状况下(0 ℃、101 kPa),Vm≈______________。
标准状况是特定条件,不是常温常压,计量对象在该条件下必须为_______态。
2.阿伏加德罗定律及其推论
(1)阿伏加德罗定律内容
在相同的温度和压强下,相同_______的任何气体都含有______________的分子。
(2)阿伏加德罗定律的推论
3.标准状况下气体摩尔体积的有关计算
①气体的物质的量n=_______ ml;
②气体的摩尔质量M=_______=_______ g·ml-1;
③气体的分子数N=_______=__________;
④气体的质量m=_______=_________ g。
(1)22 g CO2气体的体积为11.2 L( )
(2)在非标准状况下,气体摩尔体积一定不是22.4 L·ml-1( )
(3)标准状况下11.2 L Br2的物质的量为0.5 ml( )
(4)标准状况下,11.2 L O2和H2的混合气体所含分子数约为3.01×1023( )
(5)相同体积的CO和N2,二者含有的原子数相同( )
(6)1 ml任何物质在标准状况下所占的体积都为22.4 L( )
(7)在常温常压下,11.2 L Cl2含有的分子数为0.5NA( )
(8)同温同压下,相同体积的任何气体都含有相同数目的原子( )
一、n= eq \f(N,NA) = eq \f(m,M) = eq \f(V,Vm) 的关系应用
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·ml-1。若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为 。
(2)该气体所含原子总数为 。
(3)该气体在标准状况下的体积为 。
(4)该气体在标准状况下的密度为 。
(5)该气体一个分子的质量为 。
二、阿伏加德罗定律的应用
(1)30 g 12C18O和28 g 14N2所含的分子数之比为 。
(2)同温同压下,12C18O和14N2两种气体的密度之比为 。
(3)同温同压同体积的12C18O和14N2具有电子数之比为 。
(4)28 g14N2所含的原子数为 NA。
(5)将乙烯、CO、N2三种气体分别盛放在三个相同容器中,若三个容器的温度和质量相等,则三个容器的气体压强之比为 。
(6)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则
①混合气体在标准状况下的密度是 g·L-1。
②混合气体的平均摩尔质量是 g·ml-1。
知识点03 物质的量浓度
1.物质的量浓度
(1)概念:物质的量浓度表示___________的溶液里所含溶质的物质的量,符号为_______。
(2)常用单位:_____________________。
(3)公式:n=_______
(4)注意事项
①V是_______的体积,不是溶剂的体积,也不是溶质与溶剂的体积之和。
②n必须是_______的物质的量。
2.溶质的质量分数
(1)概念:以_______的质量与_______的质量的比值来表示溶液的组成的物理量,符号为w。
(2)公式:w=______________×100%
(3)物质的量浓度c和溶质质量分数w的关系
c=_____________ (M:摩尔质量;单位:g·ml-1;ρ:密度,单位:g·cm-3)
3.与物质的量浓度有关的计算
(1)根据定义式计算溶质的物质的量浓度
根据概念表达式cB=_______,欲求cB,先求_______和_______。
计算溶质的物质的量浓度的关键是从已知条件中找出溶质的物质的量(n)和溶液的体积(V),据此求出溶质的物质的量浓度cB。
(2)气体体积(标准状况下)与溶质的物质的量浓度的关系
若已知溶液的体积
(3)溶液中离子浓度的计算
①单一溶液中溶质组成计算
根据组成规律求算:在溶液中,阴离子与阳离子浓度之比等于化学组成中阴、阳离子个数之比。
如K2SO4溶液中:c(K+)=_________=2c(K2SO4)。
②混合溶液中电荷守恒计算
根据电荷守恒,溶质所有____________________________与____________________________相等。
如在Na2SO4、NaCl混合溶液中,c(Na+)=______________,c(Na+)、c(Cl-)分别为7 ml/L、3 ml/L,则c(SOeq \\al(2-,4))=_______ ml/L=_______ ml/L。
4.溶液的稀释和混合问题
(1)将浓溶液加水稀释,稀释前后溶质的______________和_______都保持不变。
c(浓)·V(浓)=______________
m(浓)·w(浓)=______________
(2)同一溶质不同浓度的两溶液相混合,混合后,溶质的____________ (或_______)等于混合前两溶液中溶质的______________ (或__________)。
c1·V1+c2·V2=______________
m1·w1+m2·w2=______________)
(3)混合后溶液的体积
①若题目中指出不考虑溶液体积的改变,可认为是原两溶液的体积之和;
②若题目中给出混合后溶液的密度,应根据V(混)=eq \f(m混,ρ混)=eq \f(ρ1V1+ρ2V2,ρ混)来计算。
(1)1 ml·L-1 NaCl溶液是指此溶液中含有1 ml NaCl( )
(2)1 ml Na2O溶于水,配成1 L溶液所得溶液的物质的量浓度为1 ml·L-1( )
(3)用100 mL水吸收0.1 ml HCl气体所得溶液的物质的量浓度恰好是1 ml·L-1( )
(4)将58.5 g NaCl投入1 000 mL水中形成的溶液的物质的量浓度为1 ml·L-1( )
(5)将25 g CuSO4·5H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 ml·L-1( )
(6)与20 mL 1 ml·L-1 NaNO3溶液中NOeq \\al(-,3)的物质的量浓度相等的是10 mL1 ml·L-1 Cu(NO3)2溶液( )
有关物质的量浓度的计算
1.1 L 0.5 ml·L-1的Al2(SO4)3溶液中n(Al3+)=_______ ml,c(Al3+)=_______ml·L-1,n(SOeq \\al(2-,4))=_______ ml,c(SOeq \\al(2-,4))=_______ ml·L-1,c[Al2(SO4)3]∶c(Al3+)∶c(SOeq \\al(2-,4))=__________,由此可知,对于同一溶液中,不同微粒的浓度之比等于______________之比。
2.(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为 ml·L-1。
(2)若从中取出50 mL溶液,其物质的量浓度为 ml·L-1;溶质的质量为 g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为 ml·L-1,SOeq \\al(2-,4)的物质的量浓度为 ml·L-1。
3.将12.5 g胆矾溶于水并配成1 L的溶液,溶液的物质的量浓度为_______ ml·L-1。
4.在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是 、 。
(2)取这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 _。
知识点04 一定物质的量浓度溶液的配制
1.容量瓶的构造及使用
(1)容量瓶上标有_______、_______和_______。常用规格有100 mL、250 mL、500 mL、1 000 mL等。
(2)容量瓶在使用前要检查______________,其操作顺序为装水盖塞→倒立→正立→玻璃塞旋转180°→倒立。
2.一定物质的量浓度溶液的配制
(1)由固体配制一定物质的量浓度的溶液
(2)由浓溶液配制一定物质的量浓度的溶液
①计算:计算公式c=______________,______________
②量取:用量筒量取一定体积的浓溶液,量筒的精度为_______。
③稀释:在烧杯中加入适量的蒸馏水将浓溶液稀释。
浓硫酸稀释时先加入______________,再_____________________。恢复到室温。
其他步骤与固体配制溶液的步骤相同。
3.质量百分比浓度、体积比浓度溶液的配制
(1)配制100 g 10%的NaCl溶液:
用______________称取10.0 g NaCl固体,放入烧杯中,再用100 mL_______量取_______ mL的水注入烧杯中,然后用_______搅拌使之溶解。
(2)用浓硫酸配制1∶4的稀硫酸50 mL:
用50 mL的_______量取40.0 mL的水注入100 mL的烧杯中,再用10 mL 的_______量取10.0 mL浓硫酸,然后沿烧杯内壁缓缓注入烧杯中,并用玻璃棒不停地搅拌。
4.一定物质的量浓度溶液的配制误差分析
(1)误差分析的方法:
在配制一定物质的量浓度的溶液时,很多因素会引起溶液浓度的误差。分析误差时,要根据c= eq \f(n,V) ,围绕实验操作对_______或_______的影响来分析。
(2)定容时仰视或俯视刻度线产生的误差图解:
①仰视刻度线(图1)。由于操作时是以刻度线为基准加水,刻度线低于液面,故加水量_______,导致溶液体积_______,浓度_______。
②俯视刻度线(图2)。与仰视刻度线恰好相反,刻度线高于液面,故加水量_______,导致溶液体积_______,浓度_______。
(3)溶液的配制误差分析
以配制100 mL 0.100 ml·L-1的Na2CO3溶液为例,判断下列操作对溶液浓度的影响。
(1)容量瓶在使用前要检查是否漏水( )
(2)用固体NaCl配制0.5 ml·L-1的溶液,所用的仪器只有:烧杯、玻璃棒、胶头滴管、容量瓶( )
(3)向容量瓶转移液体时,引流用的玻璃棒可以接触容量瓶内壁( )
(4)用量筒量取20 mL 0.500 0 ml·L-1 H2SO4溶液于烧杯中,加水80 mL,配制成0.100 0 ml·L-1 H2SO4溶液( )
(5)NaOH在烧杯里刚完全溶解时,立即将溶液转移到容量瓶( )
(6)配制480 mL 1 ml·L-1的NaOH溶液,应用托盘天平称量NaOH固体19.2 g,选用500 mL容量瓶( )
一、一定物质的量浓度溶液的配制仪器使用及规范操作
1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
2.由FeSO4·7H2O固体配制0.10 ml·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、__________ ______________(从下列图中选择,写出名称)。
3.下列图示表示一定物质的量浓度溶液配制的是 。
4.判断下列实验过程是否正确。
(1)配制0.400 0 ml·L-1的NaOH溶液:称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容( )
(2)配制浓度为0.010 ml·L-1的KMnO4溶液:称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度( )
(3)用20 mL量筒量取15 mL酒精,加水5 mL,配制质量分数为75%酒精溶液( )
(4)实验中需用2.0 ml·L-1的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950 mL、201.4 g( )
(5)实验室配制500 mL 0.2 ml·L-1的硫酸亚铁溶液,其操作是:用天平称15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀( )
二、溶液配制的误差分析
1.从溶质改变角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
(1)配制450 mL 0.1 ml·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g: 。
(2)配制500 mL 0.1 ml·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g: 。
(3)配制NaOH溶液用托盘天平称量NaOH时,托盘天平的两个托盘上放两张质量相等的纸片,其他操作均正确: 。
(4)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒: 。
(5)配制稀H2SO4溶液用量筒量取浓硫酸时,仰视读数: 。
(6)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线: 。
(7)未经洗涤烧杯及玻璃棒: 。
2.从溶液改变角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
(1)配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容: 。
(2)定容摇匀后,发现液面下降,继续加水至刻度线: 。
(3)定容时仰视刻度线: 。
(4)定容摇匀后少量溶液外流: 。
(5)容量瓶中原有少量蒸馏水: 。
知识点05 阿伏加德罗常数及其应用
一、一定体积的气体中微粒数目的分析
(1)看“气体”是否处于“标准状况”(0℃,101KPa)
当题干中设置“常温常压”、“室温”等条件时,无法用____________下的气体摩尔体积求解粒子数目。
(2)看“标准状况”下物质是否为“气体”
水、苯、汽油、四氯化碳、乙醇、甲醇、CH2Cl2、CHCl3、SO3、HF等在____________下均不为气态;
只有气体并且在____________下才能使用Vm=22.4L·ml-1进行有关计算;
当题干中所给物质在____________下为非气态物质时,无法用标准状况下的气体摩尔体积求解粒子数目。
二、一定物质中原子、中子、质子、电子等数目的分析
先计算出一个物质中所含微观粒子数目,再根据题目条件计算出该物质的物质的量,进而计算出物质中所含微观粒子数目的物质的量,最后根据微粒数、物质的量、NA三者之间的数学关系,确定微观粒子的数目。
①He、Ne:是_________分子;
②臭氧(O3)、白磷(P4):多原子分子中的原子个数;
③D2O:H(H)、D(H)、T(H)三者中的_________数不同;
④16O2、17O2、18O2 16O、17O、18O 35Cl、37Cl中的_________数不同;
⑤Na2O2、Na2O、KO2中的阴、阳离子个数比分别为_________、_________、_________;
⑥若物质为混合物,先求混合物中各物质的最简式是否相同。
若最简式相同,可先求最简式的_________,然后求解目标粒子数目;若最简式不同,可先计算两物质的摩尔质量是否相同,当摩尔质量相同时,可先求两物质的总_________,然后求解目标粒子的数目。
如:14 g乙烯与丙烯中所含的碳原子数为_______;22 g CO2 和N2O 混合物中所含的原子数为_______;常考查的还有O2和O3,NO2和N2O4等。
最简式相同的物质,如NO2和N2O4、乙烯(C2H4)和丙烯(C3H6)等。
摩尔质量相同的物质,如N2、CO、C2H4等。
三、一定量的物质中化学键数目的分析
金刚石:1 ml金刚石(或晶体硅)中含有的C—C键(或Si—Si键)数为_________;
石墨:1 ml石墨中含有的C—C键数为_________;
SiO2:1ml含_________ml Si—O键;
苯:苯环中的碳碳键是介于单键和双键之间的一种独特的键,不含有碳碳双键,含有_____个C—H;
白磷(P4): 11 ml白磷(P4)中含有的P—P键的数目为_________ ;
1 ml Na2O2、CaC2中含Oeq \\al(2-,2) 、Ceq \\al(2-,2)分别是_________ ml;
烃及其衍生物:通过书写其结构简式确定化学键。
四、电解质溶液中微粒数目的分析
已知量(溶液的体积及溶质的物质的量浓度)→物质的量→分析粒子种类及个数(溶质的电离、水解、溶剂所含粒子等)→目标粒子数目;
解题时的几个易错点:
(1)“已知浓度缺体积”及“已知体积缺浓度”:以上两种情况均无法求解溶液中所含目标粒子的数目;
如25 ℃ 时,pH=13的NaOH溶液中所含OH−的数目为 0.1NA:因为缺少_________无法计算OH−的数目,故此说法错误。
(2)电离:当溶质为弱电解质时,其在溶液中_________电离,溶液中所含的分子数及电离出的离子数目均无法直接求解;
如1 L 1 ml·L−1的氨水中有NA个NHeq \\al(+,4):一水合氨为弱电解质,_________全部电离,故氨水中所含NHeq \\al(+,4)的数目_________NA,错误。
(3)水解:当电解质在溶液中发生水解时,溶液中发生水解的离子数目无法直接求解;
如将0.1 ml FeCl3配成1 L溶液,所得溶液含有0.1NA个Fe3+:Fe3+部分水解导致所配溶液中的Fe3+减少,从而使溶液中的Fe3+数目_________0.1NA,错误。
(4)溶剂:当溶剂中也含有所求的粒子时,往往习惯性地只考虑溶质中所含粒子,而忽视了溶剂中所含粒子导致出错。
如50 g质量分数为46%的乙醇水溶液中,含氢原子数目为3NA:由于忽视溶剂水中也含有_________,错误。
(5)胶体中微粒:是多个微粒的聚合体,胶粒数目_________离子数目。
如0.1L1ml/L的饱和氯化铁溶液滴入沸水中,生成的胶体含胶粒数目_______0.1NA。
五、特殊反应或隐含反应中NA的分析
1.可逆反应类型
因为可逆反应进行不完全,当没给出转化率时,不能求出准确的目标粒子数目。
常见的可逆反应:
①2SO2+O2eq \(,\s\up7(催化剂),\s\d5(△))2SO3 ②NO2N2O4 ③N2+3H2eq \(,\s\up7(高温、高压),\s\d5(催化剂))2NH3
④Cl2+H2OHCl+HClO ⑤NH3+H2ONH3·H2ONH eq \\al(\s\up1(+),\s\d1(4)) +OH-
⑥H2+I22HI
如某密闭容器盛有0.1 ml N2和0.3 ml H2,在一定条件下充分反应,转移的电子数目为0.6NA:该反应为_____反应,进行程度不确定,无法准确求解转移的电子数目,故错误。
2.溶液浓度变化使反应停止的类型
因为酸的浓度变化使反应停止,难以求出准确的目标粒子数目。
如80 mL 12 ml·L−1的浓盐酸与足量MnO2反应,生成Cl2的分子数目为0.24NA:随着反应进行,浓盐酸变为_________,反应停止,无法准确求解生成的Cl2的分子数目,错误。
3.物质组成不能确定的类型
当某些物质混合或反应进行一段时间后,产物的种类变化或物质的量不定,难以求出准确的目标粒子数目。
如标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5NA:两种气体混合后生成NO2,若不考虑NO2部分转化为N2O4,气体的体积为8.4 L,物质的量为0.375 ml,事实上,混合气体中存在可逆反应__________,故无法准确求解分子数目,错误。
六、氧化还原反应中电子转移数目的分析
常考反应中转移的电子数:
注意氧化顺序:如向FeI2溶液中通入氯气,氯气先氧化__________,再氧化__________;
量不同,所表现的化合价不同:如1 ml Fe与足量的稀HNO3反应,转移 2NA个电子:铁与足量的稀硝酸反应时生成Fe(NO3)3,转移的电子数为_______,故上述说法错误。
(1)标准状况下,22.4 L氧气、氮气和CO的混合气体中含有2NA个原子( )
(2)标准状况下,18 g H2O所含的氧原子数目为NA( )
(3)在常温常压下,18 g H2O与18 g D2O所含电子数均为10NA( )
(4)17 g —OH与17 g OH-所含电子数均为10NA( )
(5)0.1 ml·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA( )
(6)25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA( )
(7)常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子( )
(8)1 L 0.01 ml·L-1 KAl(SO4)2溶液中含有的阳离子数大于0.02NA( )
(9)1 ml Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA( )
(10)1 ml Na2O2与足量CO2充分反应转移的电子数为2NA( )
(11)含2 ml H2SO4的浓硫酸与足量铜共热,转移的电子数为2NA( )
(12) 0.1 ml·L-1的NaHSO4溶液中,Na+数目为0.1NA( )
(13)密闭容器中2 ml NO与1 ml O2充分反应后,混合气体中氧原子数为4NA( )
(14)100 g 46%的乙醇溶液中含有氧原子数为NA( )
(15)CH4与P4的分子结构均为正四面体形,在1 ml CH4分子或P4分子中含有的共价键数皆为4NA( )
(16)用惰性电极电解饱和食盐水,若阴极产生11.2 L气体,则线路中通过NA个电子( )
(1)常温常压下,11.2 L O2所含分子数_______0.5NA(填“>”、“<”或“=”)
(2)将标准状况下22.4 L NH3溶于水配成1 L溶液,溶液中NH3·H2O与NHeq \\al(+,4)的数目之和为_______NA(填“>”、“<”或“=”)
(3)0.5ml H2和1ml I2 混合,在一定条件下充分反应后的体系中分子总数为_______。
(4)0.5ml CH3+中质子数为_______、电子数目为_______。
(5)1 ml CH3OCH3中,孤电子对数目为_______。
(6) 12 g NaHSO4中含有_______个阳离子。
(7)在2.8 g Fe中加入100 mL 3 ml/L HCl,Fe完全溶解, 反应转移电子数为_______。
(8)28 g C2H4分子中含有的σ键数目为_______。
(9)标准状况下,22.4 L Cl2溶于水所得溶液中,Cl2、Cl-、HClO和ClO-微粒总数为介于_______和_______之间。
(10)浓硝酸热分解生成NO2、N2O4共23 g,转移电子数为_______。
(11)电极反应LiFePO4-xe-===xLi++Li1-xFePO4,每转移1ml电子释放_______个Li+。
(12) 2 ml PCl5中磷原子的价层电子对数为_______。
(13)标准状况下,22.4 L氧气、氮气和CO的混合气体中含有_______个原子。
(14)常温常压下,1 ml CO2与SO2的混合气体中含氧原子数为_______。
(15)4.5 g SiO2晶体中含有的硅氧键的数目为_______。
(16)34 g过氧化氢存在的极性键总数为_______。
(17)46 g乙醇中存在的共价键总数为_______。
(18)5.6 g Fe和6.4 g Cu分别与0.1 ml Cl2充分反应,转移的电子数均为_______。
知识点01 物质的量 摩尔质量
知识点02 气体摩尔体积 阿伏加德罗定律
知识点03 物质的量浓度
知识点04 一定物质的量浓度溶液的配制
知识点05 阿伏加德罗常数及其应用
公式
语言叙述(背会)
T、p相同
eq \f(V1,V2)=eq \f(n1,n2)
同温、同压下,气体的体积与其______________成正比
eq \f(ρ1,ρ2)=eq \f(M1,M2)
同温、同压下,气体的密度与其_________ (或____________)成正比
T、V相同
eq \f(p1,p2)=eq \f(n1,n2)
温度、体积相同的气体,其压强与其__________成正比
实验步骤
实验仪器
实验要点
计算
计算公式:n=cV m=nM
称量
托盘天平的精度为_______,用分析天平或电子天平,精度为0.0001g。
溶解
用玻璃棒_______,并______________
转移
用玻璃棒_______
洗涤
①用玻璃棒洗涤_____________________2~3次
②洗涤液均注入容量瓶中
③摇匀
定容
①将蒸馏水注入容量瓶至液面位于_________ ___________________
②改用胶头滴管加水至_____________________
③平时_______
摇匀
盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,_____________________
可能引起误差的操作
变化的量
实际浓度(c)
将烧杯中溶液向容量瓶中转移时,有少量洒出
烧杯中溶液倾倒完毕,忘记洗涤烧杯和玻璃棒
未冷却至室温就注入容量瓶定容
定容时,仰视容量瓶的刻度线
定容时,俯视容量瓶的刻度线
定容时,水加多了,用滴管吸出
定容摇匀后,发现液面下降,再加水至刻度线
溶解前烧杯内有水
/
反应
物质
转移电子数(NA)
Na2O2+CO2(或H2O)
1 ml Na2O2
1 ml O2
Cl2+NaOH(H2O)
1 ml Cl2
Cl2+Fe
1 ml Cl2
Cu+S
1 ml Cu
+I−(+H+)
1 ml I2
NH4NO3→N2
1 ml N2
+Cl−(+H+)
3 mlCl2
NH4NO2→N2
1 ml N2
相关学案
这是一份知识清单23 盐类的水解(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单23盐类的水解教师版2025年高考化学一轮复习知识清单docx、知识清单23盐类的水解学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共28页, 欢迎下载使用。
这是一份知识清单21 电离平衡(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单21电离平衡教师版2025年高考化学一轮复习知识清单docx、知识清单21电离平衡学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共17页, 欢迎下载使用。
这是一份知识清单18 原电池 化学电源(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单18原电池化学电源教师版2025年高考化学一轮复习知识清单docx、知识清单18原电池化学电源学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。












