


知识清单17 化学反应的热效应(含答案) 2025年高考化学一轮复习知识清单
展开
这是一份知识清单17 化学反应的热效应(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单17化学反应的热效应教师版2025年高考化学一轮复习知识清单docx、知识清单17化学反应的热效应学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共29页, 欢迎下载使用。
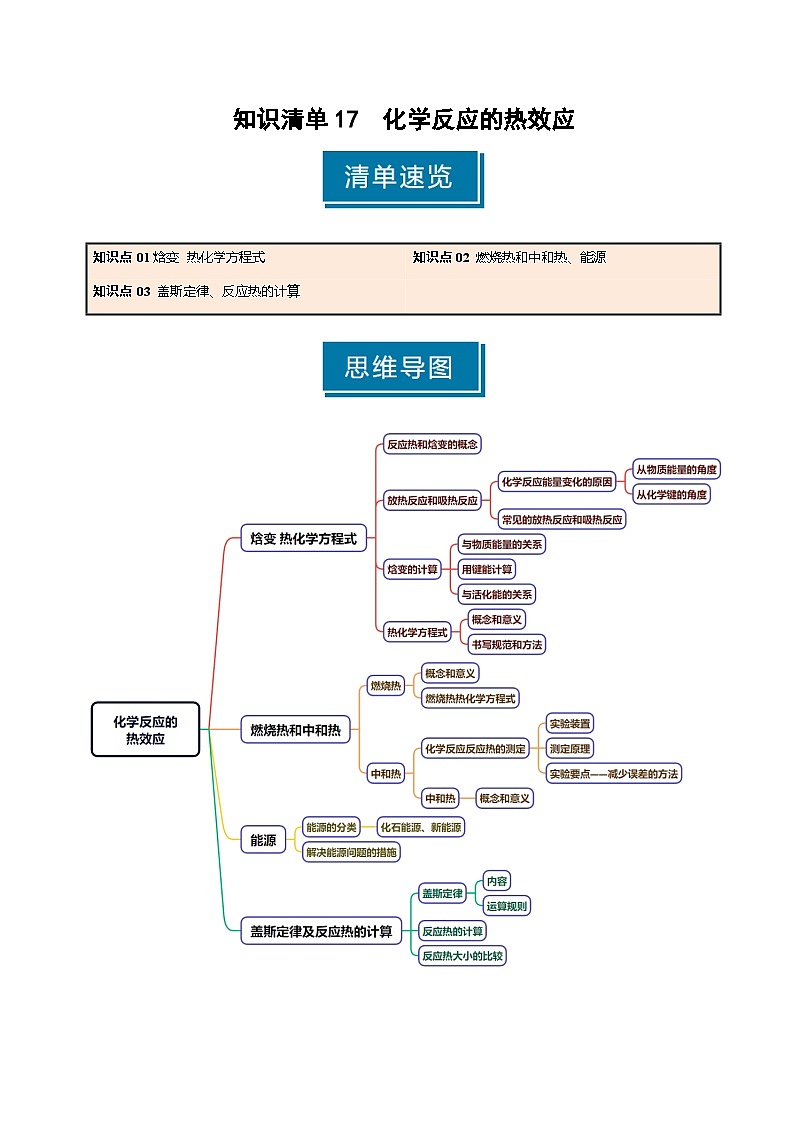
知识点01 焓变 热化学方程式
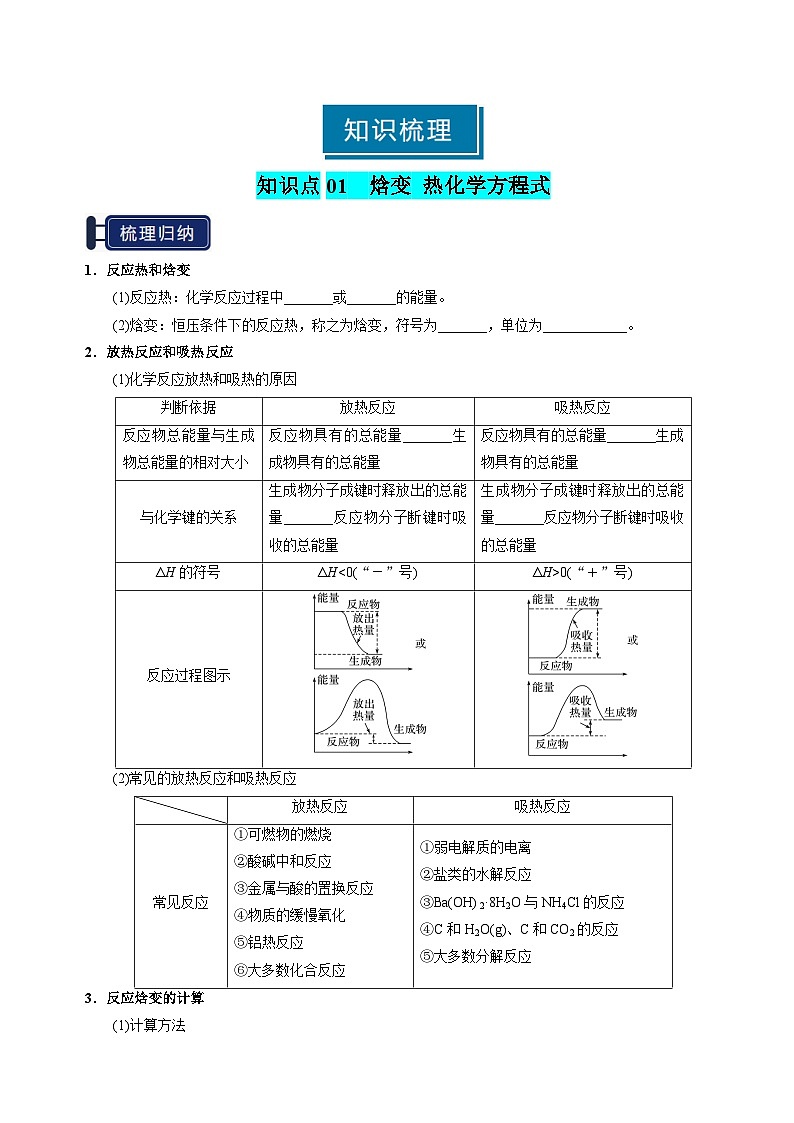
1.反应热和焓变
(1)反应热:化学反应过程中_______或_______的能量。
(2)焓变:恒压条件下的反应热,称之为焓变,符号为_______,单位为____________。
2.放热反应和吸热反应
(1)化学反应放热和吸热的原因
(2)常见的放热反应和吸热反应
3.反应焓变的计算
(1)计算方法
ΔH=_______的总能量-_______的总能量
ΔH=_______的总键能-_______的总键能
ΔH=_______活化能-_______活化能
(2)用键能计算反应热
利用键能计算反应热的关键,是弄清物质中化学键的数目,常见单质、化合物中所含共价键的种类和数目。
(3)活化能与焓变的关系
a.催化剂能_______反应的活化能,但不影响焓变的大小。
b.在无催化剂的情况,E1为_______的活化能,E2为_______的活化能,ΔH=_________,活化能大小影响反应速率。
c.起点、终点能量高低判断反应的ΔH,并且物质的能量越低,物质越_______。
4.热化学方程式
(1)概念:表示参加反应物质的量和_______的关系的化学方程式。
(2)意义:
不仅表明了化学反应中的_______变化,也表明了化学反应中的_______变化。例如:H2(g)+eq \f(1,2)O2(g)===H2O(l) ΔH=-285.8 kJ·ml-1,表示在25 ℃和1.01×105 Pa下,1 ml H2(g)和eq \f(1,2) ml O2(g)反应生成___________________________________。
(3)热化学方程式的书写方法
①写出化学方程式并注明各物质的聚集状态。
热化学方程式的化学计量数表示的是____________,可以是_______或_______。
物质的聚集状态:固态用“_______”,液态用“_______”,气体用“_______”,溶液用“_______”。
②注明反应时的温度和压强。常用的ΔH的数据,一般都是___________时的数据,可以不特别注明。
③用ΔH表示化学反应热,ΔH必须与化学方程式一一对应,注意“+”“-”和单位__________。
④ΔH的单位中“ml-1”的含义
对一个化学反应,ΔH的单位中“ml-1”不是指每摩尔具体物质,而是指“每摩尔_______”。
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应( )
(2)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同( )
(3)石墨转变为金刚石是吸热反应,则金刚石比石墨更稳定( )
(4)800 ℃、30 MPa下,将0.5 ml N2和1.5 ml H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,则其热化学方程式为N2(g)+3H2(g)===2NH3(g) ΔH=-38.6 kJ·ml-1( )
(5)所有的燃烧反应都是放热反应,所以不需要加热就能进行( )
(6)一个反应的焓变因反应物的用量和反应条件的改变而发生改变( )
(7)可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关( )
(8)碳在空气中燃烧生成CO2,该反应中化学能全部转化为热能( )
(9)活化能越大,表明化学反应吸收的能量越大( )
(10)Na2CO3溶于水,NaHCO3溶于水均放出热量( )
(11)对于SO2(g)+ eq \f(1,2) O2(g)SO3(g) ΔH=-Q kJ·ml-1,增大压强平衡右移,放出的热量增大,ΔH减小( )
(12)热化学方程式前面的化学计量数既表示分子数也表示物质的量( )
(13)同素异形体转化的热化学方程式除了标明状态外,还要注明名称( )
(14)因为O—H键的键能大于S—H键的键能,所以H2O的稳定性大于H2S( )
一、化学反应过程的能量图
1.根据如图所示的反应,回答下列问题:
(1)该反应是放热反应还是吸热反应?__________。
(2)反应的ΔH=________。
(3)反应的活化能为__________。
(4)试在图中用虚线表示在反应中使用催化剂后活化能的变化情况。
2.科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图。
回答下列问题:
(1)从状态Ⅰ到状态Ⅲ为 (填“吸热”或“放热”)反应。
(2)从状态Ⅰ到状态Ⅱ需要 (填“吸收”或“释放”)能量,CO分子 (填“是”或“否”)需要断键形成C和O。
(3)从状态Ⅱ到状态Ⅲ形成的化学键是 。
(4)将相同物质的量的CO转化为CO2,CO与O比CO与O2反应放出的热量 (填“多”或“少”),可能的原因是 。
(5)由该反应过程可知,在化学反应中,旧化学键 (填“一定”或“不一定”)完全断裂,但一定有新化学键的 。
3.臭氧层中O3分解过程如图所示,回答下列问题。
(1)ΔH (填“>”或“”“<”或“=”,下同)ΔH2。
(2)C(s)+O2(g)===CO2(g) ΔH1<0 C(s)+eq \f(1,2)O2(g)===CO(g) ΔH2<0
则ΔH1 ΔH2。
(3)2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH1 2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH2
则有ΔH1______ΔH2
(4)Br2(g)+H2(g)===2HBr(g) ΔH1 Br2(l)+H2(g)===2HBr(g) ΔH2
则有ΔH1______ΔH2
(5)4Al(s)+3O2(g)===2Al2O3(s) ΔH1 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH2
则有ΔH1_____ΔH2
(6)Cl2(g)+H2(g)===2HCl(g) ΔH1 Br2(g)+H2(g)===2HBr(g) ΔH2
则有ΔH1_____ΔH2
知识点01焓变 热化学方程式
知识点02 燃烧热和中和热、能源
知识点03 盖斯定律、反应热的计算
判断依据
放热反应
吸热反应
反应物总能量与生成物总能量的相对大小
反应物具有的总能量_______生成物具有的总能量
反应物具有的总能量_______生成物具有的总能量
与化学键的关系
生成物分子成键时释放出的总能量_______反应物分子断键时吸收的总能量
生成物分子成键时释放出的总能量_______反应物分子断键时吸收的总能量
ΔH的符号
ΔH0(“+”号)
反应过程图示
放热反应
吸热反应
常见反应
①可燃物的燃烧
②酸碱中和反应
③金属与酸的置换反应
④物质的缓慢氧化
⑤铝热反应
⑥大多数化合反应
①弱电解质的电离
②盐类的水解反应
③Ba(OH)2·8H2O与NH4Cl的反应
④C和H2O(g)、C和CO2的反应
⑤大多数分解反应
物质
(化学键)
CO2
(C==O)
CH4
(C—H)
P4
(P—P)
SiO2
(Si—O)
石墨
(C—C)
金刚石
(C—C)
S8
(S—S)
Si
(Si—Si)
每个微粒所含键数
化学键
C—H
C==C
C—C
H—H
键能/ (kJ·ml-1)
414
615
347
435
化学键
N≡O
Cl—Cl
Cl—N
N==O
键能/ (kJ·ml-1)
630
243
a
607
热化学方程式
方程式系数关系
焓变之间的关系
反应Ⅰ:aA(g)===B(g)ΔH1
反应Ⅱ:B(g)===aA(g)ΔH2
反应Ⅰ:aA(g)===B(g)ΔH1
反应Ⅱ:A(g)=== eq \f(1,a) B(g)ΔH2
/
相关学案
这是一份知识清单23 盐类的水解(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单23盐类的水解教师版2025年高考化学一轮复习知识清单docx、知识清单23盐类的水解学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共28页, 欢迎下载使用。
这是一份知识清单21 电离平衡(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单21电离平衡教师版2025年高考化学一轮复习知识清单docx、知识清单21电离平衡学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共17页, 欢迎下载使用。
这是一份知识清单18 原电池 化学电源(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单18原电池化学电源教师版2025年高考化学一轮复习知识清单docx、知识清单18原电池化学电源学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。








