





新高考化学复习专题八化学键分子和晶体的结构与性质练习课件
展开考点1 化学键、分子间作用力
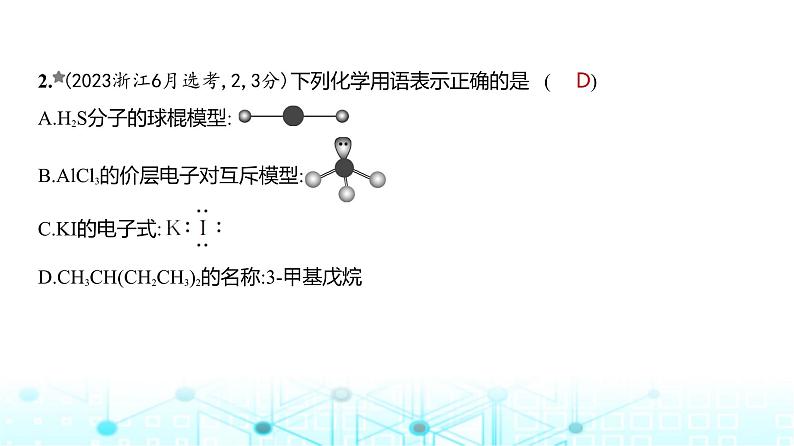
2. (2023浙江6月选考,2,3分)下列化学用语表示正确的是 ( )A.H2S分子的球棍模型: B.AlCl3的价层电子对互斥模型: C.KI的电子式:D.CH3CH(CH2CH3)2的名称:3-甲基戊烷
3. (2021北京,3,3分)下列化学用语或图示表达不正确的是 ( )A.N2的结构式: B.Na+的结构示意图: C.溴乙烷的分子模型: D.CO2的电子式:
4. (2022天津,4,3分)利用反应2NH3+NaClO N2H4+NaCl+H2O可制备N2H4。下列叙述正确的是 ( )A.NH3分子有孤电子对,可作配体B.NaCl晶体可以导电C.1个N2H4分子中有4个σ键D.NaClO和NaCl均为离子化合物,它们所含的化学键类型相同
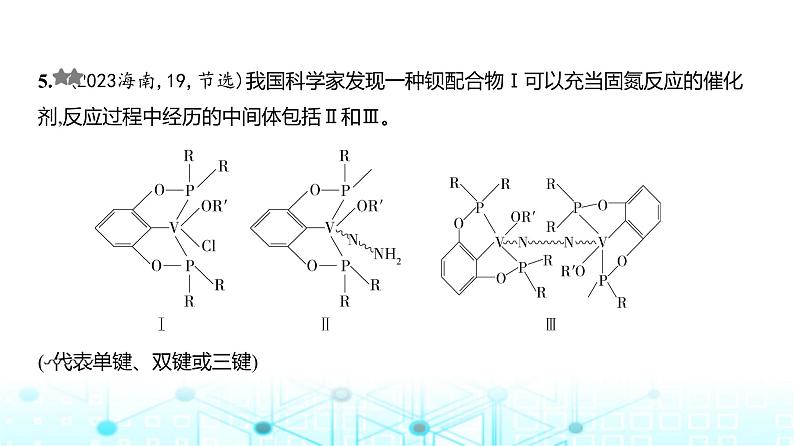
5. (2023海南,19,节选)我国科学家发现一种钡配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
( 代表单键、双键或三键)
回答问题:(1)配合物Ⅰ中钒的配位原子有4种,它们是 。(2)配合物Ⅰ中,R‘代表芳基,V-O-R'空间结构呈角形,原因是 。(3)配合物Ⅱ中,第一电离能最大的配位原子是 。(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为+4和+3,配合物Ⅱ、Ⅲ和N2三者中,两个氮原子 间键长最长的是 。
答案 (1)C、O、P、Cl (2)氧原子的价层电子对数为4,其中孤电子对数为2,采取sp3 杂化 (3)N (4)配合物Ⅱ
考点2 分子结构与性质
6. (2023湖南,4,3分)下列有关物质结构和性质的说法错误的是 ( )A.含有手性碳原子的分子叫做手性分子B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点C.酰胺在酸或碱存在并加热的条件下可发生水解反应D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
7. (2023新课标,9,6分)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是 ( )A.该晶体中存在N—H…O氢键B.基态原子的第一电离能:C
9. (2022湖北,11,3分)磷酰三叠氮是一种高能分子,结构简式为 。下列关于该分子的说法正确的是 ( )A.为非极性分子B.立体构型为正四面体形C.加热条件下会分解并放出N2D.分解产物NPO的电子式为
10. (2023重庆,10,3分)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是 ( )A.NCl3和SiCl4均为极性分子B.NCl3和NH3中的N均为sp2杂化C.NCl3和SiCl4的水解反应机理相同D.NHCl2和NH3均能与H2O形成氢键
11. (2023浙江1月选考,17,10分)硅材料在生活中占有重要地位。请回答:(1)Si(NH2)4分子的空间结构(以Si为中心)名称为 ,分子中氮原子的杂化轨道类 型是 。Si(NH2)4受热分解生成Si3N4和NH3,其受热不稳定的原因是 。(2)由硅原子核形成的三种微粒,电子排布式分别为①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1。有关这些微粒的叙述,正确的是 。A.微粒半径:③>①>②B.电子排布属于基态原子(或离子)的是:①②C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学 式为 。
答案 (1)四面体 sp3 Si周围的NH2基团体积较大,受热时斥力较强[Si(NH2)4中Si—N 键键能相对较小];产物中气态分子数显著增多(熵增)(2)AB(3)共价晶体 SiP2
考点3 晶体结构与性质
12. (2021天津,2,3分)下列各组物质的晶体类型相同的是 ( )A.SiO2和SO3 B.I2和NaClC.Cu和Ag D.SiC和MgO
13. (2023北京,1,3分)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是 ( )A.三种物质中均有碳碳原子间的σ键B.三种物质中的碳原子都是sp3杂化C.三种物质的晶体类型相同D.三种物质均能导电
14. (2023重庆,9,3分)配合物[MA2L2]的分子结构以及分子在晶胞中的位置如图所示,下列说法错误的是 ( )
A.中心原子的配位数是4B.晶胞中配合物分子的数目为2C.晶体中相邻分子间存在范德华力D.该晶体属于混合型晶体
15. (2023山东,5,2分)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是 ( )
A.与石墨相比,(CF)x导电性增强B.与石墨相比,(CF)x抗氧化性增强C.(CF)x中C—C的键长比C—F短D.1 ml (CF)x中含有2x ml共价单键
16. (2022湖北,9,3分)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是 ( )
A.Ca2+的配位数为6B.与F-距离最近的是K+C.该物质的化学式为KCaF3D.若F-换为Cl-,则晶胞棱长将改变
17. (2023湖南,11,3分)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6B.晶体中与K+最近且距离相等的Ca2+有8个C.晶胞中B和C原子构成的多面体有12个面D.晶体的密度为 g·cm-3
1. (2023山东,3,2分)下列分子属于极性分子的是 ( )A.CS2 B.NF3 C.SO3 D.SiF4
考法1 杂化轨道类型及分子极性判断
2. (2023海南,4,2分)下列有关元素单质或化合物的叙述正确的是 ( )A.P4分子呈正四面体,键角为109°28'B.NaCl焰色为黄色,与Cl电子跃迁有关C.Cu基态原子核外电子排布符合构造原理D.OF2是由极性键构成的极性分子
3. (2023江苏,5,3分)下列说法正确的是( )A. H H H都属于氢元素B.N 和H2O的中心原子轨道杂化类型均为sp2C.H2O2分子中的化学键均为极性共价键D.CaH2晶体中存在Ca与H2之间的强烈相互作用
4. (2023浙江1月选考,12,3分)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3 2Al(NH3)Cl3。下列说法不正确的是 ( )A.Al2Cl6的结构式为 B.Al2Cl6为非极性分子C.该反应中NH3的配位能力大于氯D.Al2Br6比Al2Cl6更难与NH3发生反应
5. (2023新课标,12,6分)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是 ( )A.NH2OH、NH3和H2O均为极性分子B.反应涉及N—H、N—O键断裂和N—N键生成C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+D.将NH2OH替换为ND2OD,反应可得ND2ND2
6. (2021全国甲,35,节选)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择 性催化剂将二氧化碳加氢合成甲醇。回答下列问题:(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为 ;单晶硅的晶体类型为 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化 类型为 。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂 化类型为 (填标号)。(2)CO2分子中存在 个σ键和 个π键。(3)甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是 。
答案 (1)3s23p2 共价晶体 sp3 ② (2)2 2 (3)甲硫醇不能形成分子间氢键,而水和甲醇均能,且水的氢键比甲醇的多
考法2 键参数大小比较 大π键分析
7. (2022北京,9,3分)由键能数据大小,不能解释下列事实的是 ( )
A.稳定性:CH4>SiH4B.键长:
8. (2022天津,12,3分)一定条件下,石墨转化为金刚石吸收能量。下列关于石墨和金刚石的说法正确的是 ( )A.金刚石比石墨稳定B.两物质的碳碳σ键的键角相同C.等质量的石墨和金刚石中,碳碳σ键数目之比为4∶3D.可以用X射线衍射仪鉴别金刚石和石墨
9. (2023北京,10,3分)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是 ( )A.F—F键的键能小于Cl—Cl键的键能B.三氟乙酸的Ka大于三氯乙酸的KaC.氟化氢分子的极性强于氯化氢分子的极性D.气态氟化氢中存在(HF)2,而气态氯化氢中是 HCl分子
10. (2021湖北,9,3分)下列有关N、P及其化合物的说法错误的是 ( )A.N的电负性比P的大,可推断NCl3分子的极性比PCl3的大B.N与N的π键比P与P的强,可推断 的稳定性比 的高C.NH3的成键电子对间排斥力较大,可推断NH3的键角比 PH3的大D.HNO3的分子间作用力较小,可推断HNO3的熔点比 H3PO4的低
11. (2023山东,16,12分)卤素可形成许多结构和性质特殊的化合物。回答下列问题:(1)-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶 体类型为 ,HOF水解反应的产物为 (填化学式)。(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键( )。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角 Cl—O—Cl键角 (填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O键的键长并说明原因 。(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结 构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程
式为 。若阿伏加德罗常数的值为NA,化合物 X的密度ρ= g·cm-3(用含NA的代数式表示)。
答案 (1)分子晶体 HF和H2O2(2)sp2 > ClO2中存在大π键,Cl2O中仅存在Cl—O σ键,所以ClO2中Cl—O键的键长更短(3)CuCl2+4K+2F2 2KCl+K2CuF4
考法3 物质熔、沸点高低比较
12. (2022天津,3,3分)下列物质沸点的比较,正确的是 ( )A.CH4>C2H6B.HF>HClC.H2S>H2SeD. >CH3CH2CH2CH3
13. (2023湖北,11,3分)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是 ( )
14. (2023河北,7,3分)物质的结构决定其性质。下列实例与解释不相符的是 ( )
15. (2021海南,11,4分)关于NH3性质的解释合理的是 ( )
16. (2022山东,5,2分)AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N—Al键、N—Ga键。下列说法错误的是 ( )A.GaN的熔点高于AlNB.晶体中所有化学键均为极性键C.晶体中所有原子均采取sp3杂化D.晶体中所有原子的配位数均相同
17. (2023全国乙,35,节选)(2)已知一些物质的熔点数据如下表:
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其 原因 。SiCl4的空间结构为 ,其中Si 的轨道杂化形式为 。
答案 NaCl为离子晶体,SiCl4为分子晶体,离子键比分子间作用力强 SiCl4、GeCl4、 SnCl4的相对分子质量增大,分子间作用力增强,则熔点逐渐升高 正四面体形 sp3
1. (2023重庆2月月考,1)下列说法正确的是 ( )A.含有金属元素的化合物一定是离子化合物B.完全由非金属元素组成的化合物可能是离子化合物C.ⅠA族和ⅦA族元素原子间只能形成离子键D.金属键只存在于金属单质中
2. (2023辽宁葫芦岛二模,2)下列符号表征不正确的是 ( )A.次氯酸的结构式:H—Cl—OB.H2分子中σ键的电子云轮廓图: C.H2S的VSEPR模型: D.MgCl2的形成过程:
3. (2024届江苏如皋期初考,5)许多过渡金属离子对多种配体有很强的结合力,能形成种类繁多的配合物。下列说法正确的是 ( )A.配合物[TiCl(H2O)5]Cl2·H2O不能与AgNO3溶液反应产生白色沉淀B.1 ml配合物Ni(CO)4中共有8 ml σ键C.配合物[Cu(NH3)4]SO4·H2O的配体为NH3和S D.配合物[Ag(NH3)2]OH的配位数为6
4. (2023北京顺义二模,7)S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法不正确 的是( )A.结构式为Cl—S—S—ClB.是含有极性键的非极性分子C.与S2Br2结构相似,熔、沸点:S2Br2>S2Cl2D.与水反应的化学方程式可能为2S2Cl2+2H2O SO2↑+3S↓+4HCl
5. (2024届黑龙江哈尔滨师范大学附中开学考,12)As2O3(砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成AsCl3,AsCl3和LiAlH4反应的产物之一为AsH3。下列 说法错误的是( )A.As2O3分子中As原子的杂化方式为sp3B.AsCl3的分子空间结构为平面正三角形C.Al 的VSEPR模型是四面体形D.AsH3分子的键角小于109°28'
6. (2023吉林长春三模,9)SO3有多种结构变体,气态时主要以单分子存在,固态时分子有三种变体,其中γ-SO3和β-SO3分子结构如图所示。下列说法错误的是 ( )
A.气态SO3分子空间结构为平面三角形B.γ-SO3中a对应的键长比b对应的键长短C.γ-SO3和β-SO3中硫原子均采取sp3杂化D.β-SO3形成的固体中作用力只有共价键
7. (2024届河北邯郸三模,2)“超分子”已经在很多领域广泛应用。下列关于超分子的说法正确的是 ( )
A.冠醚的空穴结构对离子有选择作用,在有机反应中可作催化剂,图甲中K+与冠醚形 成离子键B.杯酚具有“分子识别”特征,图乙中杯酚与C60形成氢键C.可燃冰(图丙)可看作由水和甲烷等分子通过非共价键形成的超分子,硫化氢分子间 也能通过与水分子间类似的相互作用形成分子笼D.烷基磺酸钠在水中聚集形成的胶束(图丁),这反映了超分子的“自组装”特征
8. (2024届江西乐安二中开学考,6)下列关于晶体的说法,不正确的是 ( )
①晶体中粒子呈周期性有序排列,有自范性,而非晶体中粒子排列相对无序,无自范性; ②含有金属阳离子的晶体一定是离子晶体;③共价键可决定分子晶体的熔、沸点;④ MgO和NaCl两种晶体中,MgO的离子键弱,熔点比较低;⑤晶胞是晶体结构的基本单元, 晶体内部的微粒按一定规律作周期性重复排列;⑥晶体尽可能采取紧密堆积方式,以 使其变得比较稳定;⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻A.①②③ B.②③⑦ C.④⑤⑥ D.②③④
9. (2024届河南开封高级中学质检一,12)下列有关晶体的说法不正确的是 ( )
A.图中所示的四种物质中,熔点最低的是冰B.每个Cu晶胞中平均含有4个铜原子C.在NaH晶胞中,距离Na+最近且等距的Na+的个数为12D.钛酸钡晶胞中,Ba2+的配位数为4
10. (2023辽宁大连二模,14)FeS2具有良好的半导体性能,如图给出了立方FeS2晶胞中的Fe2+和位于晶胞体心的 (晶胞中的其他 已省略)。下列叙述正确的是 ( )A.Fe2+的最高能层的电子排布式为3d6B.基态Fe2+共有24种不同空间运动状态的电子C.FeS2晶胞中距离每个 最近的 有8个D.晶胞中Fe2+位于 所形成的正八面体的体心
11. (2024届湖北武汉部分学校9月调研,13)为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。公告自2023年8月1日起正式实施。镓的某种 化合物的晶胞结构如图所示(晶胞参数为a pm,NA为阿伏加德罗常数的值),下列说法正 确的是 ( )
A.Ga元素位于周期表的ds区B.晶体结构中N的配位数为4
C.该物质的化学式为GaN2D.该晶体的密度为 ×10-27g/cm3
1. (2023上海普陀二模,8)下列化合物中,含非极性共价键的极性分子是 ( )A.CH2 CH2 D.Na2O2
2. (2023重庆南开中学三诊,7,改编)CCl4是一种重要的有机溶剂,其工业制备原理为CS2+3Cl2 CCl4+S2Cl2。下列说法正确的是( )A.CS2和CCl4中的C原子杂化方式均为sp3B.CS2和CCl4分子的空间结构分别是V形和正四面体C.CS2为非极性分子D.液态Cl2挥发时主要破坏共价键
3. (2024届江西宁冈中学开学考,8)氨硼烷(NH3·BH3)是一种高性能固体储氢材料,在催化剂作用下可发生如下反应:3NH3·BH3+6H2O 3N +B3 +9H2↑。已知B3 结构如图所示。下列说法正确的是( )
A.NH3与H3O+具有相似的空间结构B.NH3·BH3中的“·”表示的作用力为氢键C.B3 中各原子均满足最外层8e-稳定结构D.反应前后,B原子的杂化方式未发生改变
4. (2024届重庆渝中期中,7)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂,如化合物Ⅰ、Ⅱ(结构如图)。例如,化合物Ⅰ可与氧化汞生成化合物Ⅲ。下列说 法正确的是 ( ) A.Ⅰ中S原子和O原子均采用sp3杂化 B.Ⅰ中S元素的电负性最大C.Ⅱ中只含共价键 D.Ⅲ中C—C—C的键角为180°
5. (2024届湖北黄冈9月调研,6)下列微粒的空间结构,用杂化轨道理论解释正确的是( )
6. (2023山东烟台二模,16,节选)硅材料和铝材料在生产生活中应用广泛。回答下列问题:(2)N(SiH3)3是一种高介电常数材料。已知:N(SiH3)3中Si—N—Si键角为120°,N(CH3)3中 C—N—C键角为111°。共价键的极性:Si—N C—N(填“>”“=”或“<”)。 下列划线原子与N(SiH3)3中N原子杂化类型相同的是 (填标号)。A.Al(OCH3)3 B.NH3·BH3C.N(CH3)3 D.NH4NO3
7. (2023北京清华附中三模,4)汽车尾气中的CO、NOx、硫氧化物、乙烯、丙烯等碳氢化合物会引起光化学烟雾、酸雨等污染问题;汽油抗震添加剂四乙基铅(熔点为-1 36 ℃,极易挥发)的排放严重危害人体中枢神经系统。汽车尾气净化装置可将污染物 中的CO和NO转化为无害气体CO2和N2。下列有关说法正确的是 ( )A.SO2和SO3中的键角相等B.丙烯中C原子为sp2杂化C.N2中σ键和π键数目之比为1∶2D.固态四乙基铅为离子晶体
8. (2023河北唐山三模,3)侯德榜联合制碱法的原理之一是NH3+CO2+NaCl+H2O NH4Cl+NaHCO3↓。下列关于该原理涉及的物质说法正确的是 ( )A.NH4Cl的电子式为 B.CO2、N 、H2O中心原子均为sp3杂化C.键角的大小顺序为CO2>N >NH3>H2OD.NaCl晶胞中Cl-的配位数是12
9. (2024届湖北武汉武钢三中7月月考,7)溶液中Fe3+和SCN-可形成配离子[Fe(SCN)(H2O)3]2+,其中Fe、C、N三种原子不在一条直线上。下列关于该配离子的说法正确的 是 ( )A.存在极性共价键和离子键B.C的杂化方式为sp3C.Fe3+的配位数为5D.[Fe(SCN)(H2O)3]2+中H—O—H的键角大于配位前水分子中该键角
10. (2024届辽宁金州高级中学期中,14)已知一氯乙烯(C2H3Cl)分子中,C的一个sp2杂化轨道与Cl的3px轨道形成C—Cl σ键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子 的大π键( )。下列粒子中,含有 的是 ( )A.C B.N C.O3 D.S
11. (2023河北邯郸一模,11)大多数离子液体含有体积很大的阴、阳离子。某离子液体结构如图所示,其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同 主族。该物质可通过以物质M( ,含有大π键,表示为 ,n为参与形成大π键的原子个数,m为参与形成大π键的电子个数)为原料合成得到。下列说法正确的是 ( )
A.第一电离能:Y>X>ZB.X2Y2分子为直线形分子C.M分子中存在的大π键为 D.电负性:X>Y>Z
12. (2024届湖南永州一中开学考,4)下列有关物质结构和性质的说法正确的是 ( )A.含有极性键的分子叫做极性分子B.邻羟基苯甲酸的沸点高于对羟基苯甲酸的沸点C.金属能导电是因为金属晶体中的金属阳离子在外加电场作用下可定向移动D.甲醇可与水以任意比互溶是因为醇分子与水分子间形成了氢键
13. (2024届江西景德镇一检,5)下列有关C、N、O三种元素及其相关化合物的结构与性质说法错误的是 ( )A.第一电离能:C
微专题 晶胞结构分析与计算
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3B.图1中O原子的配位数为6C.图2表示的化学式为LiMg2OClxBr1-xD.Mg2+取代产生的空位有利于Li+传导
2. (2023河北,11,3分)锆(Zr)是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,NA为阿伏加德罗常数的值。下列说法错误的是 ( )
B.该氧化物的密度为 g·cm-3C.Zr原子之间的最短距离为 a pmD.若坐标取向不变,将p点Zr原子平移至原点,则q点Zr原子位于晶胞xy面的面心
A.该氧化物的化学式为ZrO2
3. (2024届湖北武汉部分重点高中8月月考,15)立方砷化硼(BAs)是一种优良的半导体材料,BAs的晶胞结构如图所示:
若晶胞参数为a pm,阿伏加德罗常数的值为NA,下列有关说法错误的是 ( )A.BAs晶体中存在着配位键B.1号砷原子的坐标为( , , )C.晶胞中As原子与B原子的最近距离为 a pmD.晶体BAs的摩尔体积为a3NA×10-36 m3/ml
4. (2024届山西怀仁一中开学考,12)某种太阳能材料CuInSx晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知A处In原子坐标为(0.5,0,0.25),B处 Cu原子坐标为(0,0.5,0.25)。阿伏加德罗常数的值为NA。下列说法正确的是 ( )
B.CuInSx中的x=4C.CuInSx晶体中,D处Cu原子周围紧邻且距离相等的Cu原子共有6个D.CuInSx晶体的密度为 ×1030 g·cm-3
A.C处S原子坐标为(0.75,0.5,0.625)
5. (2024届安徽巢湖一中10月月考,13)一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知MP=QR,用NA表示阿伏加德罗常数的值)。
下列说法正确的是 ( )A.基态47Ag失去4d能级上的一个电子转化为Ag+B.若N点原子分数坐标为( , ,0),则P点原子分数坐标为(0,0, )C.M、N之间的距离为 a×10-7 cmD.晶体的密度为 g·pm-3
6. (2023北京,15,10分)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2 )可看作是S 中的一个O原子被S原子取代的产物。(1)基态S原子价层电子排布式是 。(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由: 。(3)S2 的空间结构是 。(4)同位素示踪实验可证实S2 中两个S原子的化学环境不同,实验过程为S S2 Ag2S+S 。过程ⅱ中,S2 断裂的只有硫硫键,若过程ⅰ所用试剂是N SO3和35S,过程ⅱ含硫产物是 。
(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
答案 (1)3s23p4(2)O和S为同主族元素,S原子半径比O原子大,S原子更易电离出最外层的电子,第一电 离能比O原子小(3)四面体形(4)A S、32S (5)4 ×1021(6)S2 中中心S原子不能做配位原子,端基S原子能做配位原子;因为S2 中中心S原子无孤电子对,端基S原子有孤电子对
7. (2023福建龙岩三模,14,节选)(3)一种新型导电陶瓷材料硅的钨化物,其晶胞结构如图所示,硅原子的配位数为 。设NA为阿伏加德罗常数的值,则该硅的钨化物晶体的密度为 g/cm3(列出计算式)。
8. (2024届广东执信中学开学考,17,节选)(4)磷青铜是一种具有高耐腐蚀性、耐磨性的合金材料,广泛用于机械零件制造。磷青铜的晶胞结构如下图所示。
①该晶体的化学式为 。②若该晶胞的边长为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为 g/cm3(列出计算式)。
答案 ①Cu3SnP ②
9. (2023全国乙,35,节选)(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下图所示,晶胞中含有 个Mg。该物质化学式 为 ,B-B最近距离为 。
10. (2023全国甲,35,15分)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:(1)下图所示的几种碳单质,它们互为 ,其中属于共价晶体的是 ,C60间的作用力是 。
(2)酞菁和钴酞菁的分子结构如下图所示。
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 (填图中 酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤对 电子与钴离子形成 键。(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图a所示,二聚体中Al的轨 道杂化类型为 。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断 铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图b所示,F-的配位数 为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
答案 (1)同素异形体 金刚石 范德华力(2)③ +2 配位(3)sp3 离子 2 ×1030
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序 是 ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键 越强;(ⅱ) 。(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。(4)α-AgI晶体中I-离子作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、 八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,Α-AgI晶体在电池中可作为 。
已知阿伏加德罗常数为NA,则α-AgI晶体的摩尔体积Vm= m3·ml-1(列出算式)。
12. (2022全国甲,35,节选)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2 CH2)与四氟乙烯(CF2 CF2)的共聚物(ETFE)制成。回答下列问题:(2)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第 一电离能的变化图是 (填标号),判断的根据是 ;第三电离能的变化图是 (填标号)。
(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构 。(4)CF2 CF2和ETFE分子中C的杂化轨道类型分别为 和 ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因 。
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是 ;若该立方晶胞参数为a pm,正负离子的核间距最小为 pm。
答案 (2)a 同周期元素从左到右,第一电离能呈增大趋势,N原子的价电子排布式为2 s22p3,2p轨道是半充满稳定结构,第一电离能比O原子大 b(3)H—F…H—F…H—F(4)sp2 sp3 F的电负性比H大,C—F键的键能比C—H键的大(5)Ca2+ a
新高考化学复习专题八化学键分子和晶体的结构与性质教学课件: 这是一份新高考化学复习专题八化学键分子和晶体的结构与性质教学课件,共60页。
人教版高考化学一轮复习第4章物质结构与性质第3节化学键与分子结构及性质课件: 这是一份人教版高考化学一轮复习第4章物质结构与性质第3节化学键与分子结构及性质课件
人教版高考化学一轮复习限时集训18化学键与分子结构及性质课件: 这是一份人教版高考化学一轮复习限时集训18化学键与分子结构及性质课件,共53页。PPT课件主要包含了A组基础达标练,B组能力提升练等内容,欢迎下载使用。












