





所属成套资源:全套新高考化学一轮复习专题课件+练习含答案
新高考化学复习专题五金属及其化合物练习课件
展开
这是一份新高考化学复习专题五金属及其化合物练习课件,共60页。
考点1 钠、铁及其化合物
1. (2023浙江6月选考,3,3分)氯化铁是一种重要的盐,下列说法不正确的是 ( )A.氯化铁属于弱电解质B.氯化铁溶液可腐蚀覆铜板C.氯化铁可由铁与氯气反应制得D.氯化铁溶液可制备氢氧化铁胶体
2. (2023浙江6月选考,4,3分)物质的性质决定用途,下列两者对应关系不正确的是 ( )A.铝有强还原性,可用于制作门窗框架B.氧化钙易吸水,可用作干燥剂C.维生素C具有还原性,可用作食品抗氧化剂D.过氧化钠能与二氧化碳反应生成氧气,可作潜水艇中的供氧剂
3. (2023浙江1月选考,5,3分)下列关于元素及其化合物的性质说法不正确的是( )A.Na和乙醇反应可生成H2B.工业上煅烧黄铁矿(FeS2)生产SO2C.工业上用氨的催化氧化制备NOD.常温下铁与浓硝酸反应可制备NO2
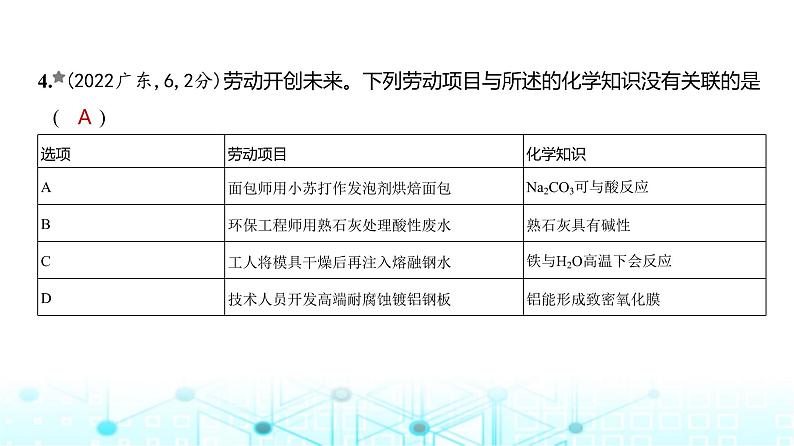
4. (2022广东,6,2分)劳动开创未来。下列劳动项目与所述的化学知识没有关联的是 ( )
5. (2022广东,14,4分)下列关于Na的化合物之间转化反应的离子方程式书写正确的是 ( )A.碱转化为酸式盐:OH-+2H++C HC +2H2OB.碱转化为两种盐:2OH-+Cl2 ClO-+Cl-+H2OC.过氧化物转化为碱:2 +2H2O 4OH-+O2↑D.盐转化为另一种盐:Na2SiO3+2H+ H2SiO3↓+2Na+
6. (2022浙江6月选考,22,2分)关于化合物FeO(OCH3)的性质,下列推测不合理的是 ( )A.与稀盐酸反应生成FeCl3、CH3OH、H2OB.隔绝空气加热分解生成FeO、CO2、H2OC.溶于氢碘酸(HI),再加CCl4萃取,有机层呈紫红色D.在空气中,与SiO2高温反应能生成Fe2(SiO3)3
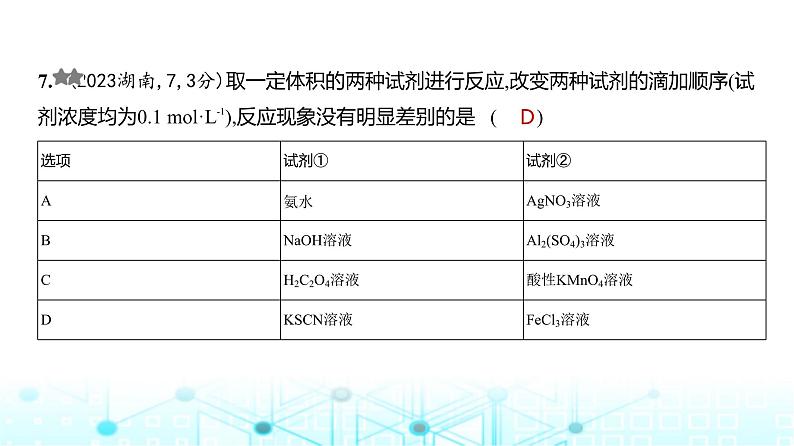
7. (2023湖南,7,3分)取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为0.1 ml·L-1),反应现象没有明显差别的是 ( )
8. (2022山东,11,4分)某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是 ( )
9. (2022海南,6,2分)依据下列实验,预测的实验现象正确的是 ( )
10. (2022广东,1,2分)中华文明源远流长,在世界文明中独树一帜,汉字厥功至伟。随着时代发展,汉字被不断赋予新的文化内涵,其载体也发生相应变化。下列汉字载体
主要由合金材料制成的是 ( )
考点2 金属资源的开发利用
11. (2023辽宁,3,3分)下列有关物质的工业制备反应错误的是 ( )A.合成氨:N2+3H2 2NH3B.制HCl:H2+Cl2 2HClC.制粗硅:SiO2+2C Si+2CO↑D.冶炼镁:2MgO 2Mg+O2↑
12. (2023福建,7,4分)从炼钢粉尘(主要含Fe3O4、Fe2O3和ZnO)中提取锌的流程如下:
“盐浸”过程ZnO转化为[Zn(NH3)4]2+,并有少量Fe2+和Fe3+浸出。下列说法错误的是( )A.“盐浸”过程若浸液pH下降,需补充NH3B.“滤渣”的主要成分为Fe(OH)3C.“沉锌”过程发生反应[Zn(NH3)4]2++4H2O+S2- ZnS↓+4NH3·H2OD.应合理控制(NH4)2S用量,以便滤液循环使用
13. (2022福建,6,4分)用铬铁合金(含少量Ni、C单质)生产硫酸铬的工艺流程如下:
下列说法错误的是 ( )A.“浸出”产生的气体含有H2B.“除杂”的目的是除去Ni、C元素C.流程中未产生六价铬化合物D.“滤渣2”的主要成分是Fe2(C2O4)3
14. (2022山东,12,4分)高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下
表。
下列说法错误的是 ( )A.固体X主要成分是Fe(OH)3和S,金属M为ZnB.浸取时,增大O2压强可促进金属离子浸出C.中和调pH的范围为3.2~4.2D.还原时,增大溶液酸度有利于Cu的生成
15. (2023湖南,9,3分)处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24。
下列说法错误的是 ( )A.“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3B.Na2S溶液呈碱性,其主要原因是S2-+H2O HS-+OH-C.“沉淀池Ⅱ”中,当Cu2+和Zn2+完全沉淀时,溶液中 =4.0×10-12D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
16. (2022湖南,7,3分)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是 ( )A.不宜用陶瓷作吸收塔内衬材料B.采用溶液喷淋法可提高吸收塔内烟气吸收效率C.合成槽中产物主要有Na3AlF6和CO2D.滤液可回收进入吸收塔循环利用
17. (2023重庆,15,14分)Fe3O4是一种用途广泛的磁性材料,以FeCl2为原料制备Fe3O4并获得副产物CaCl2水合物的工艺如下。
25 ℃时各物质溶度积见下表:
回答下列问题:(1)Fe3O4中Fe元素的化合价是+2和 。O2-的核外电子排布式为 。(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是
。(3)反应釜2中,加入CaO和分散剂的同时通入空气。
①反应的离子方程式为 。②为加快反应速率,可采取的措施有 (写出两项即可)。(4)①反应釜3中,25 ℃时,Ca2+浓度为5.0 ml/L,理论上pH不超过 。②称取CaCl2水合物1.000 g,加水溶解,加入过量Na2C2O4,将所得沉淀过滤洗涤后,溶于
热的稀硫酸中,用0.100 0 ml/L KMnO4标准溶液滴定,消耗24.00 mL。滴定达到终点的
现象为 ,该副产物中CaCl2的质量分数为 。
答案 (1)+3 1s22s22p6 (2)Fe2+易被氧化,得不到Fe(OH)2 (3)①4CaO+6H2O+4Fe2++O2
4Fe(OH)3+4Ca2+ ②适当升高温度、搅拌等合理答案 (4)①11 ②加入最后半滴KMnO4标准溶液后,溶液变为浅红色,且半分钟内不变色 66.6%
18. (2023福建,11,20分)白合金是铜钴矿冶炼过程的中间产物,一种从白合金(主要含Fe3O4、CO、CuS、Cu2S及少量SiO2)中分离回收金属的流程如下:
(1)“酸浸1”中加快反应速率的措施有 (任写一种)。CO发生反应
的离子方程式: 。(2)“焙烧1”中,晶体[Fe2(SO4)3·xH2O和CSO4·yH2O]总质量随温度升高的变化情况如下:
①升温至227 ℃过程中,晶体总质量变小的原因是 ;566~600 ℃发生分解的物质是 (填化学式)。
②为有效分离铁、钴元素,“焙烧1”的温度应控制为 ℃。(3)25 ℃时,Ksp(CuS)=6.3×10-36,H2S的 =1.1×10-7, =1.3×10-13。反应CuS(s)+2H+(aq) Cu2+(aq)+H2S(aq)的平衡常数K= (列出计算式即可)。经计算可判断CuS难溶于稀硫酸。(4)铜的硫化物结构多样。天然硫化铜俗称铜蓝,其晶胞结构如图。
①基态Cu2+的价电子排布式为 。②晶胞中含有 个 ,N(Cu+)∶N(Cu2+)= 。③晶体中微粒间作用力有 (填标号)。a.氢键 b.离子键 c.共价键 d.金属键(5)“焙烧2”中Cu2S发生反应的化学方程式为 ;
“滤渣2”是 (填化学式)。
答案 (1)将白合金粉碎,搅拌,适当提高酸的浓度,适当提高温度等任写1条 CO+2H+
C2++H2O (2)①晶体失去结晶水 Fe2(SO4)3 ②600 (3) (4)①3d9 ②2 2∶1(或4∶2或2) ③bc (5)Cu2S+2O2 2CuO+SO2 SiO2
19. (2023河北,16,14分)闭环循环有利于提高资源利用率和实现绿色化学的目标。利用氨法浸取可实现废弃物铜包钢的有效分离,同时得到的CuCl可用于催化、医药、
冶金等重要领域。工艺流程如下:
已知:室温下的Ksp(CuCl)=10-6.8。回答下列问题:(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成
分为 (填化学式)。(2)滤渣的主要成分为 (填化学式)。(3)浸取工序的产物为[Cu(NH3)2]Cl,该工序发生反应的化学方程式为
。浸取后滤液的一半经氧化工序可得深蓝色溶液①,氧化工序发生反
应的离子方程式为 。(4)浸取工序宜在30~40 ℃之间进行。当环境温度较低时,浸取液再生后不需额外加热
即可进行浸取的原因是 。
(5)补全中和工序中主反应的离子方程式[Cu(NH3)2]++2H++Cl- + 。(6)真空干燥的目的为 。
1. (2024届广东执信中学开学考,6)下列有关金属的说法中正确的是 ( )A.常温下Cu和浓H2SO4反应生成CuSO4B.实验室可用氧化铝坩埚熔化NaOH、Na2CO3固体C.镁不慎着火,可用CO2灭火D.实验结束后剩余的金属钠不能随意丢弃,应放回原试剂瓶中
2. (2023北京丰台二模,5)已知2Na+O2 Na2O2。下列说法不正确的是 ( )A.钠在空气中燃烧,产生黄色火焰,生成淡黄色固体B.Na2O2中含有离子键和非极性共价键C.Na2O2中阴、阳离子个数比为1∶1D.Na2O2可作供氧剂,与CO2反应过程中每生成1 ml O2转移2 ml e-
3. (2024届辽宁沈阳二中开学考,1)下列“类比”“推理”合理的是 ( )A.Fe与Cl2反应生成FeCl3,则Fe与I2反应生成FeI3B.CaO与CO2反应生成CaCO3,CuO与CO2反应生成CuCO3C.在Na2O2与水反应后的溶液中加入MnO2粉末,会产生大量气体,该气体能使带火星的
木条复燃,则可推测Na2O2与水反应有中间产物H2O2生成D.Na与水反应生成NaOH和H2,则Fe与水蒸气反应生成Fe(OH)3和H2
4. (2024届湖北武汉六中月考,4)月球土壤中富含铁元素,主要以单质Fe和Fe2+的形式存在,但嫦娥五号取回的微陨石撞击处的月壤样品中存在大量的Fe3+,这有可能是以
下哪个原因造成的 ( )A.4FeO Fe+Fe3O4 B.Fe3O4 Fe2O3+FeOC.4FeO+O2 2Fe2O3 D.Fe2O3+FeO Fe3O4
5. (2024届四川泸县一中开学考,10)某同学欲利用下图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且所用蒸馏水先加热煮沸。下列说法正确的是
( )
A.X可以是稀硫酸或稀硝酸或稀盐酸B.实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入XC.反应一段时间后可在烧瓶中观察到白色沉淀D.反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
6. (2024届福建厦门一中开学考,8)在FeCl3、CuCl2混合溶液中,加入铁粉与铜粉的混合物,下列说法错误的是 ( )A.若金属无剩余,则溶液中一定存在的金属阳离子有Fe2+、Cu2+,可能存在的有Fe3+B.若剩余固体中有铁和铜,则溶液中一定存在的金属阳离子有Fe2+,一定不存在Cu2+、Fe3+C.若剩余固体中只有铜,则溶液中一定存在的金属阳离子有Fe2+,可能存在的有Cu2+、Fe3+D.实验中,不会出现剩余固体中只有铁的情况
7. (2024届云南师大附中开学考,8,改编)工业冶炼下列金属,采用的化学原理正确的是( )A.钠:2NaCl(溶液) 2Na+Cl2↑B.锰:3MnO2+4Al 3Mn+2Al2O3C.钙:CaO+C Ca+CO↑D.汞:HgS Hg+S
8. (2023山西大同三模,7)《吕氏春秋》二十五卷中记载了铜锡合金的性质:“金(即铜单质)柔锡(即锡单质)柔,合两柔则为刚(即坚硬),燔(灼烧)之则为淖(液体)”。铜、锡
和铜锡合金的熔点如下表所示:
下列说法错误的是 ( )A.铜锡合金是青铜器的主要成分B.铜锡合金的熔点较低,比其成分金属易熔化C.铜锡合金比纯铜有更好的抗腐蚀性D.铜锡合金的硬度比纯铜的高
9. (2024届四川成都七中零诊,8)下列关于Fe、Cu、Mg、Al四种金属元素的说法中不正确的是( )A.四种元素的单质只有三种能和盐酸反应,生成相应的盐和氢气B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法C.将Mg棒和Al棒作为原电池的两个电极插入NaOH溶液中,Mg棒上发生氧化反应D.铁锈的主要成分是氧化铁,铜锈的主要成分是碱式碳酸铜
10. (2024届重庆八中开学考,14)用镁还原TiCl4可制取高熔点的金属钛,工艺流程如图。下列说法不正确的是 ( )
11. (2024届河北保定期中,11)金属铬(Cr)常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4(亚铬酸亚铁)制备Cr的流程如下。下列说法错误的是 ( )
12. (2024届山东烟台期中,13)以Pd(NH3)2Cl2固体为原料制备纯PdCl2,其部分实验过程如下:
已知:①Pd(NH3)2Cl2+2HCl (NH4)2[PdCl4];②H2PdCl4+4NaOH Pd(OH)2↓+4NaCl+2H2O,Pd(OH)2有两性,Ksp[Pd(OH)2]=10-31;③Pd2++4NH3·H2O [Pd(NH3)4]2++4H2O K=1032.8。下列说法错误的是 ( )A. “酸溶”后再“氧化”可提高氧化速率B. “氧化”过程中可能有Cl2生成C. Pd(OH)2既能溶于NaOH溶液又能溶于氨水D. “氧化”不充分,“沉钯”时所得Pd(OH)2的产率无影响
13. (2024届福建漳州质检一,9)工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯(Pd),采用如下流程:
已知:“酸溶Ⅱ”的主要反应:3Pd+12HCl+2HNO3 3H2PdCl4+2NO↑+4H2O。
下列说法错误的是 ( )A.“酸溶Ⅰ”的目的是除去铁、锌等杂质B.为加快酸溶速率,“酸溶Ⅱ”需要高温条件C.调节pH使溶液显碱性可以减少甲醛的损耗D.溶液Ⅰ可能含有HCOO-
14. (2023河北唐山二模,16)海水中提取镁的工艺流程如下:
(1)该工艺流程中属于分解反应的有 个,请写出其中属于氧化还原反应的化学方程式 。(2)MgCl2·6H2O脱水得到MgCl2的过程中,通入HCl的作用是 。(3)25 ℃时,在沉镁过程中,将MgCl2溶液滴加到Ca(OH)2悬浊液中,当混合溶液pH=12时,
同时存在Ca(OH)2、Mg(OH)2两种沉淀,则此时溶液中c(Ca2+)∶c(Mg2+)= 。判
断此时Mg2+ (填“是”或“否”)完全沉淀。已知:Ksp[Ca(OH)2]=4.8×10-6,Ksp[Mg(OH)2]=6.0×10-12,当某离子浓度降到1×10-5 ml·L-1以下时,认为该离子已经完全沉淀。(4)新工艺向含氧化镁熔浆中添加三氯化铈(CeCl3)和氯气反应,生成CeO2和无水氯化
镁。请写出该反应的化学方程式 。(5)某实验小组对MgCl2·6H2O进行热重曲线分析:
①分析181 ℃时固体产物的化学式为 。②写出230~300 ℃时生成固体产物(一种含镁的碱式盐)的化学方程式
。
1. (2024届吉林长春外国语开学考,18)比亚迪推出的“刀片电池”正极材料为LiFePO4。利用LiFePO4废料(带铝箔)回收Li、Al、Fe、P元素的工业模拟过程如下:
下列说法错误的是 ( )A.LiFePO4中Fe为+2价B.产品1主要成分为Al(OH)3C.步骤③发生反应2Fe2++H2O2+2H+ 2Fe3++2H2OD.④、⑥两步加入Na2CO3产生沉淀的原理相同
2. (2023辽宁,16,14分)某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、C2+、Fe2+、Fe3+、Mg2+和Mn2+)。实现镍、钴、镁元素的回收。
回答下列问题:(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为 (答出一条即
可)。(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO
5),1 ml H2SO5中过氧键的数目为 (用NA表示)。(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(H2SO5的电离第一步完全,第二步微弱);滤
渣的成分为MnO2、 (填化学式)。(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分
数为 时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小
的原因是 。
(5)“沉钴镍”中得到的C(Ⅱ)在空气中可被氧化成CO(OH),该反应的化学方程式为 。(6)“沉镁”中为使Mg2+沉淀完全(25 ℃),需控制pH不低于 (精确至0.1)。
3. (2023安徽合肥一模,16)一种从铜阳极泥(主要成分有Se、Ag2Se、Cu2Se等,还含有少量的Au、Pt等贵金属)中提取Se,同时回收Ag和Cu的工艺流程如下图所示。
已知:①硒的沸点为685 ℃,在空气中加热时会被氧化。②在该工艺条件下,有关金属
离子开始沉淀和恰好沉淀完全的pH如下表:
回答下列问题:(1)为了提高“浸出”效果,可采取的措施有 (写出一种合理措施);浸出渣
的主要成分是 。(2)工业上铜阳极泥还可以用浓硫酸浸出,从产物角度分析其缺点是
。(3)铜阳极泥中的硒元素主要以Se 形式留在浸出液中,写出Se单质在“浸出”时反应的离子方程式: 。(4)“沉硒”所得粗硒可采用真空蒸馏的方法提纯,采用真空蒸馏的目的是
。
(5)加入NaOH进行“沉铜”处理,调节溶液pH的范围是 。(6)已知:常温下,[Ag(S2O3)2]3-(aq) Ag+(aq)+2S2 (aq) K1=2.7×10-14,AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10。“溶浸”时发生反应的离子方程式为AgCl+2S2 [Ag(S2O3)2]3-+Cl-。常温下,该反应的平衡常数K= 。(7)“还原”时,工业上常用HCHO在碱性条件下还原[Ag(S2O3)2]3-得到Ag,反应后所得
滤液3可进入 操作中循环利用(填流程中操作名称)。
4. (2023全国甲,26,14分)BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备粉状BaTiO3。
回答下列问题:(1)“焙烧”步骤中碳粉的主要作用是 。(2)“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS。“浸取”时主
要反应的离子方程式为 。(3)“酸化”步骤应选用的酸是 (填标号)。a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸(4)如果焙烧后的产物直接用酸浸取,是否可行?其原因是
。
(5)“沉淀”步骤中生成BaTiO(C2O4)2的化学方程式为 。(6)“热分解”生成粉状钛酸钡,产生的 ∶nCO= 。
5. (2023河南郑州三模,26)砷酸铜是一种蓝色粉末,难溶于水和酒精,广泛应用于木材防腐剂。某化工厂以硫化砷废渣(主要成分为As2S3,含少量的Sb、Bi)为原料制备砷
酸铜的工艺流程如图所示:
请回答下列问题:(1)Cu3(AsO4)2中As的化合价为 。(2)“粉碎”的目的是 。(3)“碱浸”时,在加热条件下As2S3中硫元素被氧化为S ,反应的离子方程式为 。(4)“沉砷”后滤液中主要含有 ,该物质可循环利用到 步骤中。(5)“滤渣”的成分是 。(6)“转化”时发生反应的化学方程式为 。(7)该化工厂实验员称取100 g硫化砷废渣(As2S3质量分数为73.8%),粉碎后通空气并加
入NaOH溶液,得到1 L的悬浊液,测得碱浸后的滤液中Na3AsO4的浓度为0.45 ml·L-1,该
实验员检测的砷的浸出率为 。
6. (2023北京,18,13分)以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下, MnO2的氧化性强于Fe3+。(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续
银的浸出;矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应MnS+2H+ Mn2++H2S↑,则可推断:Ksp(MnS) Ksp(Ag2S)(填“>”或“
相关课件
这是一份浙江版高考化学复习专题五金属及其化合物教学课件,共35页。
这是一份新高考化学复习专题六非金属及其化合物练习课件,共51页。
这是一份新高考化学复习专题五金属及其化合物教学课件,共55页。









