




所属成套资源:全套新高考化学一轮复习专题课件+练习含答案
新高考化学复习专题六非金属及其化合物教学课件
展开
这是一份新高考化学复习专题六非金属及其化合物教学课件,共60页。
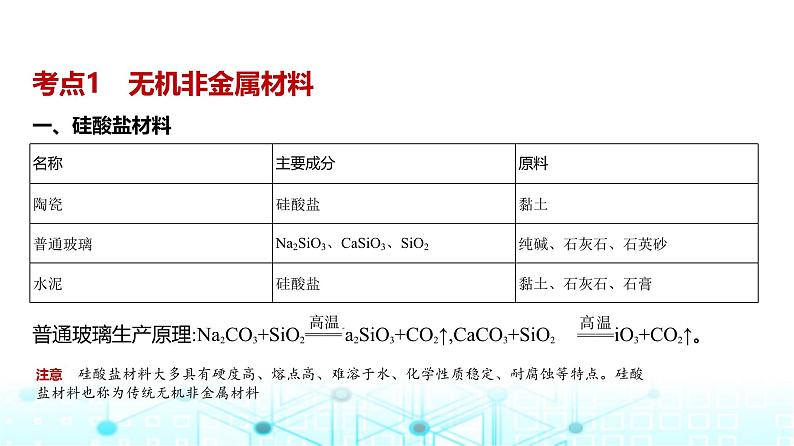
考点1 无机非金属材料一、硅酸盐材料
普通玻璃生产原理:Na2CO3+SiO2 Na2SiO3+CO2↑,CaCO3+SiO2 CaSiO3+CO2↑。
注意 硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。硅酸盐材料也称为传统无机非金属材料
二、新型无机非金属材料1.硅(1)制备:SiO2+2C Si(粗硅)+2CO↑,Si+3HCl SiHCl3+H2,SiHCl3+H2 Si+3HCl。(2)用途:①作半导体材料;②用于太阳能电池;③用于制芯片。
2.二氧化硅(1)存在形式:石英、水晶、玛瑙、沙子等。(2)化学性质①酸性氧化物:SiO2+2NaOH Na2SiO3+H2O(盛有碱性物质的试剂瓶要用橡胶塞,不能用玻璃塞)。②能与氢氟酸反应:SiO2+4HF SiF4↑+2H2O。注意 氢氟酸为弱酸。(3)用途:制作光导纤维、化学仪器、光学仪器、钟表部件等。
3.新型陶瓷:高温结构陶瓷、压电陶瓷、透明陶瓷、超导陶瓷等。碳化硅(SiC)俗称金刚砂,硬度大、耐高温。4.碳纳米材料:富勒烯、碳纳米管、石墨烯等。
考点2 卤族元素 海水资源的开发利用一、氯气1.物理性质:黄绿色、有刺激性气味的气体;密度比空气大;可溶于水,25 ℃时,1体积水
可溶解约2体积氯气。2.化学性质
注意 ①氯气与变价金属反应时,一般生成高价金属氯化物。②氯气有毒。
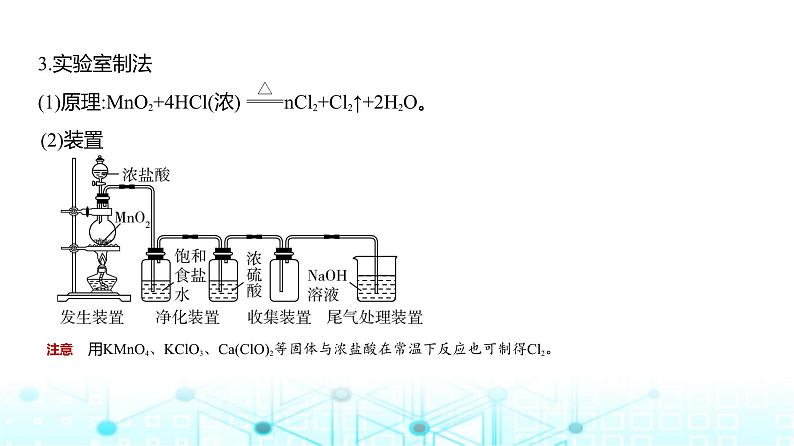
3.实验室制法(1)原理:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
注意 用KMnO4、KClO3、Ca(ClO)2等固体与浓盐酸在常温下反应也可制得Cl2。
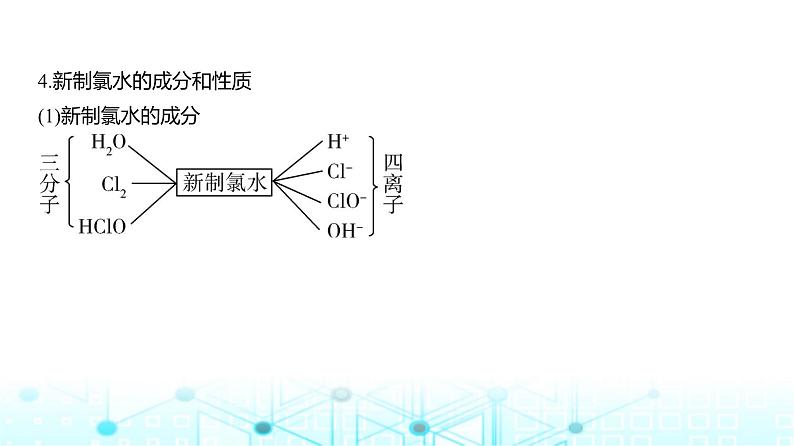
4.新制氯水的成分和性质
(1)新制氯水的成分
(2)新制氯水中平衡移动的应用
(3)新制氯水性质的多重性——微粒性质的综合体现
二、氯的化合物1.次氯酸
2.次氯酸盐(1)漂白液
三、卤素单质(X2)的性质1.相似性①都能与大多数金属反应生成金属卤化物,如和铁反应生成FeX3(I2除外,生成FeI2);
②都能与H2反应生成HX;③都能与H2O或碱发生歧化反应(F2除外)。2.递变性(按F2、Cl2、Br2、I2的顺序)①颜色逐渐加深,熔、沸点逐渐升高,密度逐渐增大;②单质氧化性(与H2反应的难易程度)逐渐减弱,X-的还原性逐渐增强。
3.特殊性氟:氟元素无正价,是非金属性最强的元素。单质与水反应:2F2+2H2O 4HF+O2。溴:常温下唯一呈液态的非金属单质,易挥发且有毒,液封保存。碘:易升华,淀粉遇I2变蓝。I2易与Na2S2O3溶液反应:I2+2S2 2I-+S4 ,这一反应常用于定量分析。
知识拓展卤素互化物和拟卤素①卤素互化物由两种卤素互相结合而成的物质叫卤素互化物,如IBr、ICl、BrF3、ClF3。卤素互化物
与卤素单质的性质相似,有较强的氧化性,能与金属反应,如2Mg+2IBr MgBr2+MgI2。卤素互化物中,非金属性弱的元素显正价,如ICl中,I显+1价,Cl显-1价,所以卤素互化
物与水或碱的反应一般属于非氧化还原反应,如IBr+H2O HBr+HIO,IBr+2NaOH NaBr+NaIO+H2O。
②拟卤素有些由多原子分子构成的物质与卤素单质性质相似,其阴离子与卤素阴离子性质相似,如氰(CN)2、硫氰(SCN)2、氧氰(OCN)2。遇到这些物质时可用换元法,如把(SCN)2当作X2,把SCN-当作X-,来推测它们的性质。
四、卤素离子的检验1.沉淀法:向未知液中滴加AgNO3溶液和稀硝酸,若生成白色沉淀,则有Cl-;若生成浅黄
色沉淀,则有Br-;若生成黄色沉淀,则有I-。2.置换—萃取法:向未知液中加适量新制饱和氯水振荡后,再加入CCl4振荡,若有机层呈
红棕色或橙红色,则有Br-;若有机层呈紫红色,则有I-。
3.置换—淀粉法检验I-:向未知液中先加入淀粉溶液,不变蓝,然后加适量新制饱和氯水振荡后,溶液变蓝,则有I-。
五、海水资源的开发利用1.氯碱工业海水→粗盐 饱和食盐水 反应原理:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
反应原理:①Cl2+2Br- 2Cl-+Br2,②Br2+SO2+2H2O H2SO4+2HBr,③2HBr+Cl2 2HCl+Br2。
反应原理:2I-+Cl2 2Cl-+I2。
考点3 硫及其化合物一、硫单质1.物理性质:黄色固体,质脆,难溶于水,微溶于酒精,易溶于CS2。2.化学性质
注意 硫有多种同素异形体,如正交硫、单斜硫。
二、二氧化硫1.物理性质:无色、有刺激性气味的气体,密度比空气大;易溶于水,1体积水约溶解40体
积SO2。2.化学性质
3.用途:①漂白剂(漂白纸浆、毛、丝等);②杀菌消毒;③食品添加剂(用在红酒、干果中等)。归纳总结 SO2、CO2同时存在时的检验流程,先检验SO2,然后除尽SO2,最后检验CO2。
三、硫酸1.物理性质:无色油状液体,密度比水大,沸点高,难挥发。2.化学性质稀硫酸:具有酸的通性。浓硫酸:三大特性——吸水性、脱水性、强氧化性。
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2OC+2H2SO4(浓) 2SO2↑+CO2↑+2H2O常温下,浓硫酸可使Fe、Al钝化。注意原电池以及与阿伏加德罗常数相关的考题,同时注意钝化是化学变化。
反应原理及设备:Ⅰ.4FeS2+11O2 2Fe2O3+8SO2 沸腾炉Ⅱ.2SO2+O2 2SO3 接触室Ⅲ.SO3+H2O H2SO4 吸收塔
4.硫酸根离子的检验(1)原理:Ba2++S BaSO4↓。(2)方法:待测液 取清液 有无白色沉淀(确定有无S )。(3)加盐酸目的:防止C 、S 、Ag+等的干扰。
考点4 氮及其化合物 环境保护与绿色化学一、氮元素的存在形式和固氮
二、氮气1.结构:电子式为 ,结构式为 。2.氮气的性质(1)物理性质:无色无味的气体,密度比空气略小,难溶于水。(2)化学性质
3.氮的氧化物(1)一氧化氮和二氧化氮
(2)其他氮氧化物:主要有N2O、N2O3、N2O4、N2O5等。(3)污染:①光化学烟雾;②酸雨。注意 NO2能与N2O4相互转化:2NO2 N2O4,由于此平衡的存在,通常所说的NO2气体实际上是NO2和N2O4的混合气体。例如2 ml NO与1 ml O2充分反应,由于生成的NO2部分转化为N2O4,故实际所得的NO2少于2 ml。
三、硝酸1.物理性质:无色、有刺激性气味的液体,易挥发。2.化学性质
反应原理:①4NH3+5O2 4NO+6H2O;②2NO+O2 2NO2;③3NO2+H2O 2HNO3+NO。四、氨及铵盐1.NH3(1)结构:电子式为 ,分子空间结构为三角锥形。(2)物理性质:无色、有刺激性气味的气体;密度比空气小,易液化,极易溶于水(1体积水
约溶解700体积氨气)。(3)化学性质
3.制法NH3 NO NO2 HNO3
NH3是唯一能使湿润的红色石蕊试纸变蓝的气体(高中阶段),常用此性质检验NH3。(4)制法①实验室制法原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。装置如下图所示:
注意 可用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒验满。欲快速制取NH3可将
浓氨水滴到NaOH固体或生石灰上。②工业制法:N2+3H2 2NH3。(5)喷泉实验①原理:短时间内,体系内外产生较大的压强差。②常见形成喷泉的气体和液体组合HCl气体和水/NaOH溶液,NH3和水/酸溶液,酸性气体和NaOH溶液,NO2和水。2.铵盐(1)物理性质:一般为白色、易溶于水的晶体。
(2)化学性质与碱反应:N +OH- NH3↑+H2O受热分解:NH4Cl NH3↑+HCl↑NH4HCO3 NH3↑+CO2↑+H2O水解反应:N +H2O NH3·H2O+H+(3)检验:样品与NaOH溶液共热,用湿润的红色石蕊试纸检验,观察试纸是否变蓝。
五、环境保护和绿色化学1.环境污染与保护
2.绿色化学(1)核心:利用化学原理从源头上减少或消除工业生产对环境造成的污染。(2)原子经济性目标:原子利用率达100%(原子利用率= ×100%)。注意 在化学反应中,化合反应与加成反应的原子利用率为100%。
1.判断正误(正确的打“√”,错误的打“×”)。(1)晶体硅熔点高、硬度大,故可用于制作半导体材料。 ( )(2)传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐。 ( )(3)氯气可使湿润的红布条褪色,所以氯气具有漂白性。 ( )(4)漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的。 ( )(5)利用高沸点酸可以制备低沸点酸,如可用浓硫酸和碘化钠制备碘化氢。 ( )(6)SO2气体通入BaCl2溶液中产生白色沉淀BaSO3。 ( )(7)SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好。( )
(8)SO2具有还原性,浓硫酸具有强氧化性,因此不能用浓硫酸干燥SO2。 ( )(9)向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明原溶液中一定有S 。( )(10)固氮反应一定属于氧化还原反应。( )
2.下列有关说法中错误的是 ( )A.氢氟酸不能盛放在玻璃试剂瓶中B.玻璃、水晶、陶瓷的主要成分均是硅酸盐C.灼烧NaOH固体不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应D.由沙子制备光伏材料时的反应之一为SiO2+2C Si+2CO↑
3.(2024届云南师大附中开学考,1)关于液氯与氯水,下列判断错误的是 ( )A.均呈黄绿色 B.均含氯分子C.均含氯离子 D.均有氧化性
4.下列制取Cl2、探究其漂白性、收集并进行尾气处理的原理和装置合理的是 ( )
5.蔗糖与浓硫酸反应的探究实验改进装置如图所示,该实验的设计体现了绿色、微型
的特点。下列说法正确的是 ( )A.该实验只体现了浓硫酸的脱水性和吸水性B.反应过程中,品红溶液褪色,加热后又恢复红色C.紫色石蕊溶液先变红后褪色D.该装置无法证明二氧化硫具有氧化性
6.某实验小组利用下图装置制备NH3并探究其性质。下列说法正确的是 ( )
A.①中药品为NH4Cl和Ca(OH)2B.②中药品为P2O5C.反应一段时间后,③中红色固体变为黑色D.反应一段时间后,④中锥形瓶收集到液氨
考法 氯、硫、氮及其化合物间的转化一、氯及其化合物间的转化1.氯元素的“价—类”二维图
2.氯及其化合物间的转化关系及规律(1)歧化反应 ①Cl2+2OH- Cl-+ClO-+H2O(稀碱,常温)②3Cl2+6OH- 5Cl-+Cl +3H2O(浓碱,加热)(2)归中反应
①Cl-+ClO-+2H+ Cl2↑+H2O(NaClO与NaCl,酸性条件)②5Cl-+Cl +6H+ 3Cl2↑+3H2O(KClO3与KCl,酸性条件)
例1 (2024届贵州贵阳开学考,9)“84”消毒液的主要成分为NaClO,在杀菌消毒中发挥
着重要作用。实验探究发现,在不同的温度下,Cl2通入NaOH溶液中主要发生以下两个
歧化反应,如图所示。下列说法正确的是 ( ) A.反应Ⅰ和Ⅱ都有NaCl生成B.Cl 的空间结构为正四面体形C.反应Ⅰ和Ⅱ中,参加反应的Cl2与NaOH的物质的量之比:Ⅰ
相关课件
这是一份新高考化学复习专题六非金属及其化合物练习课件,共51页。
这是一份新高考化学二轮复习课件专题六化学反应与能量(含解析),共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,简易量热计示意图,燃烧热,命题角度,答案B等内容,欢迎下载使用。
这是一份2023届高考化学二轮复习专题六化学反应与能量课件,共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,简易量热计示意图,燃烧热,命题角度,答案B等内容,欢迎下载使用。









