



所属成套资源:全套新高考化学一轮复习专题课件+练习含答案
新高考化学复习专题九化学反应的热效应教学课件
展开
这是一份新高考化学复习专题九化学反应的热效应教学课件,共39页。
考点1 化学反应中的能量变化1.反应热和焓变(1)反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反
应的热效应,简称反应热。(2)焓变:在等压条件下进行的化学反应,其反应热等于焓变,其符号为ΔH,常用单位是kJ
/ml或kJ·ml-1。
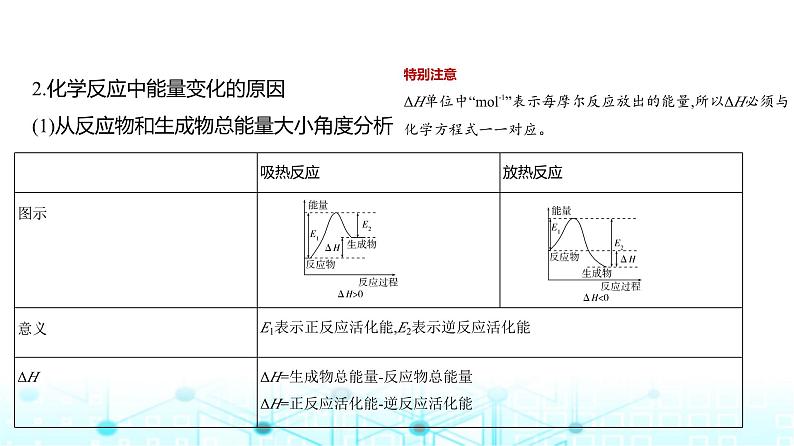
2.化学反应中能量变化的原因(1)从反应物和生成物总能量大小角度分析
特别注意ΔH单位中“ml-1”表示每摩尔反应放出的能量,所以ΔH必须与化学方程式一一对应。
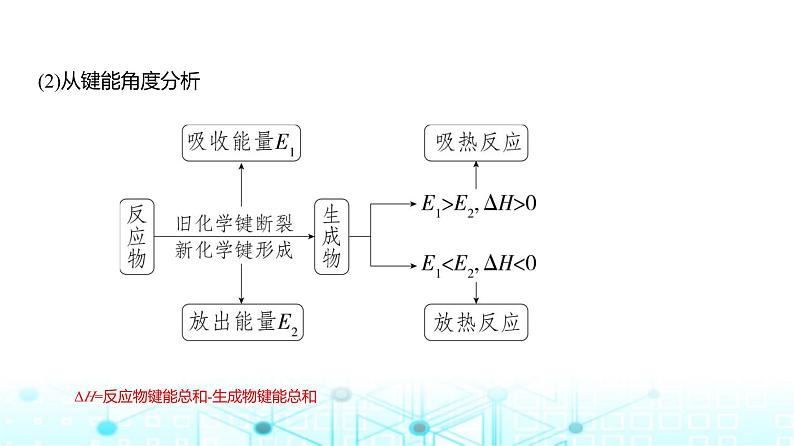
ΔH=反应物键能总和-生成物键能总和
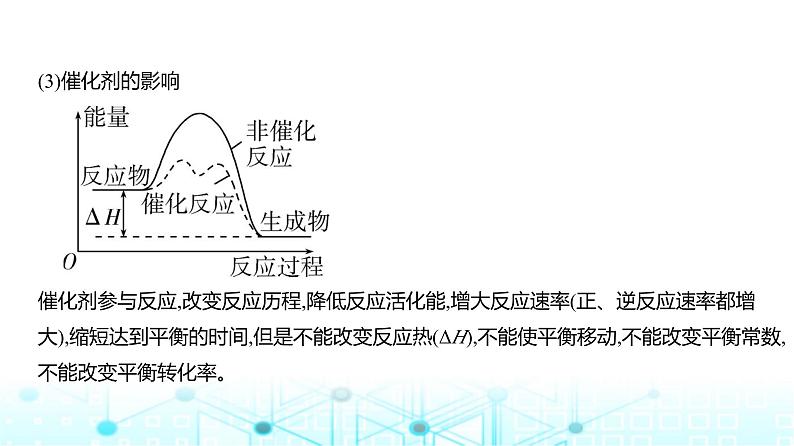
(3)催化剂的影响 催化剂参与反应,改变反应历程,降低反应活化能,增大反应速率(正、逆反应速率都增
大),缩短达到平衡的时间,但是不能改变反应热(ΔH),不能使平衡移动,不能改变平衡常数,不能改变平衡转化率。
(4)常见的吸热、放热反应吸热反应:①大多数分解反应;②盐类的水解;③Ba(OH)2·8H2O与NH4Cl的反应;④C和水
蒸气、C和CO2的反应等。放热反应:①可燃物的燃烧;②中和反应;③大多数化合反应;④金属与酸的置换反应;⑤
缓慢氧化等。
注意 ①测定燃烧热时可燃物中元素对应的指定产物,如C→CO2(g),H→H2O(l),S→SO2(g),N→N2(g)等。②在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 ml H2O时,放出57.3 kJ的热量。
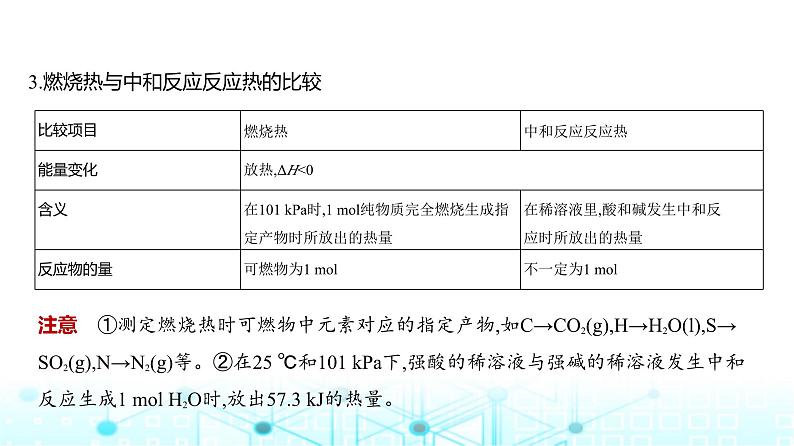
3.燃烧热与中和反应反应热的比较
考点2 热化学方程式 盖斯定律1.热化学方程式(1)意义:表明了化学反应中的物质变化和能量变化。例如2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·ml-1,表示25 ℃和101 kPa下,2 ml氢气和1 ml氧气反应生成2 ml液态
水时放出571.6 kJ的热量。(2)书写要求①写出正确的化学方程式,注明反应的温度和压强(25 ℃、101 kPa下的反应可不注明)。②注明各物质的聚集状态:固态(s)、液态(l)、气态(g)、水溶液(aq),不用“↑”和“↓”。
③热化学方程式中各物质前的化学计量数可以是整数也可以是分数。注意 无论化学反应是否可逆,热化学方程式中的ΔH都表示反应进行到底时的能量变化。归纳总结“五审”法判断热化学方程式的正误
2.盖斯定律(1)内容:不管化学反应是一步完成还是分几步完成,其反应热是相同的,即化学反应的
反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(2)应用:有些反应很难直接测其反应热,可用盖斯定律间接计算。
1.判断正误(正确的打“√”,错误的打“×”)。(1)同温同压下,反应H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的ΔH不同。( )(2)已知H+(aq)+OH-(aq) H2O(l) ΔH=-57.3 kJ·ml-1,则Ba(OH)2和盐酸反应的反应热ΔH=2×(-57.3) kJ·ml-1。( )(3)500 ℃、30 MPa下,将0.5 ml N2和1.5 ml H2置于密闭容器中充分反应生成NH3(g),
放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·ml-1。 ( )
2.在测定中和反应反应热的实验中,下列说法正确的是 ( )A.酸、碱溶液应沿玻璃棒分三次倒入小烧杯B.用铜棒代替环形玻璃搅拌棒,会使测得的反应热的绝对值偏大C.用0.55 ml/L的NaOH溶液分别与0.5 ml/L的盐酸、醋酸溶液反应,所取溶液体积相
等,则测得的反应热数值相同D.测量终止温度时,应当记录混合溶液的最高温度
3.在25 ℃和101 kPa的条件下,1 ml H2(g)和1 ml Cl2(g)完全反应生成HCl(g)的能量变
化如图所示,下列说法不正确的是 ( )
A.H—H键的键能为436 kJ·ml-1B.生成1 ml HCl(g)释放431 kJ的能量C.该反应的热化学方程式:H2(g)+Cl2(g) 2HCl(g) ΔH=-862 kJ·ml-1D.共价键断裂和形成时的能量变化是该化学反应能量变化的主要原因
4.(双选)下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是 ( )A.石墨转变为金刚石是放热反应B.S(g)+O2(g) SO2(g) ΔH1,S(s)+O2(g) SO2(g) ΔH2,则ΔH1
相关课件
这是一份新高考化学复习专题九化学反应的热效应练习课件,共51页。
这是一份人教版高考化学一轮总复习第7章第1节化学反应的热效应课时教学课件,共60页。PPT课件主要包含了环节1课前自主复习,环节2新情境专项练等内容,欢迎下载使用。
这是一份2023版高考化学一轮复习新题精练第六章化学反应的热效应课件,共53页。PPT课件主要包含了必备知识新题精练,关键能力强化提升,高频易错高效快攻,题组1热化学方程式,情境创新专练,提升素养拓展思维,题型专练创新集训,全章综合训练等内容,欢迎下载使用。









