




所属成套资源:全套新高考化学一轮复习专题课件+练习含答案
新高考化学复习专题一0一化学反应速率和化学平衡练习课件
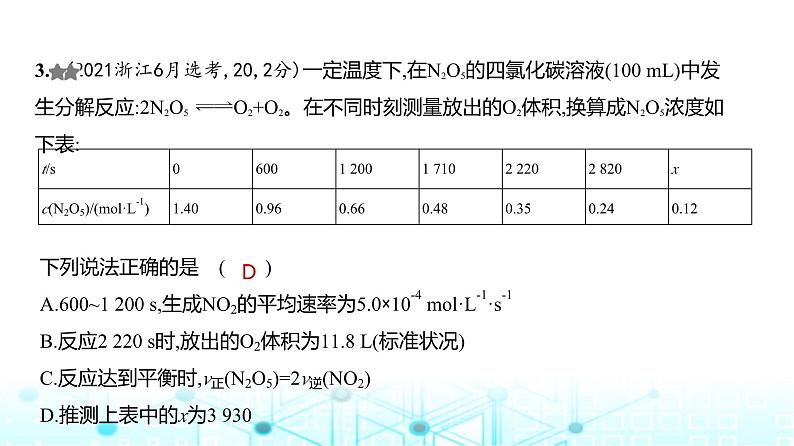
展开
这是一份新高考化学复习专题一0一化学反应速率和化学平衡练习课件,共60页。
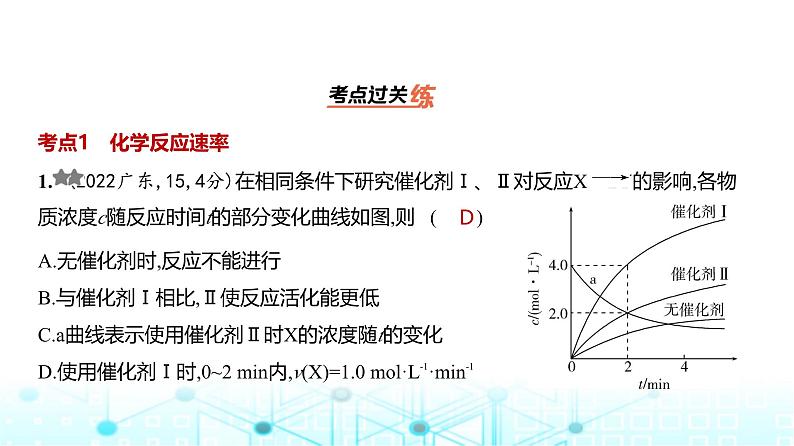
1. (2022广东,15,4分)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X 2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则 ( )
A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 ml·L-1·min-1
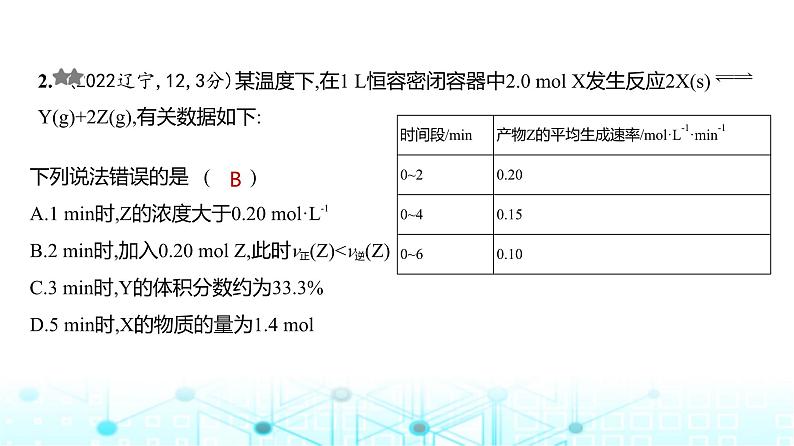
2. (2022辽宁,12,3分)某温度下,在1 L恒容密闭容器中2.0 ml X发生反应2X(s) Y(g)+2Z(g),有关数据如下:
下列说法错误的是 ( )A.1 min时,Z的浓度大于0.20 ml·L-1B.2 min时,加入0.20 ml Z,此时v正(Z)v逆,平衡常数增大B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动D.恒容下,充入一定量的CH2 CH2(g),CH2 CH2(g)的平衡转化率增大
8. (2021海南,8,2分)制备水煤气的反应C(s)+H2O(g) H2(g)+CO(g) ΔH>0,下列说法正确的是 ( )A.该反应ΔS0B.加入一定量Z,达新平衡后m(Y)减小C.加入等物质的量的Y和Z,达新平衡后c(Z)增大D.加入一定量氩气,平衡不移动
10. (2022广东,13,4分)恒容密闭容器中,BaSO4(s)+4H2(g) BaS(s)+4H2O(g)在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是 ( )
A.该反应的ΔHK(Ⅳ)D.若体积V(Ⅲ)=2V(Ⅰ),则Q(Ⅰ)= K(Ⅲ)E.逆反应的速率:v(Ⅰ)>v(Ⅱ)=v(Ⅲ)>v(Ⅳ)
③某温度下,向恒容容器中加入Ag2O,分解过程中反应速率v(O2)与压强p的关系为v(O2)
=k(1- ),k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则v(O2)= (用k表示)。
考法3 多重平衡体系的分析与计算
11. (2023福建,13,节选)探究甲醇对丙烷制丙烯的影响。
丙烷制烯烃过程主要发生的反应有ⅰ.C3H8(g) C3H6(g)+H2(g) ΔH1=+124 kJ·ml-1 ΔS1=127 J·K-1·ml-1 ⅱ.C3H8(g) C2H4(g)+CH4(g) ΔH2=+82 kJ·ml-1 ΔS2=135 J·K-1·ml-1 ⅲ.C3H8(g)+2H2(g) 3CH4(g) ΔH3=-120 kJ·ml-1 ΔS3=27.5 J·K-1·ml-1
已知:Kp为用气体分压表示的平衡常数,分压=物质的量分数×总压。(1)比较反应自发进行(ΔG=ΔH-TΔS”或
“反应 >反应 (填标号)。
③平衡体系中检测不到H2,可认为存在反应:3C3H8(g) 2C3H6(g)+3CH4(g) Kp。下列相关说法正确的是 (填标号)。a.Kp= · b.Kp= (MPa)2c.使用催化剂,可提高丙烯的平衡产率d.平衡后再通入少量丙烷,可提高丙烯的体积分数
④由表中数据推算:丙烯选择性= ×100%= (列出计算式)。(3)丙烷、甲醇共进料时,还发生反应:ⅳ.CH3OH(g) CO(g)+2H2(g) ΔH4=+91 kJ·ml-1
在0.1 MPa、t ℃下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷)∶n(甲醇)=1时,体系总反应:C3H8(g)+CH3OH(g) CO(g)+3CH4(g) ΔH= kJ·ml-1
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
。
12. (2020山东,18,节选)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·ml-1Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.4 kJ·ml-1Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
回答下列问题:(2)一定条件下,向体积为V L的恒容密闭容器中通入1 ml CO2和3 ml H2发生上述反
应,达到平衡时,容器中CH3OH(g)为a ml, CO为b ml,此时H2O(g)的浓度为
ml·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为
。
答案
13. (2023湖南,16,14分)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。Ⅰ.苯乙烯的制备(1)已知下列反应的热化学方程式:①C6H5C2H5(g)+ O2(g) 8CO2(g)+5H2O(g) ΔH1=-4 386.9 kJ·ml-1②C6H5CH CH2(g)+10O2(g) 8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·ml-1③H2(g)+ O2(g) H2O(g) ΔH3=-241.8 kJ·ml-1
计算反应④C6H5C2H5(g) C6H5CH CH2(g)+H2(g)的ΔH4= kJ·ml-1;(2)在某温度、100 kPa下,向反应器中充入1 ml气态乙苯发生反应④,其平衡转化率为
50%,欲将平衡转化率提高至75%,需要向反应器中充入 ml水蒸气作为稀释
气(计算时忽略副反应);(3)在913 K、100 kPa下,以水蒸气作稀释气、Fe2O3作催化剂,乙苯除脱氢生成苯乙烯
外,还会发生如下两个副反应:⑤C6H5C2H5(g) C6H6(g)+CH2 CH2(g)⑥C6H5C2H5(g)+H2(g) C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(S=
×100%)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 ,理由是
;
(4)关于本反应体系中催化剂Fe2O3的描述错误的是 ;A.X射线衍射技术可测定Fe2O3晶体结构B.Fe2O3可改变乙苯平衡转化率C.Fe2O3降低了乙苯脱氢反应的活化能D.改变Fe2O3颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(Ⅰ)的配合物促进C6H5CH2X
(引发剂,X表示卤素)生成自由基C6H5 H2,实现苯乙烯可控聚合。(5)引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是 ;(6)室温下,①Cu+在配体L的水溶液中形成[Cu(L)2]+,其反应平衡常数为K;②CuBr在水中
的溶度积常数为Ksp。由此可知,CuBr在配体L的水溶液中溶解反应的平衡常数为
(所有方程式中计量系数关系均为最简整数比)。
答案 (1)+118(2)5(3)甲苯 随着反应④进行,c(H2)增大,导致反应⑥速率加快,甲苯的选择性提高(4)BD (5)C6H5CH2I (6)K·Ksp
1. (2024届重庆9月月考,10)将4 ml A和2 ml B在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 ml·L-1,现有下列几种说法,其中错误的是 ( )
①用物质A表示的反应的平均速率为0.6 ml·L-1·s-1
②反应速率分别表示为v(A)、v(B)、v(C),则2v(A)=v(B)③2 s时物质A的转化率为30%④2 s时物质B的浓度为0.7 ml·L-1A.①② B.①③ C.②③ D.③④
2. (2024届内蒙古呼和浩特质检一,14)某研究人员通过测定不同条件下的化学反应速率得到以下两组数据(Ea为反应活化能)
基于数据分析和平衡原理,以下认识错误的是( )A.该实验的目的是对比温度和活化能对化学反应速率的影响程度B.其他条件相同时,温度升高,化学反应速率加快C.对于吸热反应,温度升高对于放热方向的反应速率影响较大D.一般离子反应的活化能接近于零,所以反应速率很快
3. (2023江西吉安三中一模,12)室温下,气体M、N、P、Q之间存在如下转化关系:①M N+P;②M N+Q。反应①的速率可表示为v1=k1c(M),反应②的速率可表示为v2=k2c(M)(k1、k2为速率常数)。在容积为10 L的密闭容器中,反应体系中组分M、P
的物质的量随时间的变化如下表所示:
下列说法正确的是 ( )A.0~3 min时间段内,Q的平均反应速率为0.15 ml·L-1·min-1B.反应开始后,体系中P和Q的浓度之比保持不变C.平衡时M生成Q的转化率为36%D.反应①的活化能比反应②的活化能低
4.(2024届河北石家庄精英中学期中,19)一定温度下,密闭容器中发生反应:A(s)+3B(g)
C(g)+2D(g) ΔH0D.1 000 ℃,若容器中n(CH4)=n(H2O)=n(H2)=1、n(CO)=2 ml,则反应处于平衡状态
8. (2024届广东湛江部分学校开学考,15)在Fe2O3的催化作用下,向200 ℃的恒温恒容密闭容器中充入1 ml CH4和2 ml NO2,发生反应CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g),反应过程及能量变化示意图如图所示。下列说法正确的是( )
A.容器内气体的密度不再发生变化时,该反应达到平衡状态B.反应一段时间后(未达平衡),Fe3O4会远远多于Fe2O3C.起始条件相同,其他条件不变,仅改为绝热密闭容器,CH4和NO2的转化率降低D.使用更高效的催化剂能提高该反应平衡时的转化率
9. (2024届河北泊头一中开学考,11)将a ml X、Y混合气体(物质的量之比为1∶1)加入某容积可变的密闭容器中,发生反应:mX+nY qZ。保持一定温度,改变压强分别达到平衡时,测得不同压强下气体X的物质的量浓度如下表所示:
下列说法正确的是 ( )A.保持一定温度,增大压强,平衡正向移动B.当压强为3×106 Pa时,此反应的平衡常数表达式为Kp= C.2×105 Pa时X的平衡转化率大于5×105 Pa时X的平衡转化率D.当压强为2×105 Pa时,若再向体系中加入b ml Y,重新达到平衡时,体系中气体总物
质的量为(a+b) ml
10. (2024届福建三明一中开学考,7)在催化剂作用下,向容积为1 L的容器中加入1 ml X和3 ml Y,发生反应X(g)+2Y(g) 2Z(s),平衡时和反应10 min时X的转化率[α(X)]随温度的变化分别如曲线Ⅰ、Ⅱ所示。下列说法错误的是 ( )
A.该反应ΔH>0B.200 ℃时,前10 min的平均反应速率v(X)=0.02 ml·L-1·min-1C.400 ℃时,反应的平衡常数K=2D.ab段变化可能是随温度升高反应速率加快,bc段变化可能是催化剂在温度高于400 ℃时活性降低导致
11. (2024届河南安阳一调,18)CO、NOx均是大气污染物,在适当条件下CO可将NOx还原为相应的单质,从而消除其对大气的污染。(1)已知:ⅰ.2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH1=-869 kJ·ml-1ⅱ.2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH2=-747 kJ·ml-1
①反应ⅲ.NO2(g)+CO(g) NO(g)+CO2(g) ΔH3,则ΔH3= 。
②反应ⅱ的平衡常数为K2,则lgK2与温度的倒数 的变化关系符合图中的直线 (填“a”或“b”)。
(2)T K下,向初始压强(3.3 MPa)、容积(10 L)均相等的A、B两个密闭容器中分别充入4
ml NO2(g)、x ml CO(g),维持容器A容积不变、容器B压强不变使其仅发生反应ⅰ,x
=8时测得容器B中NO2(g)的转化率随时间的变化如图所示:
①在图中作出容器A中反应从开始到达到平衡时NO2转化率的变化曲线(只画变化趋
势,不用标出具体数值)。
②当x=8时,0~5 min内容器B中v(CO)= MPa·min-1,反应ⅰ的平衡常数Kp=
(结果保留两位有效数字)。当x 8(填“>”或“0);CO2(g)+H2(g) HCOOH(g) ΔH= kJ·ml-1。(2)在某催化剂作用下,CO2(g)+H2(g) HCOOH(g)的速率方程为v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。若在某温
度下,k正=4k逆,则该反应的平衡常数K= 。加入催化剂,k正增大的倍数
(填“大于”“小于”或“等于”)k逆增大的倍数。(3)CO2催化氢化制甲酸的反应历程图(M为过渡金属)如下图所示。
上述循环中,M(CO)4PR3是 (填“催化剂”或“中间产物”)。(4)在反应器中充入CO2和H2,发生反应CO2(g)+H2(g) HCOOH(g)。化学反应速率随时间的变化关系如下图所示。
反应2:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH”“
3. (2023辽宁沈阳二中第6次模拟,12)某反应A(g)+B(g) C(g)+D(g)的速率方程为v=k·cm(A)·cn(B),其半衰期(当剩余的反应物恰好是起始的一半时所需的时间)为 。当其他条件不变,改变反应物浓度时,反应的瞬时速率如下表所示:
下列说法正确的是 ( )A.该反应的速率方程中的m=n=1B.该反应的速率常数k=6.4×10-2min-1C.表格中的c1=0.75,v1=6.4×10-3,v2=12.8×10-3D.在过量的B存在时,反应掉93.75%的A所需的时间是500 min
4. (双选)(2024届山东日照高三开学考,14)已知反应2CO(g)+4H2(g) C2H4(g)+2H2O(g),ΔH>0。在一定条件下存在v正(H2)=k1·c2(CO)c4(H2),v逆(H2O)=k2·c(C2H4)c2(H2O),反应速率随温度的变化如图所示。下列说法错误的是 ( )
A.a为v正(H2)B.T2℃时,v正(CO)=1.05 ml·L-1·min-1C.T3℃和T4℃时反应均达到平衡状态D.K=k1/k2
5. (2023湖南郴州三模,11)在T1 ℃和T2 ℃(T1v(正)C.aA(g)+bB(g) cC(g) ΔH>0
D.某温度下平衡时B的转化率随起始 的增大而先增大后减小
4. (2021广东,14,4分)反应X 2Z经历两步:①X Y;②Y 2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是 ( )
A.a为c(X)随t的变化曲线B.t1时,c(X)=c(Y)=c(Z)C.t2时,Y的消耗速率大于生成速率D.t3后,c(Z)=2c0-c(Y)
5. (2024届重庆万州二中8月月考,8)向体积恒定的2 L密闭容器中加入CO(g)和H2O(g)各1 ml,发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔHp2B.在如图所示条件下,反应Ⅰ可表示为ZnO(s)+CO(g) Zn(s)+CO2(g) ΔH
相关课件
这是一份浙江版高考化学复习专题一0一化学反应速率和化学平衡教学课件,共49页。
这是一份浙江版高考化学复习专题一0化学反应与电能练习课件,共60页。
这是一份浙江版高考化学复习专题一物质的分类及转化练习课件,共22页。PPT课件主要包含了考点2物质的转化等内容,欢迎下载使用。








