

浙江版高考化学复习专题一0化学反应与电能练习课件
展开
这是一份浙江版高考化学复习专题一0化学反应与电能练习课件,共60页。
考点1 原电池原理及其应用
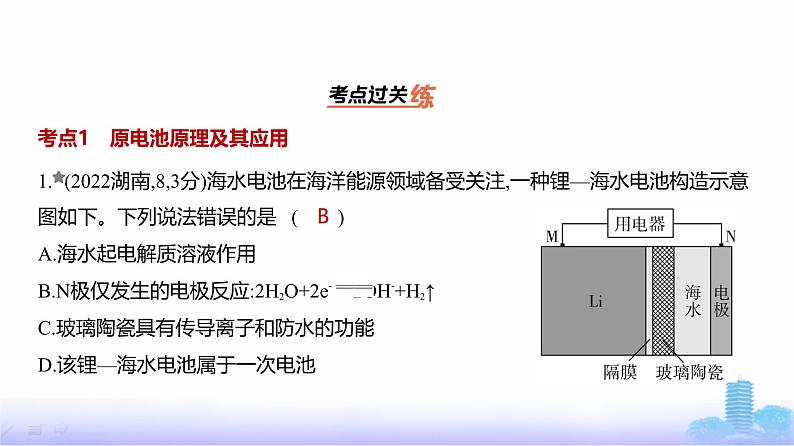
1. (2022湖南,8,3分)海水电池在海洋能源领域备受关注,一种锂—海水电池构造示意图如下。下列说法错误的是 ( )A.海水起电解质溶液作用B.N极仅发生的电极反应:2H2O+2e- 2OH-+H2↑C.玻璃陶瓷具有传导离子和防水的功能D.该锂—海水电池属于一次电池
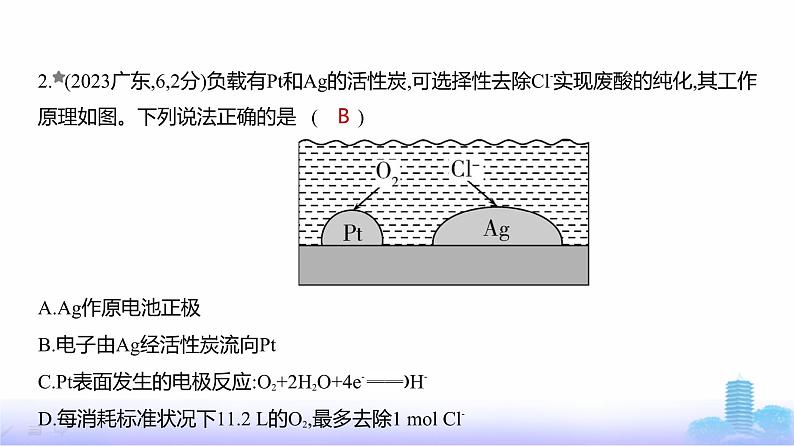
2. (2023广东,6,2分)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图。下列说法正确的是 ( ) A.Ag作原电池正极B.电子由Ag经活性炭流向PtC.Pt表面发生的电极反应:O2+2H2O+4e- 4OH-D.每消耗标准状况下11.2 L的O2,最多去除1 ml Cl-
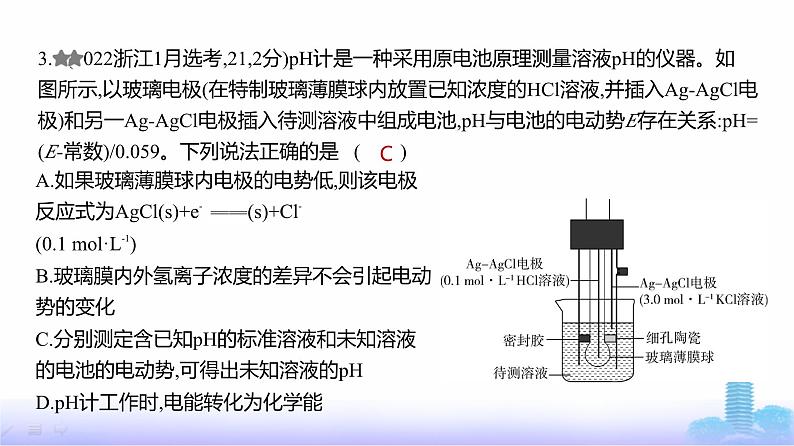
3. (2022浙江1月选考,21,2分)pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电
极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=
(E-常数)/0.059。下列说法正确的是 ( )
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为AgCl(s)+e- Ag(s)+Cl-(0.1 ml·L-1)B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pHD.pH计工作时,电能转化为化学能
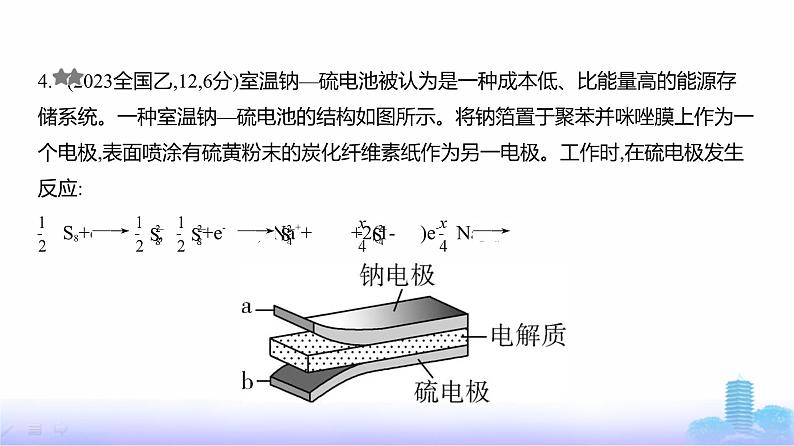
4. (2023全国乙,12,6分)室温钠—硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠—硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一
个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生
反应: S8+e- , +e- ,2Na++ +2(1- )e- Na2Sx
下列叙述错误的是 ( )A.充电时Na+从钠电极向硫电极迁移B.放电时外电路电子流动的方向是a→bC.放电时正极反应为:2Na++ S8+2e- Na2SxD.炭化纤维素纸的作用是增强硫电极导电性能
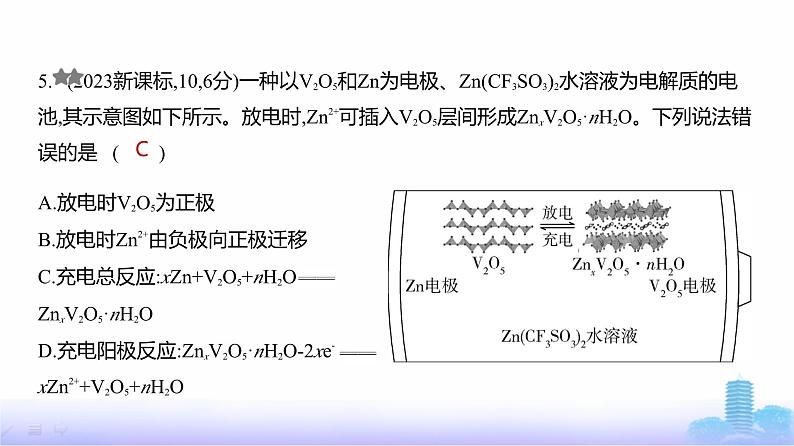
5. (2023新课标,10,6分)一种以V2O5和Zn为电极、Zn(CF3SO3)2水溶液为电解质的电池,其示意图如下所示。放电时,Zn2+可插入V2O5层间形成ZnxV2O5·nH2O。下列说法错
误的是 ( )
A.放电时V2O5为正极B.放电时Zn2+由负极向正极迁移C.充电总反应:xZn+V2O5+nH2O ZnxV2O5·nH2OD.充电阳极反应:ZnxV2O5·nH2O-2xe- xZn2++V2O5+nH2O
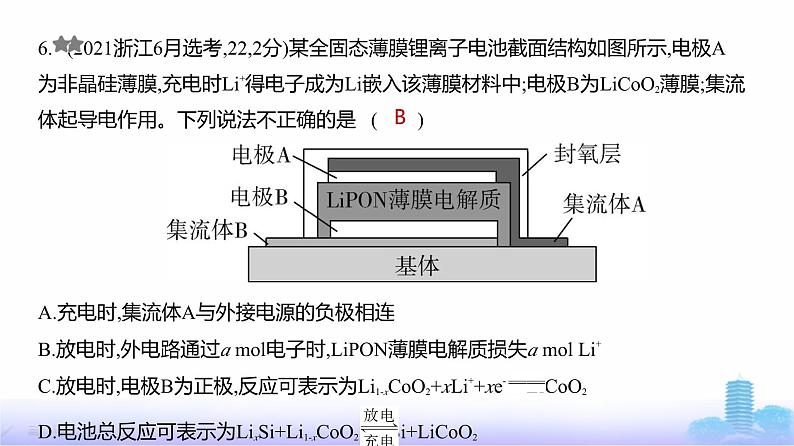
6. (2021浙江6月选考,22,2分)某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCO2薄膜;集流
体起导电作用。下列说法不正确的是 ( ) A.充电时,集流体A与外接电源的负极相连B.放电时,外电路通过a ml电子时,LiPON薄膜电解质损失a ml Li+
C.放电时,电极B为正极,反应可表示为Li1-xCO2+xLi++xe- LiCO2D.电池总反应可表示为LixSi+Li1-xCO2 Si+LiCO2
7. (2023山东,11,4分)(双选)利用热再生氨电池可实现CuSO4电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后
电池开始工作。下列说法正确的是 ( )
A.甲室Cu电极为正极B.隔膜为阳离子膜C.电池总反应为Cu2++4NH3 [Cu(NH3)4]2+D.NH3扩散到乙室将对电池电动势产生影响
考点2 电解原理及其应用
8. (2023广东,13,4分)利用活性石墨电极电解饱和食盐水,进行如图所示实验。闭合K1,一段时间后, ( )A.U形管两侧均有气泡冒出,分别是Cl2和O2B.a处布条褪色,说明Cl2具有漂白性C.b处出现蓝色,说明还原性:Cl->I-D.断开K1,立刻闭合K2,电流表发生偏转
9. (2022广东,10,2分)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中 ( )A.阴极发生的反应为Mg-2e- Mg2+B.阴极上Al被氧化C.在电解槽底部产生含Cu的阳极泥D.阳极和阴极的质量变化相等
10. (2022海南,9,4分)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如下。下列有关说法正确的是 ( )A.在b电极上,N2被还原B.金属Ag可作为a电极的材料C.改变工作电源电压,反应速率不变D.电解过程中,固体氧化物电解质中O2-不断减少
11. (2023浙江6月选考,13,3分)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是 ( )A.电极A接电源正极,发生氧化反应B.电极B的电极反应式为:2H2O+2e- H2↑+2OH-C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
12. (2021天津,11,3分)下图所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是 ( )A.a是电源的负极B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色C.随着电解的进行,CuCl2溶液浓度变大D.当0.01 ml Fe2O3完全溶解时,至少产生气体336 mL(折合成标准状况下)
13. (2023福建,9,4分)一种可在较高温下安全快充的铝—硫电池的工作原理如图,电解质为熔融氯铝酸盐(由NaCl、KCl和AlCl3形成熔点为93 ℃的共熔物),其中氯铝酸根
[AlnC (n≥1)]起到结合或释放Al3+的作用。电池总反应:2Al+3xS Al2(Sx)3。下列说法错误的是 ( )
A.AlnC 含4n个Al—Cl键B.AlnC 中同时连接2个Al原子的Cl原子有(n-1)个C.充电时,再生1 ml Al单质至少转移3 ml电子D.放电时间越长,负极附近熔融盐中n值小的AlnC 浓度越高
14. (2023重庆,12,3分)电化学合成是一种绿色高效的合成方法。下图是在酸性介质中电解合成半胱氨酸和烟酸的示意图。下列叙述错误的是 ( )
A.电极a为阴极B.H+从电极b移向电极aC.电极b发生的反应为 +2H2O-6e- +6H+D.生成3 ml半胱氨酸的同时生成1 ml烟酸
15. (2022重庆,12,3分)硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。下列说法错误的是 ( )
A.惰性电极2为阳极B.反应前后W /W 数量不变C.消耗1 ml氧气,可得到1 ml硝酮D.外电路通过1 ml电子,可得到1 ml水
16. (2023北京,5,3分)回收利用工业废气中的CO2和SO2,实验原理示意图如下。下列说法不正确的是 ( )A.废气中SO2排放到大气中会形成酸雨
B.装置a中溶液显碱性的原因是HC 的水解程度大于HC 的电离程度C.装置a中溶液的作用是吸收废气中的CO2和SO2D.装置b中的总反应为S +CO2+H2O HCOOH+S
17. (2024浙江1月选考,13,3分)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2。下列说法不正确的是 ( )A.氨水浓度越大,腐蚀趋势越大B.随着腐蚀的进行,溶液的pH变大C.铁电极上的电极反应式为2NH3+2e- 2N +H2↑D.每生成标准状况下224 mL H2,消耗0.010 ml Zn
考点3 金属的腐蚀与防护
18. (2022湖北,6,3分)下列实验装置(部分夹持装置略)或现象错误的是 ( )
19. (2020江苏单科,11,4分)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在下图所示的情境中,下列有关说法正确的是 ( )A.阴极的电极反应式为Fe-2e- Fe2+B.金属M的活动性比Fe的活动性弱C.钢铁设施表面因积累大量电子而被保护D.钢铁设施在河水中的腐蚀速率比在海水中的快
考法1 电极反应式的书写
2. (2022全国乙,12,6分)Li-O2电池比能量高,在汽车、航天等领域具有良好应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产
生电子(e-)和空穴(h+),驱动阴极反应(Li++e- Li)和阳极反应(Li2O2+2h+ 2Li++O2)对电池进行充电。下列叙述错误的是 ( )
A.充电时,电池的总反应Li2O2 2Li+O2B.充电效率与光照产生的电子和空穴量有关C.放电时,Li+从正极穿过离子交换膜向负极迁移D.放电时,正极发生反应O2+2Li++2e- Li2O2
3. (2021海南,9,4分)液氨中存在平衡:2NH3 N +N 。如图所示为电解池装置,以KNH2的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下
列有关说法正确的是 ( )A.b电极连接的是电源的负极B.a电极的反应为2NH3+2e- H2↑+2N C.电解过程中,阴极附近K+浓度减小D.理论上两极产生的气体物质的量之比为1∶1
4. (2022浙江6月选考,21,2分)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。
电解过程中溶液的体积变化忽略不计)。下列说法不正确的是 ( )
A.电极A为阴极,发生还原反应B.电极B的电极反应:2H2O+Mn2+-2e- MnO2+4H+C.电解一段时间后溶液中Mn2+浓度保持不变D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
5. (2020江苏单科,20节选)(2)研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。②图中所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化
为电能,其反应的离子方程式为 。
6. (2023江苏,17节选)(3)催化电解吸收CO2的KOH溶液可将CO2转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随
电解电压的变化如图所示。
FE%= ×100%其中,QX=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。①当电解电压为U1时,电解过程中含碳还原产物的FE%为0,阴极主要还原产物为
(填化学式)。②当电解电压为U2时,阴极由HC 生成CH4的电极反应式为 。③当电解电压为U3时,电解生成的C2H4和HCOO-的物质的量之比为
(写出计算过程)。
考法2 新型电化学装置分析 电化学相关计算
7. (2021福建,9,4分)催化剂TAPP-Mn(Ⅱ)的应用,使Li-CO2电池的研究取得了新的进展。Li-CO2电池结构和该催化剂作用下正极反应可能的历程如下图所示。下列说法错误的是 ( )
A.Li-CO2电池可使用有机电解液B.充电时,Li+由正极向负极迁移C.放电时,正极反应为3CO2+4Li++4e- 2Li2CO3+CD.*LiCO2、*CO、*LiC2O3和C都是正极反应的中间产物
8. (2022辽宁,9,3分)如图,c管为上端封口的量气管,为测定乙酸溶液浓度,量取10.00 mL待测样品加入b容器中,接通电源,进行实验。下列说法正确的是 ( )A.左侧电极反应:2H2O-4e- O2↑+4H+
B.实验结束时,b中溶液红色恰好褪去C.若c中收集气体11.20 mL,则样品中乙酸浓度为0.1 ml·L-1D.把盐桥换为U形铜导线,不影响测定结果
9. (2021江苏,12,3分)通过下列方法可分别获得H2和O2:①通过电解获得NiOOH和H2(装置示意图如图所示);②在90 ℃将NiOOH与H2O反应生成Ni(OH)2并获得O2。下列说
法正确的是 ( )A.电解后KOH溶液的物质的量浓度减小
B.电解时阳极电极反应式:Ni(OH)2+OH--e- NiOOH+H2OC.电解的总反应方程式:2H2O 2H2↑+O2↑D.电解过程中转移4 ml电子,理论上可获得22.4 L O2
10. (2022广东,16,4分)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:NaTi2(PO4)3+2Na++2e- Na3Ti2(PO4)3下列说法正确的是 ( )
A.充电时电极b是阴极B.放电时NaCl溶液的pH减小C.放电时NaCl溶液的浓度增大D.每生成1 ml Cl2,电极a质量理论上增加23 g
11. (2023浙江1月选考,11,3分)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图,下列说法正确的是 ( )A.石墨电极为阴极,发生氧化反应
B.电极A的电极反应:8H++TiO2+SiO2+8e- TiSi+4H2OC.该体系中,石墨优先于Cl-参与反应D.电解时,阳离子向石墨电极移动
12. (2023全国甲,12,6分)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应能提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说
法正确的是 ( )
A.析氢反应发生在IrOx-Ti电极上B.Cl-从Cu电极迁移到IrOx-Ti电极C.阴极发生的反应有:2CO2+12H++12e- C2H4+4H2OD.每转移1 ml电子,阳极生成11.2 L气体(标准状况)
13. (2022湖北,14,3分)含磷有机物应用广泛。电解法可实现由白磷直接制备Li[P(CN)2],过程如图所示(Me为甲基)。下列说法正确的是 ( )A.生成1 ml Li[P(CN)2],理论上外电路需要转移2 ml电子
B.阴极上的电极反应为P4+8CN--4e- 4[P(CN)2]-C.在电解过程中CN-向铂电极移动D.电解产生的H2中的氢元素来自LiOH
考法3 “隔膜”在电化学中的应用
14. (2020浙江1月选考,18,2分)在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法不正确的是 ( )A.电极A为阳极,发生氧化反应生成氯气B.离子交换膜为阳离子交换膜C.饱和NaCl溶液从a处进,NaOH溶液从d处出D.OH-迁移的数量等于导线上通过电子的数量
15. (2023湖北,10,3分)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢
气的速率为x ml·h-1。下列说法错误的是( )
A.b电极反应式为2H2O+2e- H2↑+2OH-B.离子交换膜为阴离子交换膜C.电解时海水中动能高的水分子可穿过PTFE膜D.海水为电解池补水的速率为2x ml·h-1
16. (2023广东,16,4分)用一种具有“卯榫”结构的双极膜组装电解池,可实现大电流催化电解KNO3溶液制氨。工作时,H2O在双极膜界面处被催化解离成H+和OH-,有利
于电解反应顺利进行。下列说法不正确的是 ( )A.电解总反应:KNO3+3H2O NH3·H2O+2O2↑+KOHB.每生成1 ml NH3·H2O,双极膜处有9 ml 的H2O解离C.电解过程中,阳极室中KOH的物质的量不因反应而改变D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
17. (2022河北,12,4分)(双选)科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如下。下列说法正确的是 ( )
A.电极b为阳极B.隔膜为阴离子交换膜C.生成气体M与N的物质的量之比为2∶1D.反应器 Ⅰ 中反应的离子方程式为4[Fe(CN)6]3-+4OH- 4[Fe(CN)6]4-+O2↑+2H2O
1. (2023金华十校联考,11)一种在300 ℃下工作的新型锂—二硫化亚铁热电池的截面结构如图所示,LLZTO导体管只允许Li+通过。当用1.8 V电压充电后,电池正极材料
中S、Fe的原子个数比为1.02(不计Li2S,下同);2.3 V电压充电后,S、Fe的原子个数比为
2.01。下列说法不正确的是 ( )
A.Al2O3绝缘体隔离正、负极,使化学能有效地转化为电能B.电池工作时,负极发生反应:2Li+S2--2e- Li2SC.电池正极材料的变化为FeS2 FeS FeD.电池总反应可表示为2xLi+FeS2 xLi2S+FeS2-x
2. (2023杭州学军中学阶段测试,11)近期,科学家研发出了一种新型铝电池。该电池电极分别为Al和Se,熔融盐电解质由氯化钠(NaCl)、氯化钾(KCl)和氯化铝(AlCl3)组
成(如图所示)。其中,电池放电过程中会形成AlnC (n≥1),放电总反应为2Al+3Se Al2Se3。下列说法错误的是 ( )
A.充电时,Al电极为阴极B.放电时,Al电极附近的阴离子浓度降低C.放电时,电路中每转移1 ml电子,理论上正极质量增加9 gD.充电时,阳极的电极反应式为(n-1)Al-3(n-1)e-+(3n+1) C
3. (2023重点中学拔尖学生培养联盟适应考,11)直接H2O2-H2O2燃料电池是一种新型化学电源,其工作原理如图所示。电池放电时,下列说法不正确的是 ( )A.电池工作时,电极Ⅰ电势低
B.电极Ⅱ的反应式为H2O2+2e-+2H+ 2H2OC.电池总反应为2H2O2 O2↑+2H2OD.当电路中转移0.1 ml电子时,通过阳离子交换膜的K+为3.9 g
4. (2024届嘉兴9月阶段测试,13)某同学通过“化学—电解法”探究K2FeO4(高铁酸钾)的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴
入含Fe3+的溶液,控制温度,可制得K2FeO4。下列说法不正确的是 ( )A.石墨Ⅰ连接电源负极,发生还原反应B.“化学法” 得到Fe 的离子方程式为2Fe(OH)3+3ClO-+4OH- 2Fe +3Cl-+5H2OC.合成1 ml K2FeO4,阴极可以生成3 ml KOHD.盐桥中的阴离子向KOH溶液中迁移
5. (2024届Z20名校联盟联考一,13)某无隔膜流动海水电解法制H2的装置如图所示,其中高选择性催化剂PRT可抑制O2在电极表面产生,提高放电效率。下列说法不正确
的是( )
A.钛箔作阴极,发生还原反应B.阳极反应主要为Cl--2e-+H2O HClO+H+C.电解后海水pH明显下降D.理论上生成1 ml H2转移电子数为2NA
6. (2023温州二模,11)利用废料Ce2O3制备Ce(SO4)2的工作原理如图,下列说法不正确的是 ( )A.电极b为阴极,发生还原反应
B.电解总反应式:Ce2O3+8H+ 2Ce4++3H2O+H2↑C.离子交换膜为阴离子交换膜D.X可以是H2SO4溶液
7. (2023宁波二模,11)一种用于发动机SCR系统的电解尿素(H2NCONH2)混合装置(X、Y为石墨电极,隔膜仅阻止气体通过)如图,下列说法不正确的是 ( )A.装置工作时,电子由Y极流入,X极流出
B.Y极发生还原反应C.X极的电极反应式为H2NCONH2+8OH--6e- N2↑+C +6H2OD.若用铅酸蓄电池为电源,理论上消耗49 g H2SO4时,此装置中有0.5 ml H2生成
8. (2023百校3月联考,11)我国科学家研发了一种水系可逆Zn-CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH-,在外加电场中可透过相应的离
子膜定向移动。当闭合K1时,Zn-CO2电池工作原理如图所示。下列说法不正确的是 ( )
A.闭合K2时,Zn电极与直流电源正极相连B.闭合K2时,Pd电极是阳极,发生氧化反应C.闭合K1时,H+通过a膜向Pd电极方向移动D.闭合K1时,Zn电极的电极反应式为Zn+4OH--2e- Zn(OH
9. (2023湖丽衢三地市4月联考,11)海港、码头的钢制管桩会受到海水的长期侵蚀,常用外加电流法对其进行保护(如图所示,其中高硅铸铁为惰性辅助电极)。下列有关叙
述中不正确的是 ( )A.a为负极,b为正极B.高硅铸铁是作为损耗阳极材料发挥作用的C.通电时,海水中的阳离子向钢制管桩电极移动D.通电后使钢制管桩表面的腐蚀电流接近于零
1. (2023金丽衢十二校二模,11)微生物电解池(MEC)是近年来快速发展的一种生物制氢技术。其中一种实验装置如图所示,若以葡萄糖为底物,下列说法不正确的是 ( )
A.膜是阴离子交换膜B.电极Y为阴极,发生还原反应C.阳极的电极反应为C6H12O6+6H2O-24e- 6CO2+24H+D.电极X和电极Y附近溶液的pH不同
2. (2024届名校协作体开学考,13)中国科学院研究团队在碱性锌铁液流电池研究方面取得新进展,该电池的总反应为Zn+2Fe(CN +4OH- 2Fe(CN +Zn(OH 。下列叙述正确的是 ( )
A.放电时,M极电极反应式为 -e-B.充电时,N极接电源负极,该电极发生氧化反应C.充电时,右侧贮液器中溶液浓度减小D.放电时,当电路中转移2 ml电子,负极区电解质溶液增重65 g
3. (2023四校联盟联考,11)光催化钠离子二次电池的应用研究取得重大进展,该电池工作原理如下图所示。下列有关说法不正确的是 ( )A.充电时,电子从光催化电极流出通过导线流向石墨电极
B.放电时,每消耗1 ml NaI3,左室电解质溶液质量减少46 gC.充电时,S2-通过离子交换膜进入右室D.放电时,石墨电极的电极反应式为4S2--6e-
4. (2024届杭高9月阶段考,12)磷酸铁锂电池在充、放电过程中表现出了良好的循环稳定性,具有较长的使用寿命,放电时的反应为LixC6+Li1-xFePO4 C6+LiFePO4。图1为某磷酸铁锂电池的切面,图2为LiFePO4晶胞充、放电时Li+脱出和嵌入的示意图。
其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链
结构。下列说法错误的是 ( )
A.放电时,负极反应:LixC6-xe- xLi++C6B.(a)过程中1 ml晶胞转移的电子数为 NAC.(b)代表放电过程,Li+脱离石墨,经电解质嵌入正极D.充电时的阳极反应:LiFePO4-xe- Li1-xFePO4+xLi+
5. (2023杭州重点中学3月月考,11)由我国科学家设计的Mg-Li双盐具有较高的电池效率,其工作原理如图所示,下列说法错误的是 ( )A.放电时,正极电极反应式为FeS+2e-+2Li+ Fe+Li2SB.充电时,Mg电极发生了还原反应C.充电时,每生成1 ml Mg,电解质溶液质量减少24 gD.电解质溶液中含离子迁移速率更快的Li+,提高了电池效率
6. (2023杭州教学质量检测,11)有研究表明,以CO2与辛胺CH3(CH2)7NH2为原料高选择性地合成甲酸和辛腈CH3(CH2)6CN,工作原理如图,下列说法不正确的是 ( )
A.Ni2P电极与电源正极相连B.In/In2O3-x电极上可能有副产物H2生成C.在In/In2O3-x电极上发生的反应为CO2+H2O+2e- +OH-D.标准状况下33.6 LCO2参与反应时,Ni2P电极上有1.5 ml辛腈生成
7. (2023绍兴上虞二模,11)工业上主要采用如图1所示的方法制备盐酸羟胺(NH2OH·HCl),一种常见的显像剂,性质类似NH4Cl。电池装置中含Fe的催化电极的电极反
应机理如图2所示,下列说法正确的是 ( )
A.Pt电极作正极,发生还原反应B.由图2可知,NO在电极上发生的反应为:NO+3e-+3H+ NH2OHC.反应一段时间后,右侧溶液pH减小D.外电路每转移2 ml电子,通过氢离子交换膜往左侧迁移的H+有2NA个
8. (2023精诚联盟三模,11)内部重整式高温燃料电池具有良好的商业化前景,其基本工作原理(以CH4为原料,熔融碳酸盐为电解质)如图所示。下列说法正确的是 ( )
A.b极为正极,发生还原反应B.电子流向:a极→导线→b极→电解质→a极C.a极电极反应为CH4-8e-+4C 5CO2+2H2OD.该电池所用的隔膜一定属于阳离子交换膜
9. (2024届A9协作体返校考,11)电有机合成相对于传统有机合成具有显著优势,利用如图所示装置实现电催化合成呋喃二甲酸。下列说法不正确的是 ( ) A.催化电极b为阴极,发生还原反应
B.催化电极a上的反应为 +6e-+2H2O +6H+C.电路中每转移1 ml e-,阳极区与阴极区质量变化的差为2 gD.若1 ml Ni2+在催化电极a上放电,可制得呋喃二甲酸26 g
10. (2023温州乐清知临中学二模,10)某水系钠离子电池工作原理如图,电池总反应为2Na2FePO4F+NaTi2 (PO4 )3 2NaFePO4F+Na3Ti2(PO4)3。下列说法正确的是 ( )
A.充电、放电时,钠离子均向电势更高的电极移动B.放电时,导线中每通过1 ml电子,理论上a极质量减轻23 gC.充电时,b极的电极反应为NaFePO4F+Na++e- Na2FePO4FD.交换膜应为阳离子交换膜且孔径比锂离子电池交换膜的孔径小
相关课件
这是一份浙江版高考化学复习专题一0一化学反应速率和化学平衡教学课件,共49页。
这是一份新高考化学复习专题一0一化学反应速率和化学平衡练习课件,共60页。
这是一份新高考化学复习专题一0一化学反应速率和化学平衡教学课件,共60页。








