




所属成套资源:全套浙江版高考化学一轮复习专题课件+练习含答案
浙江版高考化学复习专题六非金属及其化合物教学课件
展开
这是一份浙江版高考化学复习专题六非金属及其化合物教学课件,共50页。
考情分析 浙江选考中一般会有1道选择题考查非金属元素及其化合物的性质、性质与用
途的对应关系,还会与其他专题知识结合,可考查的方向很多,元素及其化合物的性质
相关知识是化学学习的基础,贯穿整个化学学科体系,要熟练掌握元素及其化合物的
性质,在做题中灵活应用。
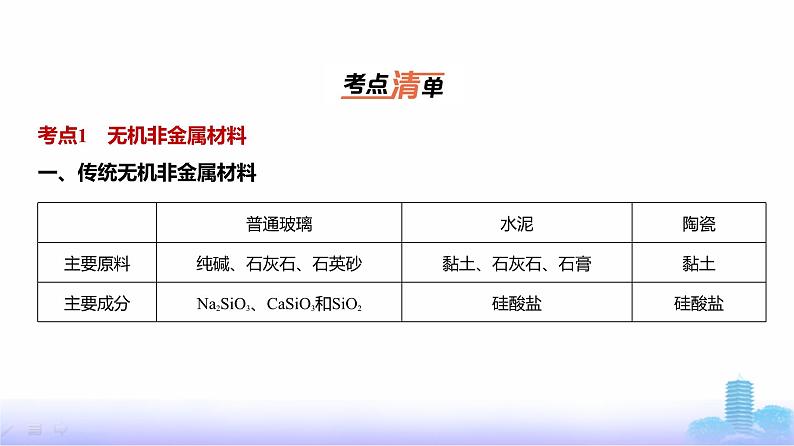
考点1 无机非金属材料一、传统无机非金属材料
二、新型无机非金属材料1.硅(1)制备:SiO2+2C Si(粗硅)+2CO↑,Si+3HCl SiHCl3+H2,SiHCl3+H2 Si+3HCl。(2)用途:作半导体材料、用于制造太阳能电池、芯片。2.二氧化硅(1)存在形式:石英、水晶、玛瑙、沙子等。
(2)化学性质①酸性氧化物:SiO2+2NaOH Na2SiO3+H2O(盛有碱性物质的试剂瓶要用橡胶塞,不能用玻璃塞)。注意 硅酸钠溶液与盐酸反应:Na2SiO3+2HCl H2SiO3↓+2NaCl。②能与氢氟酸反应:SiO2+4HF SiF4↑+2H2O。(3)用途:制作光导纤维、化学仪器、光学仪器、钟表部件等。3.新型陶瓷:高温结构陶瓷、压电陶瓷、透明陶瓷、超导陶瓷等。碳化硅(SiC)俗称金
刚砂,硬度大、耐高温。4.碳纳米材料:富勒烯、碳纳米管、石墨烯等。
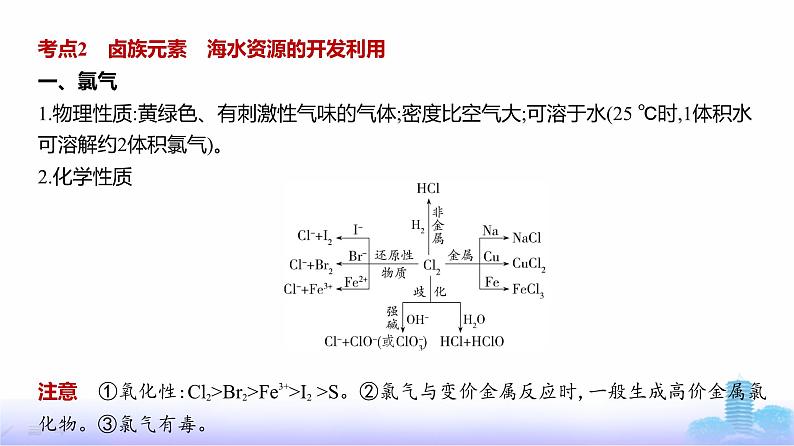
考点2 卤族元素 海水资源的开发利用一、氯气1.物理性质:黄绿色、有刺激性气味的气体;密度比空气大;可溶于水(25 ℃时,1体积水
可溶解约2体积氯气)。2.化学性质
注意 ①氧化性:Cl2>Br2>Fe3+>I2 >S。②氯气与变价金属反应时,一般生成高价金属氯
化物。③氯气有毒。
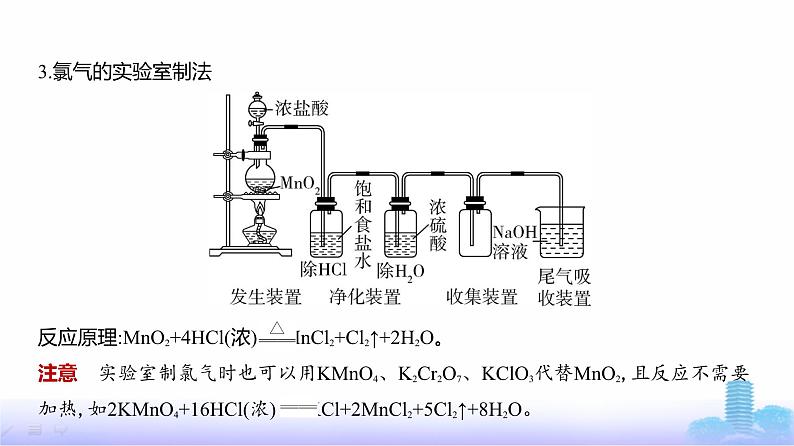
反应原理:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。注意 实验室制氯气时也可以用KMnO4、K2Cr2O7、KClO3代替MnO2,且反应不需要
加热,如2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O。
4.氯水:呈黄绿色,溶于水的氯气部分与水反应:Cl2+H2O H++Cl-+HClO。(1)新制氯水的成分三种分子:Cl2、HClO、H2O四种离子:H+、Cl-、ClO-、OH-(极少)(2)氯水的性质①强氧化性:Cl2,能氧化Br-、Fe2+、I-、S2-等。②酸性:H+,具有强酸的性质。③漂白性:HClO,或酸性条件下的ClO-,能使有颜色的有机物(如酸碱指示剂、鲜花中的
色素、品红等)褪色。
④不稳定性:2HClO 2HCl+O2↑,HClO浓度减小,使更多的Cl2与水反应,因此,久置的氯水会变成稀盐酸。⑤其他:Cl-,加入AgNO3溶液产生白色沉淀。二、氯的化合物1.次氯酸(H—O—Cl)(1)弱酸性(酸性:H2CO3>HClO>HC )(2)强氧化性(漂白性)(3)不稳定性(2HClO 2HCl+O2↑)
2.次氯酸盐(1)漂白液(有效成分:NaClO)制备:Cl2通入NaOH溶液中,发生反应:Cl2+2NaOH NaCl+NaClO+H2O。(2)漂白粉[有效成分:Ca(ClO)2]制备:Cl2通入冷的石灰乳中,发生反应:2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O。失效原因:Ca(ClO)2+H2O+CO2 CaCO3+2HClO,2HClO 2HCl+O2↑。三、卤素1.卤素单质化学性质的相似性(1)能与大多数金属反应:如2Fe+3Br2 2FeBr3、Fe+I2 FeI2。(2)能与H2反应生成HX(X代表F、Cl、Br、I,下同)。(3)常温下能与水反应:X2+H2O HX+HXO(F2例外,2F2+2H2O 4HF+O2)。
(4)能与碱反应:X2+2NaOH NaX+NaXO+H2O(F2、I2例外,2F2+2H2O 4HF+O2)。(5)能发生置换反应:Cl2+2Br- Br2+2Cl-、Br2+2I- I2+2Br-。2.卤素单质及化合物的特殊性质
3.卤素离子的检验(1)沉淀法:向未知液中滴加AgNO3溶液和稀硝酸,若生成白色沉淀,则有Cl-;若生成浅黄
色沉淀,则有Br-;若生成黄色沉淀,则有I-。(2)置换—萃取法:向未知液中加适量新制饱和氯水振荡后,加入CCl4振荡,有机层呈红
棕色或橙红色,则有Br-;有机层呈紫红色,则有I-。(3)氧化—淀粉法检验I-向未知溶液中先加入淀粉,不变蓝,再加入适量新制饱和氯水或过氧化氢溶液振荡后,
溶液变蓝,说明有I-。
四、海水资源的开发利用1.氯碱工业 → 饱和食盐水 反应原理:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。2.海水提溴 反应原理:①Cl2+2Br- 2Cl-+Br2;
②Br2+SO2+2H2O H2SO4+2HBr;③2HBr+Cl2 2HCl+Br2。3.海带提碘 反应原理:2I-+Cl2 2Cl-+I2。
考点3 硫及其化合物一、硫单质1.物理性质:硫(俗称硫黄)是一种黄色晶体,质脆,易研成粉末。硫难溶于水,微溶于酒
精,易溶于CS2。2.化学性质
二、二氧化硫1.物理性质:无色、有刺激性气味的气体;密度比空气大;易溶于水(1体积水可溶解约40
体积SO2)。2.化学性质 注意 SO2使酸性KMnO4溶液和溴水褪色,表现了SO2的还原性,不是漂白性。
3.用途:①漂白剂(漂白纸浆、毛、丝等);②杀菌消毒;③食品添加剂(用在红酒、干果
中等)。总结 SO2和CO2都可使澄清石灰水变浑浊,检验二者同时存在的一般流程如下。
三、硫酸1.物理性质:无色油状液体,密度比水大,沸点高,难挥发。2.化学性质稀硫酸:具有酸的通性。浓硫酸:三大特性——吸水性、脱水性、强氧化性。Cu+2H2SO4(浓) CuSO4+SO2↑+2H2OC+2H2SO4(浓) 2SO2↑+CO2↑+2H2O常温下,浓硫酸可使Fe、Al钝化。
3.硫酸的工业制法(接触法) 反应原理及设备:Ⅰ.4FeS2+11O2 2Fe2O3+8SO2 沸腾炉Ⅱ.2SO2+O2 2SO3 接触室Ⅲ.SO3+H2O H2SO4 吸收塔
4.硫酸根离子的检验原理:Ba2++S BaSO4↓。方法:待测液 取清液 有无白色沉淀(确定有无S )。加盐酸目的:防止C 、S 、Ag+等的干扰。
考点4 氮及其化合物 环境保护与绿色化学一、氮气
二、氮的氧化物1.NO和NO2
注意 NO2能与N2O4相互转化:2NO2 N2O4,由于此平衡的存在,通常所说的NO2实际上是NO2和N2O4的混合气体。2.NOx机动车尾气、燃料高温燃烧生成的氮氧化物属于大气污染物,会形成酸雨和光化学烟
雾等。三、硝酸1.物理性质:无色、有刺激性气味的液体,易挥发。
注意 浓硝酸见光或者受热分解产生NO2,通常保存在棕色试剂瓶中,并放在阴凉处。3.工业制硝酸NH3 NO NO2 HNO3
反应原理:①4NH3+5O2 4NO+6H2O;②2NO+O2 2NO2;③3NO2+H2O 2HNO3+NO。注意 为了使NO2充分转化为HNO3,可充入过量的O2,发生反应:4NO2+O2+2H2O 4HNO3。四、氨及铵盐1.NH3(1)结构:电子式为H: :H,分子空间结构为三角锥形,是极性分子。
(2)物理性质:无色、有刺激性气味的气体;密度比空气小,易液化(工业上,液氨可用作
制冷剂),极易溶于水(常温常压下,1体积水大约可溶解700体积NH3)。(3)化学性质 (4)检验NH3是唯一能使湿润的红色石蕊试纸变蓝的气体(高中阶段),常用此性质检验NH3。
(5)制法①实验室制法反应原理:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。
注意 可用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒验满。欲快速制取NH3可将
浓氨水滴到NaOH固体或生石灰上。②工业制法:N2+3H2 2NH3。
2.铵盐(1)物理性质:一般为白色、易溶于水的晶体。(2)化学性质(主要为“三解”:热解、碱解、水解)(3)检验:取少量固体样品(或溶液),加入浓NaOH溶液,加热,产生的气体使湿润的红色石
蕊试纸变蓝,则证明有N 。
六、绿色化学(1)核心:利用化学原理从源头上减少或消除工业生产对环境造成的污染。(2)原子经济性目标:原子利用率达100%(原子利用率= ×100%)。
1.判断正误,正确的画“√”,错误的画“×”。(1)晶体硅熔点高、硬度大,故可用于制作半导体材料。 ( )(2)硅酸钠溶液应保存在带玻璃塞的试剂瓶中。 ( )(3)用pH试纸测定氯水的pH为4。 ( )(4)漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的。 ( )(5)浓硫酸不能干燥HBr、HI气体,因为HBr、HI还原性较强,能与浓硫酸发生氧化还原
反应。 ( )(6)实验室从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取。 ( )
(7)SO2使酸性KMnO4溶液褪色,体现了SO2的漂白性。 ( )(8)向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有S 。 ( )(9)固氮反应一定属于氧化还原反应。( )(10)铜与浓硝酸反应生成NO2,与稀硝酸反应生成NO,则氧化性:稀硝酸>浓硝酸。 ( )(11)向AgNO3溶液中滴加过量氨水,溶液澄清,说明Ag+与NH3·H2O能大量共存。 ( )
2.化学与生活密切相关。下列叙述正确的是 ( )A.漂白粉与盐酸可混合使用以提高消毒效果B.温室气体是形成酸雨的主要物质C.棉花、麻和蚕丝均为碳水化合物D.干冰可用在舞台上制造“云雾”
3.下列关于硫及其化合物的叙述正确的是 ( )A.试管内壁残留的硫可用酒精洗涤B.SO2使溴水褪色体现SO2的漂白性C.SO2的水溶液长期放置,酸性会增强D.浓硫酸在空气中敞口放置,质量会减小
4.最理想的“原子经济性反应”是指反应物的原子全部转化为期望的最终产物的反
应。下列属于最理想的“原子经济性反应”的是 ( )A.用电石与水制备乙炔的反应B.用溴乙烷与NaOH的乙醇溶液共热制备乙烯的反应C.用苯酚稀溶液与饱和溴水制备2,4,6-三溴苯酚的反应D.用乙烯与氧气在Ag催化下制备环氧乙烷( )的反应
A.I2/CCl4溶液可以用乙酸乙酯萃取分离其中的碘B.操作①为分液,需要使用分液漏斗C.步骤②发生反应:I +5I-+6H+ 3I2↓+3H2OD.操作③为升华(装置如图),可除去粗碘快速结晶时混入的杂质
5.通过下列实验可从I2的CCl4溶液中回收I2。下列说法不正确的是 ( )
考法 氯、硫、氮及其化合物间的转化一、氯及其化合物间的转化1.氯元素的“价—类”二维图
2.氯及其化合物间的转化关系(1)歧化反应 ①Cl2+2OH- Cl-+ClO-+H2O(稀碱,常温)②3Cl2+6OH-(浓) 5Cl-+Cl +3H2O(浓碱,加热)
(2)归中反应 ①2H++Cl-+ClO- Cl2↑+H2O(NaClO与NaCl,酸性条件)②5Cl-+Cl +6H+ 3Cl2↑+3H2O(KClO3与KCl,酸性条件)
二、硫及其化合物间的转化1.硫元素的“价—类”二维图 注意 Na2SO4没有氧化性。
2.硫及其化合物间的转化规律(1)相同价态硫的化合物间的转化 ①SO2+H2O H2SO3②H2SO3+2NaOH Na2SO3+2H2O③Na2SO3+H2SO4 Na2SO4+H2O+SO2↑④Na2SO3+H2O+SO2 2NaHSO3
(2)不同价态含硫物质的转化当硫元素的化合价变化时,一般升高或降低至其相邻的价态,即台阶式升降,可用下图表示。 例如:2SO2+O2 2SO3,S+H2 H2S,SO2+2H2S 3S+2H2O。
三、氮及其化合物间的转化1.氮元素的“价—类”二维图
2.氮及其化合物间的转化关系
(1)歧化反应如:3NO2+H2O 2HNO3+NO2NO2+2NaOH NaNO3+NaNO2+H2O(2)归中反应如:6NO+4NH3 5N2+6H2ONO2+NO+2NaOH 2NaNO2+H2O
例1部分含硫物质的分类与相应化合价关系如图所示。下列推断合理的是 ( ) A.a的浓溶液与b反应一定生成SO2B.SO2有毒,不能用作食品添加剂C.c在空气中燃烧生成SO3D.d既可被氧化,也可被还原
解析 由题图可知,a为H2SO4,b为H2S,c为S,d为亚硫酸盐或亚硫酸氢盐。浓H2SO4有强氧化性,可与H2S反应生成S或SO2,A错误;SO2虽然有毒,但食品中添加适量SO2可起到
漂白、防腐和抗氧化作用(注意用量),B错误;不论空气是否足量,S在空气中燃烧都生
成SO2,C错误;d中S元素的化合价为+4,处于中间价态,既可被氧化,也可被还原,D正确。
例2氨是一种重要的化工原料,根据下图转化判断下列有关表述正确的是 ( ) A.浓硝酸见光易分解且易挥发,应用棕色试剂瓶盛放且用胶塞密封B.戊与丁反应时,氧化剂与还原剂的物质的量之比为1∶2C.实验室中可以采取加热甲物质的方法制取NH3D.向饱和NaCl溶液中依次通入过量的CO2和NH3,然后过滤可制得乙









