






高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用课文ppt课件
展开
这是一份高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用课文ppt课件,共30页。PPT课件主要包含了认识镁及其应用,从海水中提取镁,镁的存在,镁的物理性质,镁的提取流程,镁的化学性质,认识碘及其应用,碘的生理功能,从海带中提取碘,氧化过程等内容,欢迎下载使用。
01 化学了解从海水或海产品中提取镁、碘单质的基本原理和方法
02 能依据物质性质及其变化进行综合利用
镁合金(约含镁80%),密度小,硬度和强度大,大量用于火箭、导弹和飞机等制造业,被称为“国防金属”。
镁元素能维护心肌纤维正常舒缩功能和冠状动脉弹性,有“心脏保护神”的美称,可用来制药。
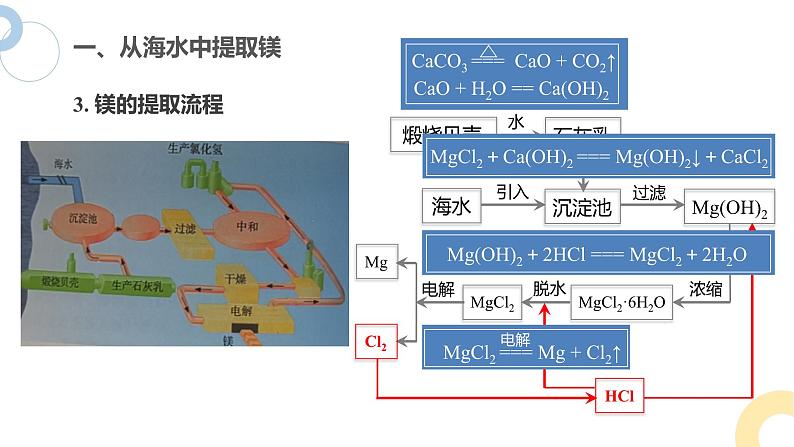
自然界中的镁主要以化合态的形式存在于地壳和海水中,海水中镁的总储量约为 1.8×1015 t
银白色金属光泽,密度较小,有良好的延展性,导电性。
镁合金的密度也较小,但硬度和强度都较大,因此镁合金被大量用于制造火箭、导弹和飞机等。
(1)利用贝壳制备石灰乳
(2) 沉淀Mg2+得到Mg(OH)2
(3) 提取无水氯化镁
(4) 电解无水氯化镁制取镁
(4) 在二氧化碳中燃烧
Mg + 2H+ === Mg2+ + H2↑
镁条剧烈燃烧,生成白色固体,瓶的内壁有黑色物质附着
易失去最外层2个电子,表现强还原性
Mg + 2HCl === MgCl2 + H2↑
碘是一种重要的工业原料,也是人体的必需的微量元素,主要存在于海水和海洋植物中。由于碘在海水中含量太低,目前还不能直接从海水中提取碘。海洋植物如海带、马尾藻等能把海水中的碘富集到是海水中的10万倍以上,所以碘通常来自于海带等海洋植物,那么如何从海带中提碘呢?
特性:淀粉遇碘单质变蓝
紫黑色晶体 ,易升华(刺激性气味,有毒) ,碘的蒸气呈紫红色
在水中溶解度比溴还小,易溶于有机溶剂(如乙醇、CCl4、苯等)
碘是人体的必需微量元素之一,有“智力元素”之称。碘在健康成人体内的总量约为30mg(20~50mg),其中70%~80%存在于甲状腺,是维持人体甲状腺正常功能所必需的元素。当人体缺碘时就会患甲状腺肿,因此碘化物可以防止和治疗甲状腺肿大。多食海带、海鱼等含碘丰富的食品,对于防治甲状腺肿大也很有效。碘的放射性同位素可用于甲状腺肿瘤的早期诊断和治疗。
H2O2 + 2I- + 2H+ === I2 + 2H2O
Cl2 + 2I- === I2 + 2Cl-
2.原因:相比较溴而言I2难挥发,采用萃取的方法更合适
1.方法:用四氯化碳或苯,萃取后分液
在一支试管中加入2~3 mL KI溶液,滴加少量新制氯水,再滴加少量CCl4,振荡,静置。
反应原理:Cl2 + 2KI === I2 + 2KCl
取一定量食盐于试管中,加入适量白醋溶解,得到酸性溶液,然后蘸取该酸性溶液点在碘化钾淀粉试纸上,若试纸变蓝色,即证明有碘元素存在。
海底矿产资源主要包括浅海矿产资源和深海资源。浅海海底的矿产资源是指大陆架和部分大陆架斜坡处的矿产资源,主要是石油与天然气和各类滨海沙矿。海底矿产资源包括多金属结核矿、海底多金属硫化物矿床和磷钙土矿等。
海底蕴含大量的金属矿产和天然气水合物,是宝贵的自然资源,也是人类共同的财富。在水深4000~6000 m的海底,富含钢、镍、钻、锰等金属的多金属结核矿,约有3万亿吨,其中锰的储量可供全世界使用18000年,镍可使用25000年。发现于大陆边缘的天然气水合物,其总储量换算成甲烷气体为1.8×1016 ~ 2.1×1016 m3,大约相当于全世界陆地已探明的煤、石油和天然气总储量的两倍,潜力巨大,被视为21世纪新型绿色能源。
中国有辽阔的海域和大陆架,渤海、黄海、东海和南海水深低于200米的大陆架面积为100多万平方千米。2017年探明,我国在临近各海域的油气储藏量约40~50亿吨。此外,我国也是世界上滨海沙矿种类最多的国家之一。
1.海水开发利用的部分过程如图所示。下列说法错误的是( )A. 向苦卤中通入Cl2是为了提取溴B. 粗盐可采用除杂和重结晶等过程提纯C. 工业生产中常选用NaOH作为沉淀剂D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
2. 海洋中有丰富的食品、矿产、能源、药物和水产资源等,海水的综合利用如图所示。
3. 陕西省某造纸厂制漂车间工人作业时,不慎拧断氯气罐阀门,导致氯气泄漏。Cl2有毒,常用于自来水和游泳池的消毒杀菌。已知硫氰[(SCN)2]的化学性质与Cl2的类似,被称为“拟卤素”,如(SCN)2+2NaOH===NaSCN+NaSCNO+H2O,阴离子的还原性顺序为I->SCN->Br->Cl-。下列说法中不正确的是( )A. 若Cl2、(SCN)2发生泄漏,均可喷洒石灰水进行处理B. KSCN可以与FeCl3溶液反应C. Cl2与KSCN溶液发生反应的离子方程式为Cl2+2SCN-=== (SCN)2+2Cl-D. (SCN)2可以与KBr溶液发生反应:(SCN)2+2KBr === 2KSCN+Br2
4. 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务。下图是某化工厂对海水资源综合利用的示意图:
Ⅱ.提取粗盐后剩余的海水(母液),可用来提取Mg和Br2。(1)若用来提取Mg,根据上述流程图分析,没有涉及的反应类型是________。A.分解反应 B.化合反应 C.置换反应 D.复分解反应(2)氮气和氩均可用做白炽灯的填充气体,但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因:
3Mg+N2 === Mg3N2
(3)若为⑥中反应所需气态氧化剂(Cl2)寻找货源,下列说法合理的是________。A.从外地购买 B.在当地新建生产厂C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环流程⑦将溴单质从混合物中分离出来是基于溴单质具有________性。
5.已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:(已知:将硫氰化钾溶液与氯化铁溶液混合,溶液变为红色)(1)写出该反应的化学方程式:________________________________。(2)将生成的红色溶液分为三等份,进行如下实验(第三份是对照):①第一份中滴加碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈________色,反应的离子方程式:________________________。向该溶液中滴加少量溴水,水溶液又变为红色,则氧化性Br2____________(填“大于”“小于”或“无法确定”) (SCN)2。
2Fe3++2I-=== 2Fe2++I2
FeCl3+3KSCN===Fe(SCN)3+3KCl
5.已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:(已知:将硫氰化钾溶液与氯化铁溶液混合,溶液变为红色)(1)写出该反应的化学方程式:________________________________。(2)将生成的红色溶液分为三等份,进行如下实验(第三份是对照):②第二份中加入少量酸性高锰酸钾溶液,血红色褪去。若含________ml高锰酸钾的溶液完全反应,转移电子2 ml。
2 10 16 2 5 8
相关课件
这是一份化学必修 第一册第三单元 海洋化学资源的综合应用评课ppt课件,共60页。PPT课件主要包含了化合态,Mg2++,耀眼的白光,黑色固体,Cl-+I2,I2+2H2O,加碘盐,甲状腺肿大,制备干燥的HCl气体,Cl2↑等内容,欢迎下载使用。
这是一份高中第三单元 海洋化学资源的综合应用公开课课件ppt,共36页。PPT课件主要包含了学习目标,体系建构,化合态,知识梳理,黑色固体,耀眼的白光,KIO3,知识运用,能力提升,碘离子等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用优质课课件ppt,共25页。PPT课件主要包含了学习目标,化合态,黑色固体,耀眼的白光,KIO3等内容,欢迎下载使用。









