





苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的转化示范课ppt课件
展开(一)原电池的基本概念
1. 定义:原电池是指把化学能转化为电能的装置。
2. 原电池的构成条件:
本质:自发的发生氧化还原反应
①两种活泼性不同的电极(或C棒)②两电极均浸入电解质溶液③形成闭合电路
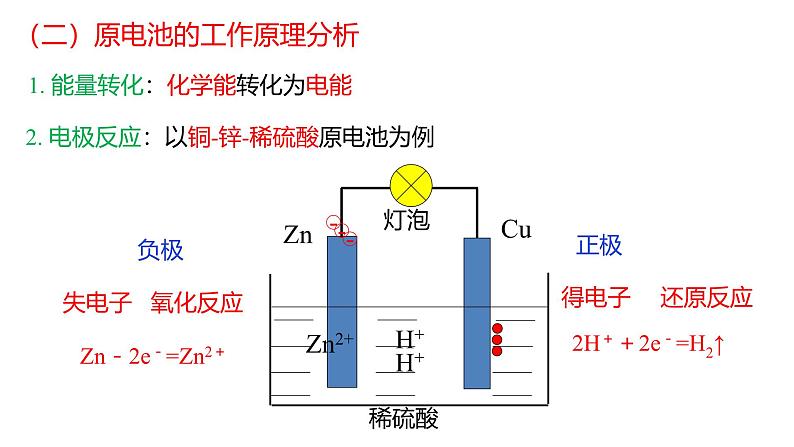
2H++2e-=H2↑
Zn-2e-=Zn2+
(二)原电池的工作原理分析
1. 能量转化:化学能转化为电能
2. 电极反应:以铜-锌-稀硫酸原电池为例
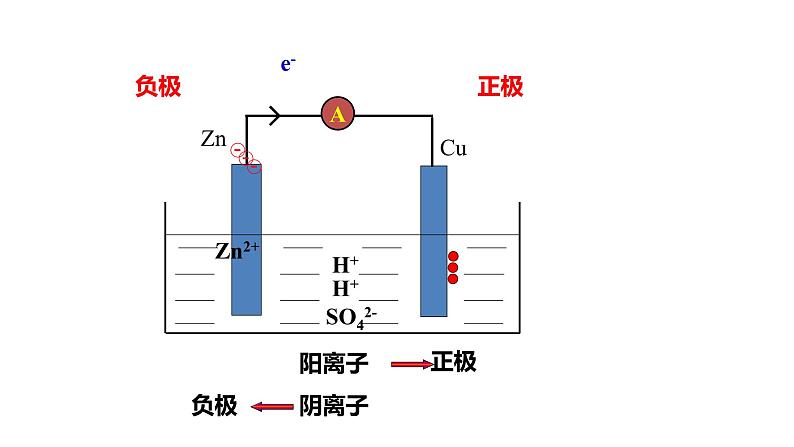
①电子:沿导线(外电路)移动,负极→正极②电流:在导线中,正极→负极③离子:在电解质溶液(内电路)中移动, 阳离子→正极;阴离子→负极 离子不上岸,电子不入水
3. 电流、电子、离子流向:
4、原电池的正负极的判断方法
微观判断(根据电子流动方向)
电子流出的极电子流入的极
较活泼的电极材料较不活泼的电极材料
质量增加的电极工作后 质量减少的电极
工作后,有气泡冒出的电极为正极
发生氧化反应的极发生还原反应的极
宏观判断:①根据电极材料②根据原电池电极发生的反应③根据电极质量的变化④根据电极有气泡冒出:
电极判断:比较得失电子能力,失电子能力强的为负极,得电子为正极
K > Ca > Na > Mg > Al > Zn > Fe … Cu > Hg > Ag > Pt > Au
强氧化性物质(浓HNO3、浓H2SO4)> Ag+ >Fe3+ > Cu2+ > H+(酸) > Pb2+>Sn2+> Fe2+> Zn2+ >H+(水) > Al3+ > Mg2+
练习: 判断下列原电池的正负极?
1、Fe-Cu 浓H2SO4
3、Mg-Al NaOH
2、Fe-Cu H2SO4
作用:①连接内电路,形成闭合回路;②平衡电荷,使溶液呈电中性。
盐桥制法:将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。
Zn-2e-=Zn2+
失e-,沿导线传递,有电流产生
Cu2++2e- =Cu
铜锌双液原 电 池 原 理
6、原电池的表示方法: (-) Zn|Zn2+ (C1) ‖ Cu2+ (C2)|Cu (+) “|”表示液-固相有一界面;“‖”表示盐桥。 在有气体参加的电池中还要表明气体的压力,溶液要表明浓度。
(1)比较金属活动性强弱。
例1、下列叙述中,可以说明金属甲比乙活泼性强的是( )A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;B.在氧化–还原反应中,甲比乙失去的电子多;C.将甲乙作电极组成原电池时甲是负极;D.同价态的阳离子,甲比乙的氧化性强;
(2)比较反应速率快慢
例2 :下列制氢气的反应速率最快的是( )A.纯锌和1ml/L 硫酸;B.纯锌和18 ml/L 硫酸;C.粗锌和 1ml/L 硫酸;D.粗锌和1ml/L 硫酸的反应中加入几滴CuSO4溶液。
例3:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(3)比较金属腐蚀的快慢
(4)判断溶液pH值变化
例4:在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125ml/L,若工作一段时间后,从装置中共收集到 0.168L气体,则流过导线的电子为__________ml,反应后溶液的氢离子的浓度为_________?(溶液体积变化忽略不计)
y =0.015 (ml)
x =0.015 (ml)
=1.75× 10﹣1(ml/L )
Zn-2e-=Zn2+
2H++2e- =H2↑
2 2 22.4
x y 0.168
0.2×0.125×2
2H+ —— 2e- ——H2↑
(5)原电池原理的综合应用
例5:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。“热敷袋”是利用 放出热量。2)炭粉的主要作用是 。3)加入氯化钠的主要作用是 。4)木屑的作用是 。
与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化
氯化钠溶于水,形成电解质溶液.
摩擦生热,产生启动反应的热量,使用“热敷袋”受热均匀.
还原性较强的物质(多是金属电极本身)
酸溶液碱溶液盐溶液或熔融液
1.分析下图所示的四个原电池装置,其中结论正确的是 ( )
A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-= 6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-= Fe2+D.④中Cu作正极,电极反应式为2H++2e-= H2↑
2. 有A,B,C,D,E五块金属片,进行如下实验:①A,B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤ B、E相连后,同时浸入稀H2SO4溶液中,B极质量减小。据此,判断五种金属的活动性顺序是 ( )A.A>B>C>D>E B.A>C>D>B>EC.C>A>B>D>E D.B>D>C>A>E
3.下列说法正确的是 ( )A.构成原电池的两个电极必须是活泼性不同的两种金属B.如图原电池中,电流由锌棒经外电路流向铜棒C.通过构成原电池,能将反应的化学能全部转化为电能D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag, 其中Ag2O作正极,发生还原反应
高中化学苏教版必修二第三单元 化学能与电能的转化图文课件ppt: 这是一份高中化学苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">第三单元 化学能与电能的转化图文课件ppt</a>,共18页。PPT课件主要包含了温故知新,氯碱工业,知识梳理,阳离子交换膜,阳极室,阴极室,阳离子交换膜电解槽,学以致用,铜离子,纯铜做电极等内容,欢迎下载使用。
高中化学苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的转化授课课件ppt: 这是一份高中化学苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">专题2 化学反应与能量转化第三单元 化学能与电能的转化授课课件ppt</a>,共21页。PPT课件主要包含了了解原电池的工作原理,教学目标,电解池,电解原理,交流讨论,原理示意图,电解原理的应用等内容,欢迎下载使用。
苏教版选修4 化学反应原理专题一 化学反应与能量变化第三单元 金属的腐蚀与防护评课ppt课件: 这是一份苏教版选修4 化学反应原理<a href="/hx/tb_c22677_t3/?tag_id=26" target="_blank">专题一 化学反应与能量变化第三单元 金属的腐蚀与防护评课ppt课件</a>,共40页。PPT课件主要包含了化学腐蚀,金属的腐蚀,2原理,1定义,3影响因素,家用燃气灶,电化学腐蚀,科学探究,不同条件下铁钉的腐蚀,水膜呈弱酸性或中性等内容,欢迎下载使用。













