





高中化学苏教版必修二第三单元 化学能与电能的转化说课ppt课件
展开根据原电池的反应原理,人们设计和生产出了形形色色的化学电源,包括一次电池、二次电池和燃料电池等。它们在生产、生活和国防等诸多领域得到了广泛的应用。
在化学电源中,常见的是一次电池。一次电池中发生氧化还原反应的物质大部分被消耗后就不能再使用。使用最广泛的一次电池是干电池,如普通锌锰干电池、碱性锌锰电池等。
包括:普通锌锰干电池、碱性锌锰干电池、银锌纽扣电池等
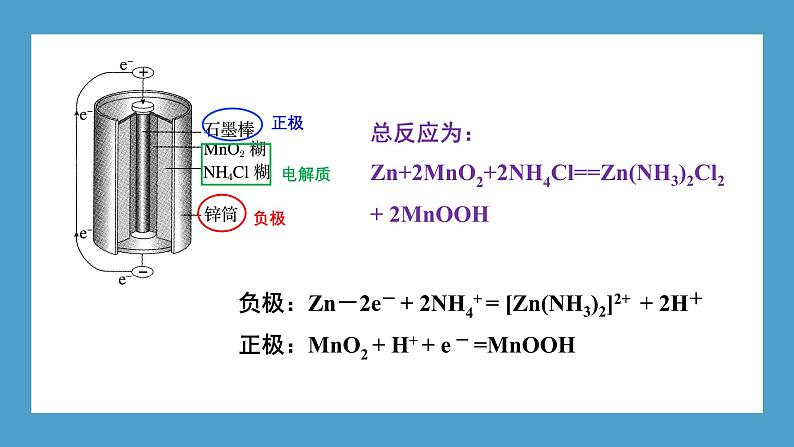
1. 普通锌锰干电池是最早进入市场的实用电池,其构造如图1-10所示。
负极:Zn-2e- + 2NH4+ = [Zn(NH3)2]2+ + 2H+ 正极:MnO2 + H+ + e - =MnOOH
总反应为:Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2 + 2MnOOH
普通锌锰干电池制作简单、价格便宜,但存在放电时间短、放电后电压下降较快等缺点。
氯化铵溶液显酸性,会跟锌皮发生反应,使用一段时间后电池会鼓胀,漏液。后来把氯化铵换成了碱性的物质,制成了碱性锌锰干电池。
碱性锌锰电池比普通锌锰干电池性能优越,它的比能量[电池单位质量或单位体积所输出电能的多少,单位为(W·h)/kg或(W·h)/L]大,能提供较大电流并连续放电。目前,在我国碱性锌锰电池正在逐渐代替普通锌锰干电池。
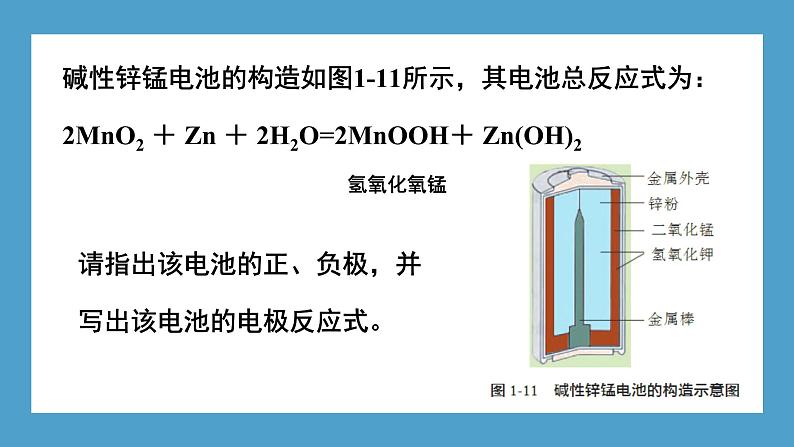
碱性锌锰电池的构造如图1-11所示,其电池总反应式为:2MnO2 + Zn + 2H2O=2MnOOH+ Zn(OH)2 氢氧化氧锰
请指出该电池的正、负极,并写出该电池的电极反应式。
负极:Zn-2e- + 2OH - = Zn(OH)2 正极:MnO2 + H2O + e - =MnOOH + OH -
优点:克服了普通锌锰干电池的缺点,比能量大,能提供较大电流并持续放电
2. 一种银锌纽扣电池(构造示意图见1-12)的电极分别为 Ag2O和Zn,电解质溶液为KOH溶液,发生氧化还原反应后生成Ag和ZnO,请写出该电池的电极反应式和电池总反应式。
总反应式为:Zn +Ag2O + H2O == 2Ag + Zn(OH)2
负极:Zn-2e-+ 2OH-==Zn(OH)2 正极:Ag2O + H2O +2e-==2Ag + 2OH-
优点:电池比能量大,电压稳定,存储时间长,适宜小电流持续放电
二次电池又称为充电电池或蓄电池,放电后可以再充电使活性物质获得再生,因此二次电池可以多次重复使用。
包括:铅蓄电池、镍铬电池、锂电池、锂离子电池等
铅蓄电池是最常见的二次电池。由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产和生活中使用广泛,如汽车等机动车辆多数使用这种蓄电池。铅蓄电池的缺点是比能量低,废弃后会污染环境等。
铅蓄电池由两组平行的栅状铅合金极板交替排列作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸。
铅蓄电池的放电反应是原电池反应,其电极反应式和电池总反应式为:
铅蓄电池的充电反应是上述反应的逆过程:
铅蓄电池的充、放电原理可以用下列化学方程式表示:
由铅蓄电池的电池反应可以看出,随着放电反应的进行,硫酸的浓度不断下降,密度不断减小,人们常常根据硫酸密度的大小来判断铅蓄电池是否需要充电。
在电能转化为化学能的装置中,人们常将发生氧化反应的电极叫做阳极,发生还原反应的电极叫做阴极。
随着信息技术的发展,为了适应移动通信、便携式电脑和各种电子产品等的广泛使用,科研工作者不断研制出小型化、高比能量、工作寿命长、不需要特殊维护的二次电池。目前已开发出镍镉电池、镍氢电池、银锌电池、锂电池和锂离子电池等新型二次电池。
与其他化学电池一样,锂离子电池也是由正极、负极和电解质溶液三部分组成的。正极材料多采用磷酸铁锂(LiFePO 4,也称磷酸亚铁锂)或钴酸锂(LiCO 2)等,一般是具有可供锂离子嵌入或脱嵌(即可逆嵌脱)结构的化合物。负极材料大多数是碳素材料,如人工石墨、碳纤维、天然石墨等。研究表明,将纳米氧化钛和纳米氧化硅添加在传统的石墨、纳米碳管里面,可以极大地提高锂电池的充放电量和充放电次数。
锂离子电池的构成及工作原理
电解质溶液是锂离子的载体,是将锂盐溶解在一定的非水、非质子性的有机溶剂中制成的,其作用是在电池内部正、负极之间形成良好的离子移动通道。 在放电过程中,锂离子从负极脱出,嵌入到正极。在充电过程中,锂离子从正极材料晶格间脱离出来,嵌入到负极材料里。在充放电过程中,锂离子在正、负极间不断地进行可逆嵌脱。
以钴酸锂-石墨锂电池为例,放电时的电极反应式可表示如下:
燃料电池是利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。燃料电池的氧化剂和还原剂不是储藏在电池内部,而是在工作时不断从外部输入,同时将电极反应产物不断排出电池,因此燃料电池能连续不断地提供电能。
燃料电池种类很多。氢氧燃料电池是以氢气为燃料,氧气为氧化剂的燃料电池,其工作原理如图1-16所示。氢气、氧气分别在多孔金属电极上发生氧化、还原反应,其反应可表示如下:
假如将目前地球上通过化石燃料燃烧产生的能量均改为通过氢氧燃料电池获得,那么可能会出现哪些新的问题?请针对其中的某一问题,提出解决方案。
除氢气外,甲烷、甲醇、肼(N2H4)、氨等都可以作为燃料电池的燃料。燃料电池的能量转换效率远高于普通燃料燃烧的能量转换效率,应用燃料电池的发电站,具有能量转换效率高、废弃物排放少、运行噪音小等优点。因此,燃料电池具有广阔的发展前景。
①氧化剂与还原剂在工作时不断补充;②反应产物不断排出;③能量转化率高(超过80%),普通的只有30%,有利于节约能源。缺点:体积较大、附属设备较多优点:能量转换率高、清洁、对环境好
1.燃料电池与前几种电池的差别:
2. 燃料电池的规律:
①燃料做负极,助燃剂氧气为正极 ②电极材料一般不参加化学反应,只起传导电子的作用。
实验准备: 学生电源、U形管、铁架台、橡胶塞两个、石墨棒两支、玻璃导管两支、石英钟、鳄鱼夹、导线若干、6 ml·L-1稀硫酸。
制作简单的氢氧燃料电池
实验步骤: (1)将石墨棒和玻璃导管插入橡胶塞中,注意调节石墨棒和玻璃导管伸入U形管内的长度。 (2)将橡胶塞塞入U形管管口,检查装置气密性,标记橡胶塞底部到达的位置。 (3)取出橡胶塞,往U形管中注入适量6 ml·L-1稀硫酸,以接近橡胶塞底部刚才所标记的位置为宜。
(4)塞紧橡胶塞,接通学生电源,注意观察实验现象,当一端玻璃导管内的液柱接近溢出时,切断学生电源。 (5)取出石英钟内的干电池,将导线与石英钟的正、负极相连,观察石英钟指针(图1-18)。
结合实验现象,请思考以下问题: (1)连接石英钟时,如何判断该氢氧燃料电池的正、负极?请说明理由。 (2)什么现象可以证明处于不同电极的氢气和氧气发生了反应?
火力发电是我国电力的主要来源。我国发电供热用煤占全国煤炭生产总量的50%左右,发电效率约40%。同时,全国大约90%的二氧化硫和80%的二氧化碳的排放量也是由煤燃烧产生的。20世纪末,各国热门研究的整体煤气化联合循环(IGCC)发电技术(煤气化是把固体的煤变成可燃烧的气体燃料的技术),可以使总发电效率达到50%~60%。
目前,我国正在开展整体煤气化熔融碳酸盐燃料电池(IG-MCFC)发电系统的开发研究,将燃料电池发电技术与整体煤气化联合循环发电技术相结合,该技术是21世纪洁净煤发电技术的一个重要方向。请查阅有关资料和数据,从能量转化、资源的合理利用、环境保护等角度评价该技术发展能否在解决能源问题中发挥作用。
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4溶液,电池放电时的反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列对电池放电时的分析正确的是( )A.Pb为正极被氧化B.电子从PbO2流向外电路C.SO42-向PbO2处移动D.电解质溶液pH不断增大
高中化学苏教版必修二第三单元 化学能与电能的转化图文课件ppt: 这是一份高中化学苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">第三单元 化学能与电能的转化图文课件ppt</a>,共18页。PPT课件主要包含了温故知新,氯碱工业,知识梳理,阳离子交换膜,阳极室,阴极室,阳离子交换膜电解槽,学以致用,铜离子,纯铜做电极等内容,欢迎下载使用。
高中化学苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的转化授课课件ppt: 这是一份高中化学苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">专题2 化学反应与能量转化第三单元 化学能与电能的转化授课课件ppt</a>,共21页。PPT课件主要包含了了解原电池的工作原理,教学目标,电解池,电解原理,交流讨论,原理示意图,电解原理的应用等内容,欢迎下载使用。
苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的转化教案配套ppt课件: 这是一份苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">专题2 化学反应与能量转化第三单元 化学能与电能的转化教案配套ppt课件</a>,共25页。PPT课件主要包含了温故知新,OH-,Cl2↑,H2↑,交流讨论,混合遇火或遇强光爆炸,总结归纳,氯碱工业,反应原理,Cl2等内容,欢迎下载使用。













