


苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的转化教案配套ppt课件
展开1.了解氯碱工业、电镀、铜的电解精炼等的反应原理。2.能够认识电解在实现物质转化和储存能量中的具体应用。
证据推理与模型认知:建立电解应用问题的分析和电解相关计算的思维模型,加深对电解原理的理解和应用。
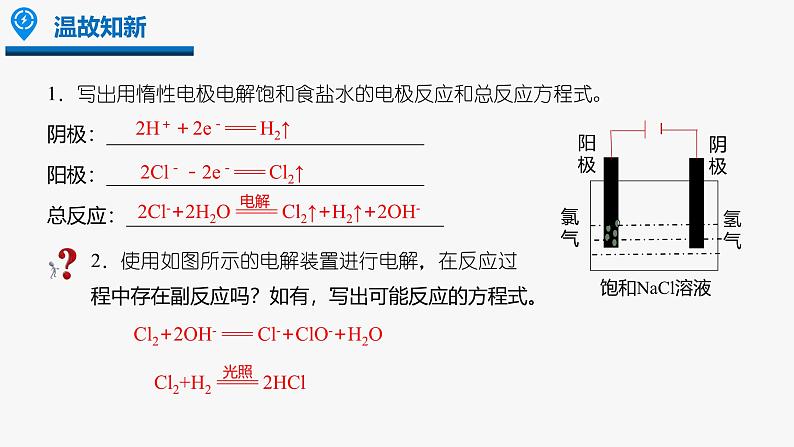
1.写出用惰性电极电解饱和食盐水的电极反应和总反应方程式。阴极:________________________________阳极:________________________________总反应:________________________________
2H++2e-=== H2↑
2Cl--2e-=== Cl2↑
Cl2+2OH- === Cl-+ClO-+H2O
2.使用如图所示的电解装置进行电解,在反应过程中存在副反应吗?如有,写出可能反应的方程式。
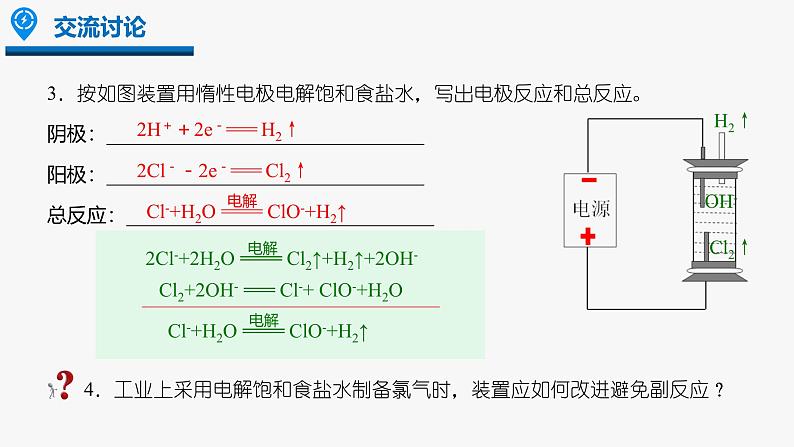
3.按如图装置用惰性电极电解饱和食盐水,写出电极反应和总反应。阴极:________________________________阳极:________________________________总反应:_______________________________
Cl2+2OH- === Cl-+ ClO-+H2O
________________________________________
4.工业上采用电解饱和食盐水制备氯气时,装置应如何改进避免副反应?
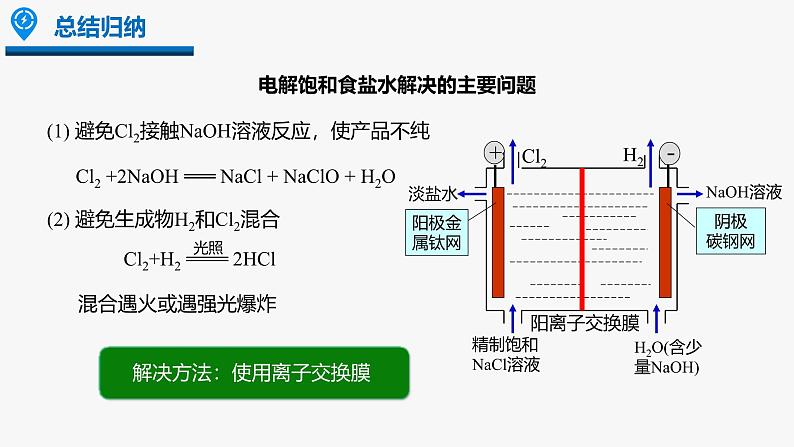
(2) 避免生成物H2和Cl2混合
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
Cl2 +2NaOH === NaCl + NaClO + H2O
电解饱和食盐水解决的主要问题
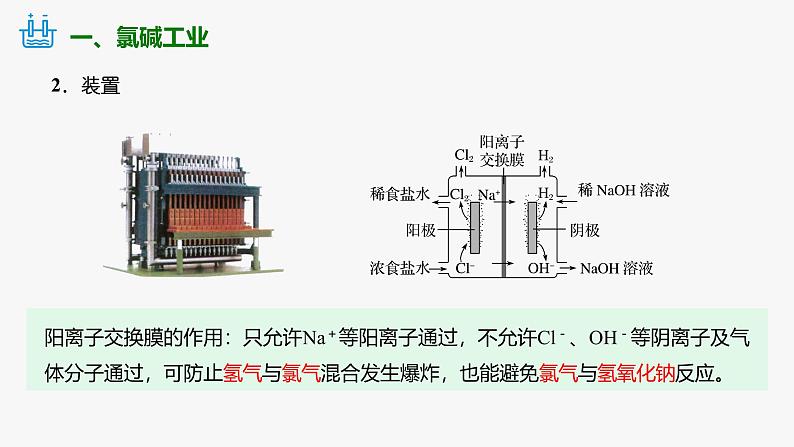
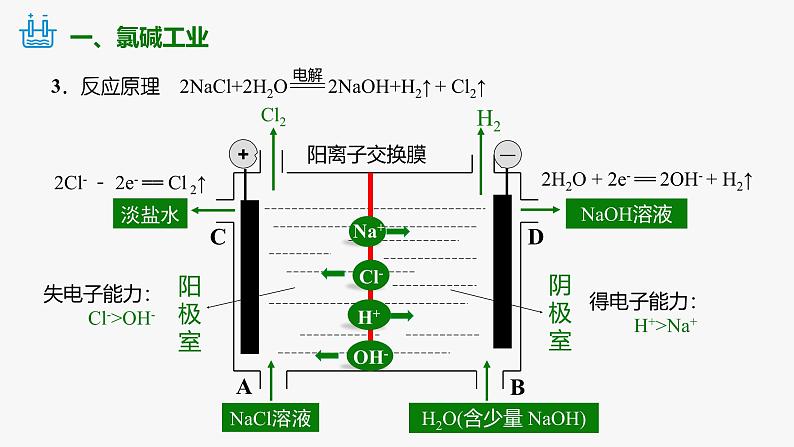
1.概念:习惯上把电解饱和食盐水的工业生产叫做氯碱工业。
阳离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可防止氢气与氯气混合发生爆炸,也能避免氯气与氢氧化钠反应。
失电子能力: Cl->OH-
得电子能力: H+>Na+
2Cl- - 2e- == Cl 2↑
2H2O + 2e- == 2OH- + H2↑
NaOH溶液
4.氯碱工业产品及其应用
(1)氯碱工业产品主要有NaOH、Cl2、H2、含氯漂白剂等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、有机合成、农药等领域中广泛应用。
按如图所示安装仪器,电极材料为石墨,电解质溶液为饱和食盐水(同时滴入几滴酚酞)。
(2)用惰性电极电解饱和食盐水的过程中,收集到的Cl2的体积一般小于H2的体积,请分析原因。
提示 Cl2在水中的溶解度比H2大,且Cl2会与电解产生的NaOH反应而被消耗。
提示 阴极可以更换为活泼金属材料,但不能更换为金属铝等可以与强碱发生反应的金属电极;阳极必须用惰性电极。
(1)实验所用的电极材料为石墨,能否更换为活泼金属材料?
提示 接通电源后,阴极区溶液变红色。原因:H2O电离出的H+放电,使c(OH-)增大,即阴极区产生碱,使溶液变红色。
(3)接通电源后,哪个电极附近的颜色发生了变化?为什么?
(4)若将阳极材料改用铜片,电解质溶液改用硫酸铜溶液进行电解,能观察到何种现象?你能解释反应原理吗?
提示 铜在阳极为活性电极,直接失电子形成Cu2+进入溶液 阴极Cu2+得到电子形成铜单质析出
电解——人 类创造新物质的重要手段
电的发明是人类历史上一个重要的里程碑,不仅提高了人类的生活质量,还实现了从电能到化学能的转变,在化学领域中“颠覆”了对传统的化学变化的认识,一些不能进行的化学反应在通电条件下成为了现实。电解帮助人类创造出更多自然界不存在的新物质,成为化学重要分支学科—— 电化学或能源化学的基础,因此也形成了电解工业(或称电化学工艺)。从本质上看,电解就是借助电流分解反应物,将电子提供给溶液或熔融态中的某些微粒,使其获得电子生成新的物质。在使用电解手段之前铝是稀缺金属,时至今日每年通过电解得到的铝已逾千万吨计,成为生产、生活中常用的金属材料。电解除广泛应用于金属矿物冶炼、金属精炼外,还促进了电镀、污水处理等领域的技术革命,为新的制造业的发展提供了理论基础。
利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。
镀层金属通常是一些在空气或溶液中不易发生变化的金属(如铬、镍、银)和合金(如黄铜)。
电解质溶液:含有镀层金属阳离子的电解质溶液——硫酸铜溶液
铁钉镀锌:根据电解原理,设计在铁钉上镀锌的实验方案
阳极:Zn-2e-===Zn2+
阴极:Zn2++2e-===Zn
与金属制件相比,塑料电镀制品不仅可以实现很好的金属质感, 而且能减轻制品重量,在有效改善塑料外观及装饰性的同时,也改善了其在电、热及耐蚀等方面的性能,提高了其表面机械强度。但电镀用塑料材料的选择却要综合考虑材料的加工性能、电镀的难易程度以及尺寸精度等因素。
随着工业的迅速发展、塑料电镀的应用日益广泛,成为塑料产品中表面装饰的重要手段之一.目前国内外已广泛在ABS、聚丙烯、聚砜、聚碳酸酯、尼龙、 酚醛玻璃纤维增强塑料、聚苯乙烯等塑料表面上进行电镀, 其中尤以ABS塑料电镀应用最广,电镀效果最好。
2.粗铜成分(1)主要成分:_______。(2)杂质金属:比铜活泼的有_______ 等。不比铜活泼的有 _______等。
主要反应:Cu(粗铜)-2e-===Cu2+
Ag、Au等活动性较弱的金属在阳极沉积形成阳极泥
Cu2++2e-===Cu(精铜)
其他反应:Zn-2e-===Zn2+等
阳极:2Cl- - 2e- == Cl2↑
阴极: 2H2O + 2e- == 2OH- + H2↑
阳极(镀层金属):M - ne- == Mn+
阴极(镀件):Mn++ ne- == M
阳极: Cu(粗铜)-2e-===Cu2+
阴极:Cu2++2e-===Cu(精铜)
1.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A.阳极发生还原反应,其电极反应式:Ni2++2e﹣ == NiB.电解过程中,阳极质量的减少与阴极质量的增加相等C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中只有Cu和Pt
(2)阳极反应式为 ;阴极反应式为 。(3)可观察到的现象是待镀金属表面 ,银 。(4)含银离子的溶液浓度的变化是 。
2.某电镀银实验装置如图所示。
请回答下列问题:(1)银为 金属,与直流电源的 相连,作阳极;待镀金属与直流电源的 相连,作阴极;含银离子的溶液为 ,含有镀层金属离子。
Ag-e-===Ag+
Ag++e-===Ag
高中化学苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的转化授课课件ppt: 这是一份高中化学苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">专题2 化学反应与能量转化第三单元 化学能与电能的转化授课课件ppt</a>,共21页。PPT课件主要包含了了解原电池的工作原理,教学目标,电解池,电解原理,交流讨论,原理示意图,电解原理的应用等内容,欢迎下载使用。
苏教版必修二第三单元 化学能与电能的转化集体备课ppt课件: 这是一份苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">第三单元 化学能与电能的转化集体备课ppt课件</a>,共25页。PPT课件主要包含了温故知新,交流讨论,氧化反应,还原反应,Cl-Na+,电解和电解池,1电解,1直流电源,2阴阳极,4形成闭合回路等内容,欢迎下载使用。
高中化学苏教版必修二第三单元 化学能与电能的转化说课ppt课件: 这是一份高中化学苏教版必修二<a href="/hx/tb_c22590_t3/?tag_id=26" target="_blank">第三单元 化学能与电能的转化说课ppt课件</a>,共36页。PPT课件主要包含了化学电源的分类,一次电池,学以致用,二次电池,拓展视野,燃料电池,选择决策,基础实验,批判性思维,课堂训练等内容,欢迎下载使用。













