
2023-2024学年北京市丰台区高三上学期期末化学试题(含解析)
展开
这是一份2023-2024学年北京市丰台区高三上学期期末化学试题(含解析),共23页。试卷主要包含了单选题,简答题等内容,欢迎下载使用。
1.《本草经集注》中记载:“其黄黑者名鸡屎矾[Cu2OH2CO3或Cu2OH2SO4],不入药用,惟堪镀作,以合熟铜(铜单质)。投苦酒(醋酸)中,涂铁皆作铜色,外虽铜色,内质不变。”下列说法不正确的是
A. “不入药用”是因鸡屎矾可溶于胃酸,产生的Cu2+可使蛋白质变性
B. 鸡屎矾“投苦酒(醋酸)中”,反应前后各元素化合价不变
C. “苦酒(醋酸)”中碳原子均为sp3杂化
D. “涂铁皆作铜色,外虽铜色,内质不变”是指Fe从溶液中置换出Cu,且覆盖在Fe表面的Cu阻止反应继续进行
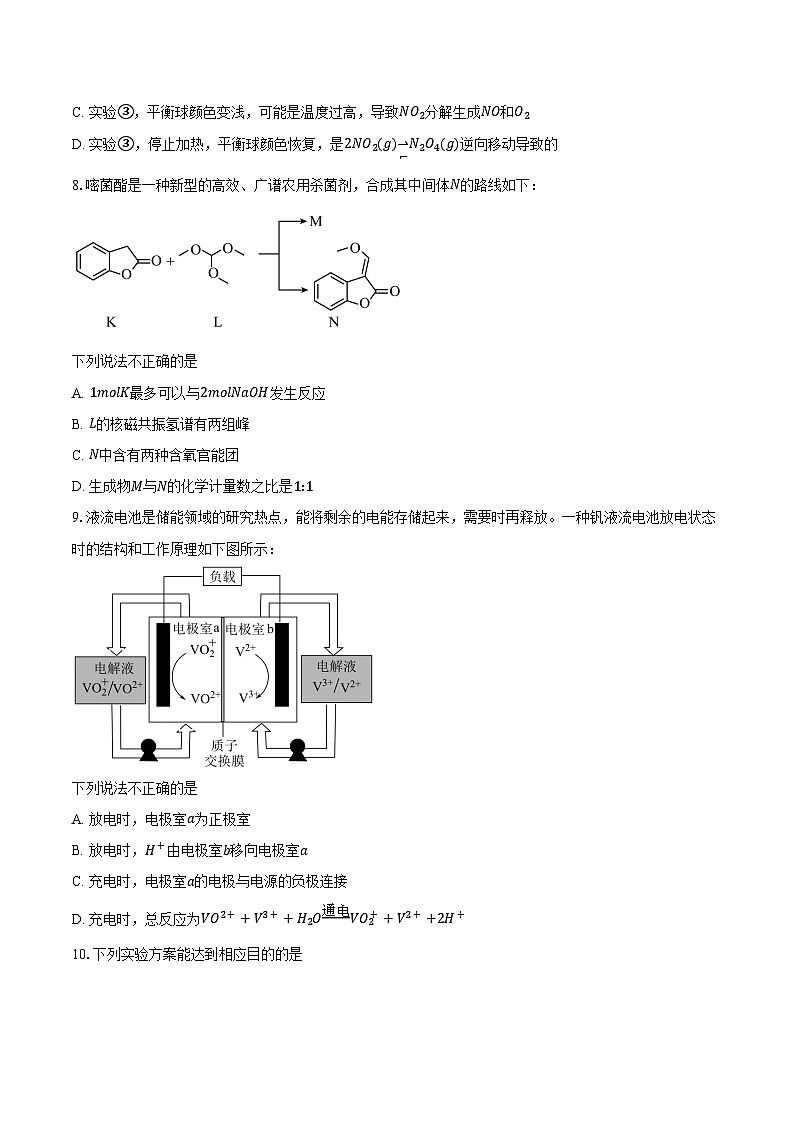
2.下列化学用语或图示表达正确的是
A. NO3−的VSEPR模型:
B. 反−2−丁烯的分子结构模型:
C. NH3的电子式:
D. 基态Cr原子的价层电子排布式:3d44s2
3.下列过程与取代反应无关的是
A. 用油脂生产肥皂B. 氨基酸形成多肽
C. 葡萄糖在酶的作用下转化为二氧化碳D. 核糖核苷酸分子间脱水形成核糖核酸
4.下列方程式与所给事实不相符的是
A. 人工固氮:N2+3H2⇌高温高压催化剂2NH3
B. NaHCO3用于焙制糕点:2NaHCO3=ΔNa2CO3+H2O+CO2↑
C. 向NaHSO4溶液中加入BaOH2至溶液显中性:H++SO42−+OH−+Ba2+=BaSO4↓+H2O
D. 久置氯水变为无色:Cl2+H2O⇀↽H++Cl−+HClO、2HClO光照 2H++2Cl−+O2↑
5.下列物质性质的比较,与氢键无关的是
A. 密度:水>冰
B. 熔点:NH4Cl>HCl.
C. 沸点:
D. 与碱基配对的能力:
6.用NA表示阿伏加德罗常数。下列说法正确的是
A. 1mlN2H4含有π键的数目为NA
B. 1L0.1ml⋅L−1NH4Cl溶液含NH4+的数目为0.1NA
C. 14g乙烯和丙烯的混合气体含有的极性共价键数为2NA
D. 22.4L(标准状况)Cl2与足量NaOH溶液充分反应,电子转移数为2NA
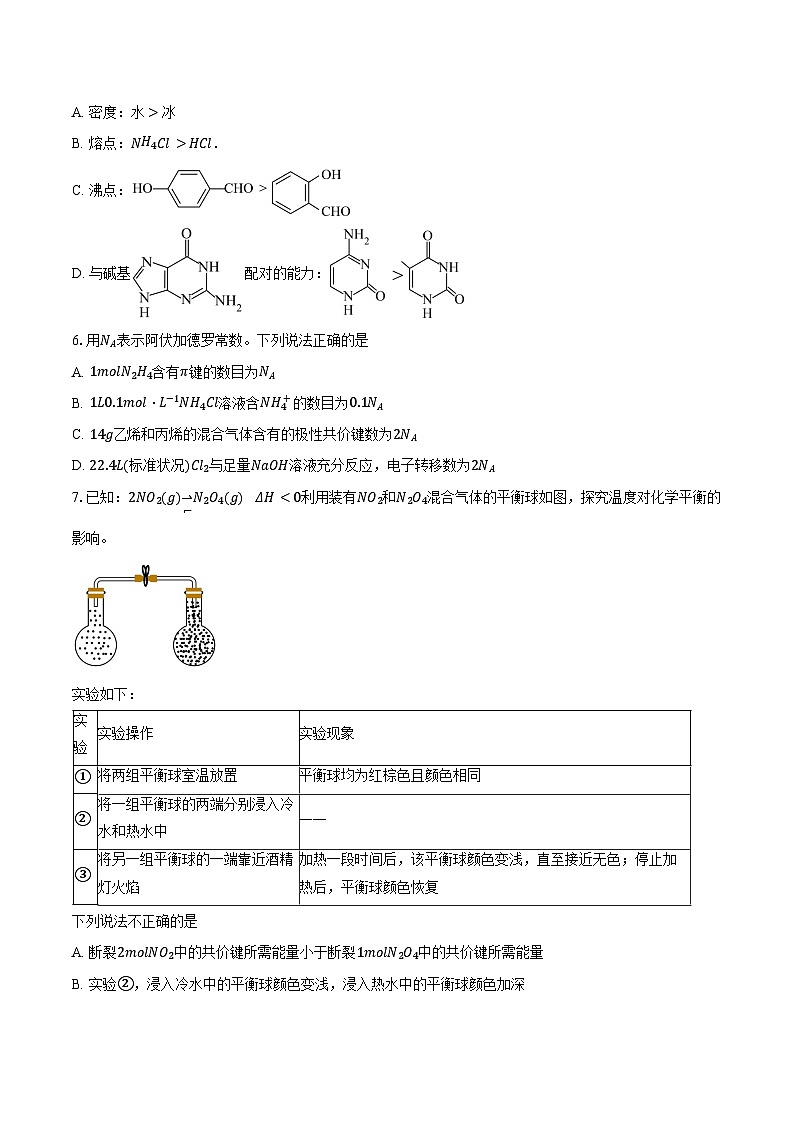
7.已知:2NO2g⇀↽N2O4g ΔHKa1H2CO3,与题中所给的信息相悖,说明向NaHCO3溶液中加入NaHSO3,不能生成H2CO3或CO2, B正确;
C.过程I所得NaHCO3和Na2SO3混合溶液中存在电荷守恒:cNa++cH+=2cSO32−+cHSO3−+cHCO3−+2cCO32−+cOH−, C正确;
D.过程II所得溶液中,NaHSO3存在物料守恒:则cNa+=cHSO3−+cSO32−+cH2SO3, D错误;
故选D。
12.D
【解析】A.由图可知,K分子中含有如图∗所示的手性碳原子:、M分子中含有如图∗所示的手性碳原子,故A正确;
B.酯基能和强酸、强碱溶液反应,则使用该材料时应避免接触强酸或强碱,故B正确;
C.由合成过程可知,每生成1个M分子,需要(m+n)个CO2,则生成1mlM参加反应的CO2的物质的量为(m+n)ml,故C正确;
D.由图可知,K分子、L分子中的碳氧环断裂与二氧化碳发生加聚反应生成M,所以合成M的过程中会产生含五元环的副产物,故D错误;
故选:D。
13.B
【解析】A.CuSO4溶液pHKspZnS>KspPbS
(4)1:4
(5)Mn3O4被O2氧化
【解析】(1)①酸浸时,粉碎矿石、适当升高温度、适当增加盐酸浓度、搅拌等措施能加快浸出速率,故答案为:粉碎矿石、适当升高温度或适当增加盐酸浓度或搅拌;
②由题意可知,硫化铅与二氧化锰的反应为硫化铅、二氧化锰与溶液中的氯离子、氢离子反应生成四氯化铅离子、锰离子、硫酸根离子和水,反应的离子方程式为PbS+4MnO2+4Cl−+8H+=PbCl42−+SO42−+4Mn2++4H2O;
③由题意可知,将盐酸间隔一定时间分两次加入的目的是将硫元素转化为硫酸根离子,防止硫元素转化为硫单质覆盖在矿物表面,阻碍反应继续进行,导致浸取率降低,故答案为:防止单质S覆盖在矿物表面,阻碍反应进行或方铅矿量一定时,提高Mn2+浸出量;
(2)由题意可知,除铁时发生的反应为二氧化锰与溶液中的亚铁离子和水反应生成碱式氧化铁沉淀和氢离子,反应的离子方程式为MnO2+2Fe2++2OH−=2FeOOH+Mn2+;
(3)由滤渣D中不含有硫化锰可知,三种硫化物中硫化锰的溶度积最大,由滤液C中铅离子浓度小于锌离子可知,硫化铅的溶度积小于硫化锌,则三种硫化物中硫化锰的溶度积大小顺序为KspMnS>KspZnS>KspPbS;
(4)由分析可知,加入氨水后,通入空气氧化的目的是将溶液中的锰离子转化为四氧化三锰,反应的离子方程式为6Mn2++6NH3·H2O+O2=2Mn3O4+6NH 4++6H+,由四氧化三锰的结构式可知,氧化物中二价锰离子和三价锰离子的个数比为1:2,则反应中氧化剂氧气和还原剂锰离子的物质的量之比为1:4;
(5)5 ℎ后随干燥时间的延长,产品中的锰含量下降说明四氧化三锰被空气中的氧气氧化,导致产品中混用杂质,使得氧元素的质量增大、锰元素的质量减小,故答案为:Mn3O4被O2氧化;
17.(1)浓硝酸、浓硫酸/Δ
(2)+→ DMSO/60+CH3COOH
(3)取代反应
(4)保护氨基
(5)+CH3COCOOH→ 一定条件+H2O
(6)
【解析】(1)根据分析可知,A发生硝化反应生成B,则需要的试剂和条件为浓硝酸、浓硫酸/Δ。
(2)
从题中可知,两个乙酸反应生成a和水,则a为,C为,与发生取代反应生成D,化学方程式为+→ DMSO/60+CH3COOH。
(3)E中肽键水解生成F,反应类型为取代反应。
(4)从反应C到F的流程中可知,C中氨基先参与了反应,最后又重新生成,所以C→D的目的是保护氨基。
(5)
根据分析可知,G与CH3COOH反应生成H和水,反应的化学方程式为+CH3COCOOH→ 一定条件+H2O。
(6)
①M与发生已知信息的反应生成I,则M为,L异构化得到M,K与NH3先发生加成反应再发生消去反应生成L,则K为。
②M生成I的过程中先生成,可以发生缩聚反应生成高分子化合物。
18.(1)C+O2(g)=CO2(g)、2Mn+O2(g)=2MnO( )
(2)CO2+H2O+Li2CO3=2LiHCO3
(3)还原剂
(4)当柠檬酸浓度过高时,浸出过程中H+不能明显被消耗,剩余的H+会抑制C6H6O72−的形成,不利于C2+形成配合物
(5) 阳极 CC6H6O7+2e−+C6H8O7=C+2C6H7O7− pH3∼4时,随pH增大,cH+降低,H+竞争放电能力减弱,C的回收率增加;
pH4∼6时,随pH增大,促进C6H8O7电离,cC6H6O72−增大,形成的CC6H6O734−、CC6H6O722−更稳定,不易放电,C的回收率下降
【解析】(1)焙烧过程中未得到Mn单质,若计算2MnO(s)+C(s) =2Mn(s)+CO2(g)的ΔH,需要知道的C(s)+O2(g)=CO2(g)、2Mn(s)+O2(g)=2MnO(s)的ΔH
(2)水浸过程中通入CO2与碳酸锂反应生成碳酸氢锂,可提高锂的浸出率,原因为CO2+H2O+Li2CO3=2LiHCO3
(3)以柠檬酸(C6H8O7,三元弱酸)和H2O2作为浸出剂,与LiCO2反应浸出C2+,则H2O2为还原剂
(4)当柠檬酸浓度从1.25ml·L−增加到1.75ml·L−时,钴的浸出率逐渐下降,可能的原因是当柠檬酸浓度过高时,浸出过程中H+不能明显被消耗,剩余的H+会抑制C6H6O72−的形成,不利于C2+形成配合物
(5)①电解法回收钴,阴极生成钴单质则石墨为阳极;CC6H6O7在电极放电生成钴单质电极反应式为CC6H6O7+2e−+C6H8O7=C+2C6H7O7−;随着pH的升高,C的回收率先增加后下降的可能原因是pH3∼4时,随pH增大,cH+降低,H+竞争放电能力减弱,C的回收率增加;
pH4∼6时,随pH增大,促进C6H8O7电离,cC6H6O72−增大,形成的CC6H6O734−、CC6H6O722−更稳定,不易放电,C的回收率下降
19.(1) Cu+2H2SO4(浓)Δ CuSO4+SO2↑+2H2O 饱和NaHSO3溶液
(2)取少量棕黄色溶液于试管中,加水稀释,观察到有白色沉淀产生
(3) SO2−2e−+2H2O=SO 42−+4H+ 加入浓盐酸前,Cu2+氧化性弱,不能氧化SO2;加入浓盐酸后,Cu+与Cl−形成[CuCl3]2−,促进Cu2++e−=Cu+发生,Cu2+氧化性增大,能够氧化SO2
(4)SO2+2Cu2++6Cl−+2H2O=SO 42−+2[CuCl3]2−+4H+
(5)SO2+6Cu+4H++12Cl−=Cu2S+4[CuCl3]2−+2H2O
(6)Na2S
【解析】(1)装置A中铜与浓硫酸共热生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)Δ CuSO4+SO2↑+2H2O;装置B除去二氧化硫中的硫酸,则B中试剂X是饱和NaHSO3溶液;
(2)CuCl难溶于水,在水溶液中存在平衡: CuCl(白色)+2Cl¯⇀↽[CuCl3]2−;实验证实了棕黄色溶液中含[CuCl3]²−,实验方案为取少量棕黄色溶液于试管中,加水稀释,观察到有白色沉淀产生;
(3)SO2与CuSO4溶液反应生成SO42−和 Cu+,则氧化反应为:SO2−2e−+2H2O=SO 42−+4H+还原反应: Cu2++e−=Cu+,根据电极反应式,分析加入浓盐酸前后实验现象有差异的可能原因加入浓盐酸前,Cu2+氧化性弱,不能氧化SO2,加入浓盐酸后,Cu+与Cl−形成[CuCl3]2−,促进Cu2++e−=Cu+发生,Cu2+氧化性增大,能够氧化SO2;故答案为: SO2−2e−+2H2O=SO 42−+4H+;加入浓盐酸前,Cu2+氧化性弱,不能氧化SO2,加入浓盐酸后,Cu+与Cl−形成[CuCl3]2−,促进Cu2++e−=Cu+发生,Cu2+氧化性增大,能够氧化SO2;
(4)综上分析,SO2在盐酸中与Cu2+反应生成[CuCl3]²和硫酸根离子,其反应离子方程式为SO2+2Cu2++6Cl−+2H2O=SO 42−+2[CuCl3]2−+4H+;
(5)经检验黑色固体是Cu2S,SO₂在盐酸中与Cu单质反应生成硫化铜、[CuCl3]2−和水,其反应的离子方程式为SO2+6Cu+4H++12Cl−=Cu2S+4[CuCl3]2−+2H2O;
(6)实验ii中,Cu片附近溶液变棕黄色生成[CuCl3]²,a为浓盐酸,iii指针偏转幅度更大,结合(5)方程式可知物质b是Na2S;
故答案为:Na2S溶液。
实验
实验操作
实验现象
①
将两组平衡球室温放置
平衡球均为红棕色且颜色相同
②
将一组平衡球的两端分别浸入冷水和热水中
——
③
将另一组平衡球的一端靠近酒精灯火焰
加热一段时间后,该平衡球颜色变浅,直至接近无色;停止加热后,平衡球颜色恢复
A.检验溴乙烷消去产物中的乙烯
B.制乙炔并检验乙炔具有还原性
C.比较Al和Cu的金属活动性
D.由FeCl3⋅6H2O制取无水FeCl3固体
序号
实验装置图
试剂Y
电压表
i
H2SO4溶液
指针几乎不偏转
ii
a
指针明显偏转
iii
a+b
指针偏转幅度更大
相关试卷
这是一份北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(含解析),共23页。试卷主要包含了单选题,填空题,解答题等内容,欢迎下载使用。
这是一份北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(含解析),共23页。试卷主要包含了单选题,填空题,解答题等内容,欢迎下载使用。
这是一份北京市丰台区2023-2024学年高三上学期期末化学试题(含答案),共15页。试卷主要包含了01,《本草经集注》中记载,下列化学用语或图示表达正确的是,下列过程与取代反应无关的是,用表示阿伏加德罗常数,已知,下列实验方案能达到相应目的的是等内容,欢迎下载使用。









