


人教版高中化学选择性必修二微专题1基于元素“位”“构”“性”之间的关系的元素推断课件2
展开
这是一份人教版高中化学选择性必修二微专题1基于元素“位”“构”“性”之间的关系的元素推断课件2,共38页。
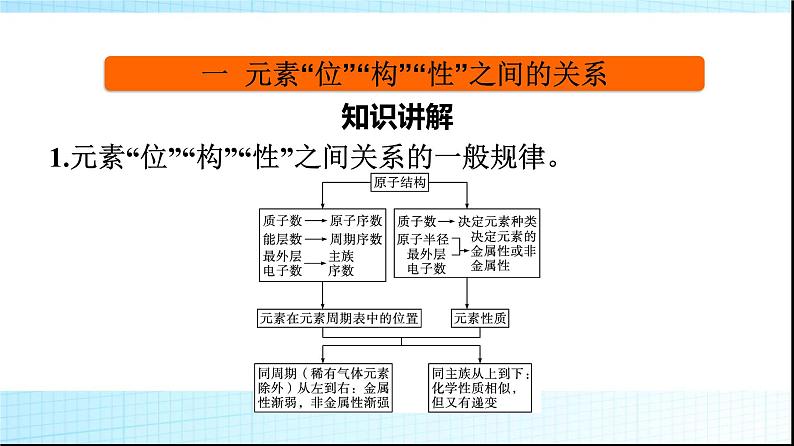
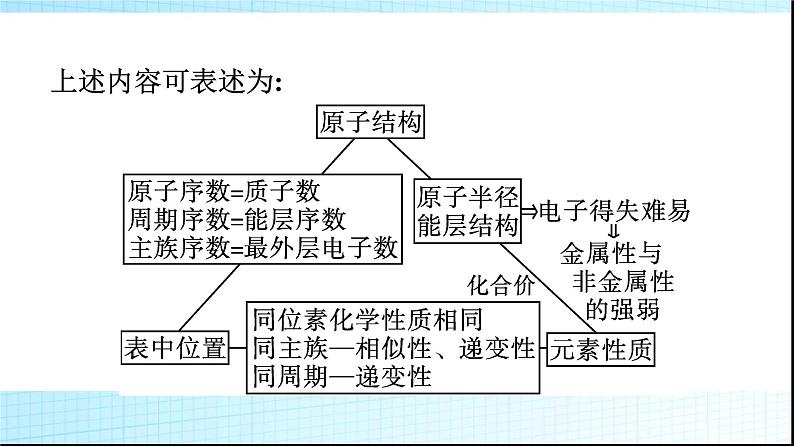
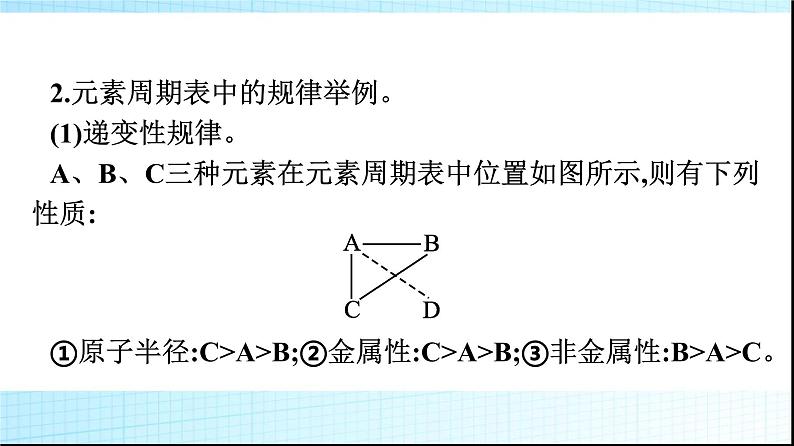
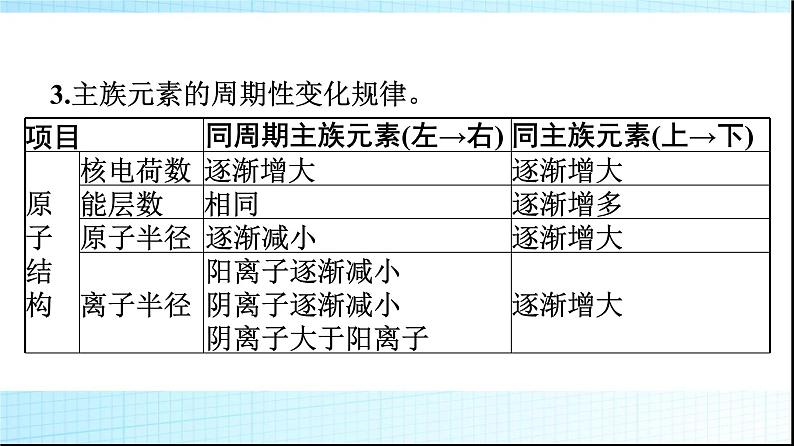
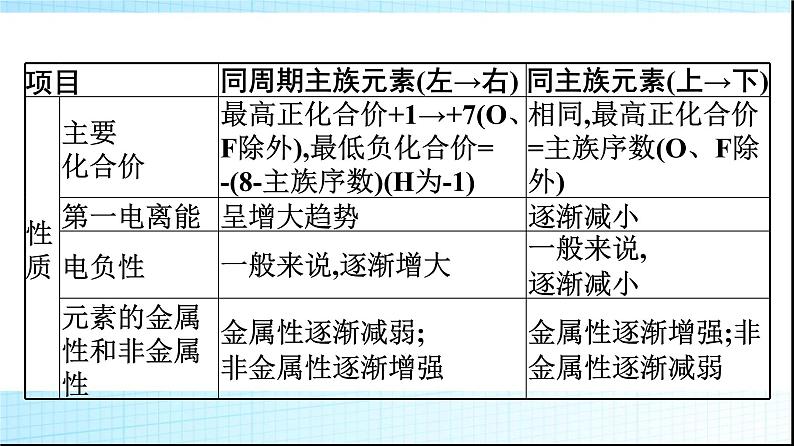
微专题1 基于元素“位”“构”“性”之间的关系的元素推断1.进一步理解巩固元素“位”“构”“性”之间关系的一般规律。2.掌握元素推断的一般规律和方法。3.逐步形成证据推理与模型认知的化学学科核心素养。一 元素“位”“构”“性”之间的关系知识讲解1.元素“位”“构”“性”之间关系的一般规律。上述内容可表述为: 2.元素周期表中的规律举例。(1)递变性规律。A、B、C三种元素在元素周期表中位置如图所示,则有下列性质:①原子半径:C>A>B;②金属性:C>A>B;③非金属性:B>A>C。(2)相似性规律。①同主族元素性质相似,如图中A、C。②处于“对角线”位置的元素某些性质相似,图中A、D位置的元素有些性质相似,如Li和Mg、Be和Al等。③同周期相邻元素的性质差别不大。(3)奇偶规律。元素周期表中,原子序数是奇数的主族元素位于奇数族,主要化合价是奇数;原子序数是偶数的主族元素位于偶数族,主要化合价是偶数。口诀为“奇序奇族奇价,偶序偶族偶价”。3.主族元素的周期性变化规律。 典例剖析【例1】 X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:(1)W元素在元素周期表中的位置是 ,X元素基态原子的轨道表示式是 。 (2)原子半径:X (填“>”或“C N>O>C(3)3d54s1(4)解析:由分析可知,W为C,X为N,Y为O,Z为Mg,M为Cr,N为Fe。(1)Z是Mg,在元素周期表中的位置是第三周期第ⅡA族。(2)同周期主族元素自左而右电负性逐渐增大,W、X、Y三种元素的电负性由大到小的顺序:O>N>C;同周期主族元素随原子序数增大第一电离能呈增大趋势,N元素原子2p轨道为半充满稳定状态,其第一电离能大于同周期相邻元素,故第一电离能由大到小的顺序:N>O>C。(3)M是第24号元素,核外电子排布式为1s22s22p63s23p63d54s1,属于过渡元素,其价层电子排布式为3d54s1。(4)N是Fe,其+3价离子Fe3+的最外层电子排布式是3s23p63d5,排布图为 。







