



所属成套资源:2025年高考化学一轮复习讲练测(新教材新高考)
第01讲 电离平衡(讲义)(含答案) 2025年高考化学一轮复习讲练测(新教材新高考)
展开
这是一份第01讲 电离平衡(讲义)(含答案) 2025年高考化学一轮复习讲练测(新教材新高考),文件包含第01讲电离平衡讲义教师版2025年高考化学一轮复习讲练测新教材新高考docx、第01讲电离平衡讲义学生版2025年高考化学一轮复习讲练测新教材新高考docx等2份试卷配套教学资源,其中试卷共45页, 欢迎下载使用。
02 \l "_Tc2999" 知识导图·思维引航
03 \l "_Tc21713" 考点突破·考法探究
\l "_Tc11550" 考点一 弱电解质的电离平衡
\l "_Tc25045" 知识点1 弱电解质
\l "_Tc16775" 知识点2 弱电解质的电离平衡
\l "_Tc17630" 考向1 强、弱电解质及判断
\l "_Tc16322" 考向2 弱电解质的电离平衡
\l "_Tc15308" 考点二 电离平衡常数
\l "_Tc20279" 知识点1 电离平衡常数
\l "_Tc21835" 知识点2 电离度
\l "_Tc9533" 考向1 电离平衡常数及其应用
\l "_Tc8799" 考向2 电离平衡常数等有关计算
\l "_Tc15308" 考点三 强酸(碱)和弱酸(碱)稀释图像
\l "_Tc20279" 知识点1 等体积、等浓度的盐酸、醋酸
\l "_Tc21835" 知识点2 相同体积、相同pH的盐酸、醋酸
\l "_Tc15681" 知识点3 pH与稀释倍数的线性关系
\l "_Tc9533" 考向1 酸或碱溶液的起始浓度相同
\l "_Tc8799" 考向2 酸或碱溶液的起始pH相同
04 \l "_Tc24080" 真题练习·命题洞见
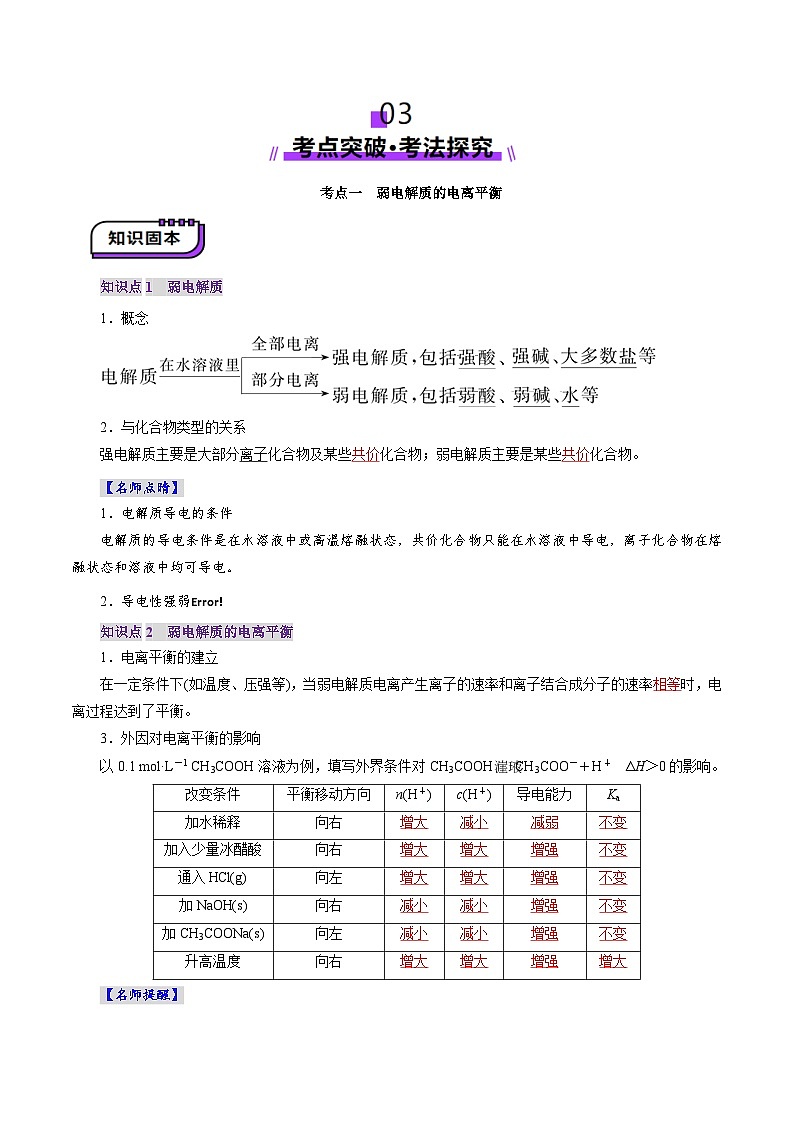
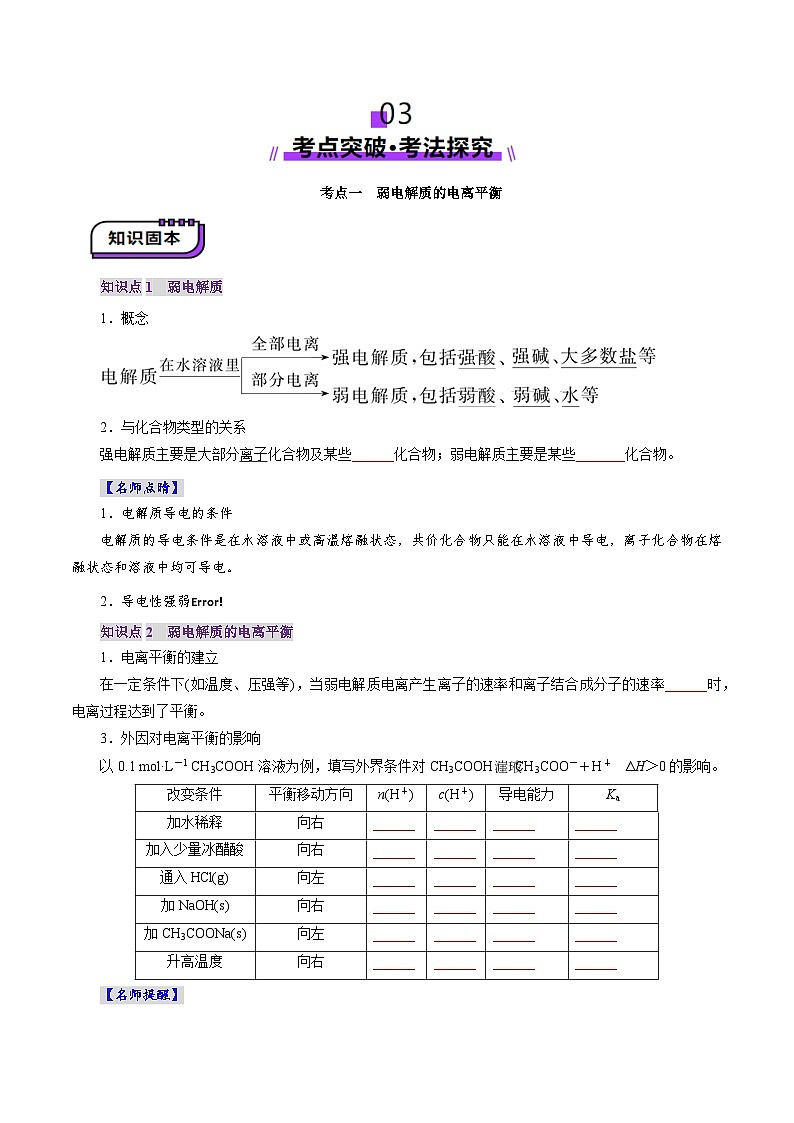
考点一 弱电解质的电离平衡
知识点1 弱电解质
1.概念
2.与化合物类型的关系
强电解质主要是大部分离子化合物及某些______化合物;弱电解质主要是某些_______化合物。
【名师点晴】
1.电解质导电的条件
电解质的导电条件是在水溶液中或高温熔融状态,共价化合物只能在水溶液中导电,离子化合物在熔融状态和溶液中均可导电。
2.导电性强弱eq \b\lc\{\rc\ (\a\vs4\al\c1(离子浓度\b\lc\{\rc\ (\a\vs4\al\c1(溶液浓度,电离程度)),离子所带电荷))
知识点2 弱电解质的电离平衡
1.电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率______时,电离过程达到了平衡。
3.外因对电离平衡的影响
以0.1 ml·L-1 CH3COOH溶液为例,填写外界条件对CH3COOHCH3COO-+H+ ΔH>0的影响。
【名师提醒】
1.浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电离。
2.温度:温度越高,电离程度越大。
3.同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
4.化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
考向1 强、弱电解质及判断
【例1】某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是( )。
A.25 ℃时,若测得0.01 ml·L-1NaR溶液的pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 ml·L-1HR溶液的pH>2且pH Ka(HC)
B.的电离度:a点 < b点
C.当时,升高温度,减小
D.恰好中和均为2、体积均为V0的三种酸溶液,消耗的NaOH溶液一样多
【思维建模】
相同体积、相同pH值的盐酸、醋酸
1.加水稀释相同的倍数,盐酸的pH大。
2.加水稀释到相同的pH,醋酸加入的水多。
【变式训练】(2024·陕西省商洛市高三模拟)常温下,将pH相同、体积均为V0的NaOH溶液和MOH (一元弱碱)溶液分别加水稀释至随的变化如图所示。下列说法正确的是( )
A.曲线Ⅰ表示NaOH溶液
B.未稀释前,c(Na+)= c(M+)>c(MOH)
C.a,c两点溶液的离子总浓度相同
D.加水稀释过程中,逐渐增大
1.(2024·湖南卷,13,3分)常温下Ka(HCOOH)=1.8×10-4,向20mL0.10ml·L-1NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是( )
A. 水的电离程度:M<N
B. M点:cNa++cH+=2cOH-
C. 当V(HCOOH)=10mL时,cOH-=cH++cHCOO-+2cHCOOH
D. N点:cNa+>cHCOO->c(OH―)>c(H+)>cHCOOH
2.(2024·全国新课标卷,7,3分)常温下ClCH2COOH和Cl2CHCOOH的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:]
下列叙述正确的是
A.曲线M表示的变化关系
B.若酸的初始浓度为,则a点对应的溶液中有
C.的电离常数
D.时,
3.(2024·河北卷,11,3分)在水溶液中,CN-可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与CN-形成配离子达平衡时,与的关系如图。
下列说法正确的是( )
A.的X、Y转化为配离子时,两溶液中CN-的平衡浓度:X>Y
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C.由Y和Z分别制备等物质的量的配离子时,消耗CN-的物质的量:Y<Z
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
4.(2023•湖北省选择性考试,14)H2L为某邻苯二酚类配体,其,。常温下构建Fe(Ⅲ)- H2L溶液体系,其中,。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数,已知,。下列说法正确的是( )
A.当pH=1时,体系中c(H2L)>c([FeL]+) >c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+[FeL2]-的平衡常数的lgK约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 ml·L-1
5.(2022•湖北省选择性考试,12)根据酸碱质子理论,给出质子(H+)的物质是酸,给出质子的能力越强,酸性越强。已知:N2H5++NH3=NH4++N2H4,N2H4+CH3COOH=N2H5++CH3COO-,下列酸性强弱顺序正确的是( )
A.N2H5+>N2H4>NH4+B.N2H5+>CH3COOH>NH4+
C.NH3>N2H4>CH3COO-D.CH3COOH>N2H5+>NH4+
3.(2022•全国乙卷)常温下,一元酸的Ka(HA)=1.0×10-3。在某体系中,与A-离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
B.溶液Ⅱ中的HA的电离度为
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
6.(2022·浙江省1月选考,17)已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+1
5.(2022•湖北省选择性考试,15)下图是亚砷酸As(OH)3和酒石酸混合体系中部分物种的图(浓度:总为,总T为)。下列说法错误的是( )
A.As(OH)3的为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.时,As(OH)3的浓度比[As(OH)2T]-的高
D.时,溶液中浓度最高的物种为As(OH)3
7.(2021•山东卷,15)赖氨酸[H3N+(CH2)4CH(NH2)COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+H2R+HRR-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=,下列表述正确的是( )
A.>
B.M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+)
C.O点,pH=
D.P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
考点要求
考题统计
考情分析
强弱电解质比较
2024·湖南卷13题,3分;2024·全国新课标卷7题,3分;2024·河北卷11题,3分;2023湖北卷12题,3分;2022江苏卷12题,3分;2021浙江1月选考17题,2分;2021浙江6月选考19题,2分;
弱电解质的电离是中学化学基本理论中的重要组成部分,也是学习中比较难理解的内容,更是近几年高考命题的必考内容。高考命题热点主要集中于影响弱电解质电离平衡的因素,通过图像分析强、弱电解质,电离常数和电离度,比较微粒浓度大小和pH的计算等,命题有时会与水解相结合增加试题的难度。能用动态平衡的观点分析电离平衡,解决以图像或者文字的形式考查的平衡问题,根据溶液中离子浓度的大小变化,推断反应的原理和变化的强弱,提高证据推理能力。
电离平衡常数应用
2024·江苏卷12题,3分;2023湖北卷14题,3分;2023浙江6月选考15题,3分;2022浙江1月选考17题,2分;2022全国乙卷13题,6分;2022湖北卷15题,3分;2022辽宁卷15题,3分;2021山东卷15题,4分;
复习目标:
1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
改变条件
平衡移动方向
n(H+)
c(H+)
导电能力
Ka
加水稀释
向右
______
______
______
______
加入少量冰醋酸
向右
______
______
______
______
通入HCl(g)
向左
______
______
______
______
加NaOH(s)
向右
______
______
______
______
加CH3COONa(s)
向左
______
______
______
______
升高温度
向右
______
______
______
______
实验方法
结论
(1)测0.01 ml·L-1 HA溶液的pH
pH=2,HA为强酸;pH>2,HA为弱酸
(2)测NaA溶液的pH
pH=7,HA为强酸;pH>7,HA为弱酸
(3)相同条件下,测相同浓度的HA和HCl溶液的导电性
导电性相同,HA为强酸;导电性弱于盐酸,HA为弱酸
(4)往同浓度的HA和HCl溶液中投入大小相同的Zn粒或CaCO3固体
开始反应速率相同,HA为强酸;开始反应速率比盐酸慢,HA为弱酸
(5)测相同pH的HA与HCl稀释相同倍数前后的pH变化
pH变化倍数相同,HA为强酸;pH变化倍数小于盐酸,HA为弱酸
判断弱酸(或弱碱)的相对强弱
电离常数越大,酸性(或碱性)越强。如:常温下,CH3COOH的Ka=1.8×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。
则酸性:CH3COOH>H2CO3>HCOeq \\al(-,3)
判断盐溶液的酸性(或碱性)强弱
电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。如:利用上面电离常数的数值可知等浓度的CH3COONa、NaHCO3、Na2CO3溶液的pH由大到小的顺序为Na2CO3>NaHCO3>CH3COONa
判断复分解反应能否发生
一般符合“强酸制弱酸”规律。如:利用上面中电离常数的数值可知,向Na2CO3溶液中加入足量CH3COOH的离子方程式为COeq \\al(2-,3)+2CH3COOH===2CH3COO-+H2O+CO2↑
判断微粒浓度比值的变化
弱电解质加水稀释时,能促进弱电解质的电离,溶液中离子和分子的浓度会发生相应的变化,但电离常数不变,题目中经常利用电离常数来判断溶液中微粒浓度比值的变化情况。如把0.1 ml·L-1 CH3COOH溶液加水稀释,eq \f(c(CH3COO-),c(CH3COOH))=eq \f(c(CH3COO-)·c(H+),c(CH3COOH)·c(H+))=eq \f(Ka,c(H+))稀释时,c(H+)减小,Ka值不变,则eq \f(c(CH3COO-),c(CH3COOH))变大
分子式
HClO4
H2SO4
HCl
HNO3
4.87
7.24(一级)
8.9
9.4
分析:加水稀释相同的倍数,醋酸的pH______
分析:加水稀释到相同的pH,______加入的水多
分析:加水稀释相同的倍数,盐酸的pH______
分析:加水稀释到相同的pH,______加入的水多
分析:(1)HY为______酸,HX为______酸
(2)a、b两点的溶液中:c(X-)______c(Y-)
(3)水的电离程度:______
分析:(1)MOH为______碱,ROH为______碱
(2)起始时,c(ROH) ______c(MOH)
(3)水的电离程度:______
比较项目
酸
c(H+)
pH
中和碱的能力
与活泼金属反应产生H2的量
开始与金属反应的速率
盐酸
大
小
相同
相同
大
醋酸溶液
小
大
小
比较
项目
酸
c(H+)
c(酸)
中和碱的能力
与足量活泼金属反应产生H2的量
开始与金属反应的速率
盐酸
相同
小
小
少
相同
醋酸溶液
大
大
多
相关试卷
这是一份第01讲 化学反应的热效应(讲义)(含答案) 2025年高考化学一轮复习讲练测(新教材新高考),文件包含第01讲化学反应的热效应讲义教师版2025年高考化学一轮复习讲练测新教材新高考docx、第01讲化学反应的热效应讲义学生版2025年高考化学一轮复习讲练测新教材新高考docx等2份试卷配套教学资源,其中试卷共53页, 欢迎下载使用。
这是一份新高考化学一轮复习讲练测第21讲 电离平衡(讲)(解析版),文件包含新高考化学一轮复习讲练测第21讲电离平衡讲原卷版docx、新高考化学一轮复习讲练测第21讲电离平衡讲解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份新高考化学一轮复习讲练测第21讲 电离平衡(练)(解析版),文件包含新高考化学一轮复习讲练测第21讲电离平衡练原卷版docx、新高考化学一轮复习讲练测第21讲电离平衡练解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。








