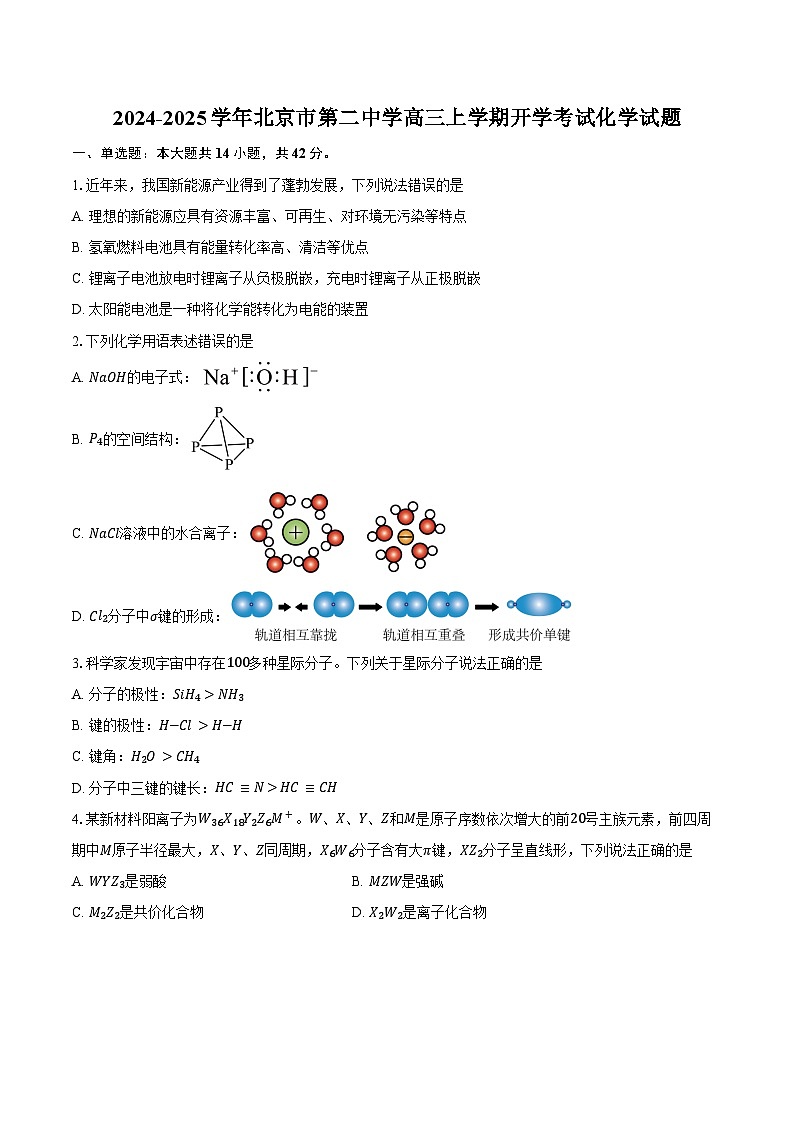

2024-2025学年北京市第二中学高三上学期开学考试化学试题(含答案)
展开1.近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是
A. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B. 氢氧燃料电池具有能量转化率高、清洁等优点
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D. 太阳能电池是一种将化学能转化为电能的装置
2.下列化学用语表述错误的是
A. NaOH的电子式:
B. P4的空间结构:
C. NaCl溶液中的水合离子:
D. Cl2分子中σ键的形成:
3.科学家发现宇宙中存在100多种星际分子。下列关于星际分子说法正确的是
A. 分子的极性:SiH4>NH3
B. 键的极性:H−Cl>H−H
C. 键角:H2O>CH4
D. 分子中三键的键长:HC≡N>HC≡CH
4.某新材料阳离子为W36X18Y2Z6M+。W、X、Y、Z和M是原子序数依次增大的前20号主族元素,前四周期中M原子半径最大,X、Y、Z同周期,X6W6分子含有大π键,XZ2分子呈直线形,下列说法正确的是
A. WYZ3是弱酸B. MZW是强碱
C. M2Z2是共价化合物D. X2W2是离子化合物
5.蛇孢菌素(X)是一种具有抗病活性的天然植物毒素。下列关于X说法正确的是
A. 含有4种官能团,8个手性碳原子
B. 1ml X最多可以和3mlH2发生加成反应
C. 只有1种消去产物
D. 可与新制的CuOH2反应生成砖红色沉淀
6.由下列实验事实得出的结论正确的是
A. AB. BC. CD. D
7.我国学者把游离态氮固定在碳上(示踪反应如下),制得的N=C=N2−离子可用于合成核酸的结构单元。阿伏加德罗常数的值为NA,下列说法正确的是 15N2+C石墨+2LiH20atm,550,5ℎ Li2 15NC15N+H2
A. 22.4L15N2含有的中子数为16NA B. 12gC石墨中sp2杂化轨道含有的电子数为6NA
C. 1mlN=C=N2−中含有的π键数为4NA D. 生成1mlH2时,总反应转移的电子数为6NA
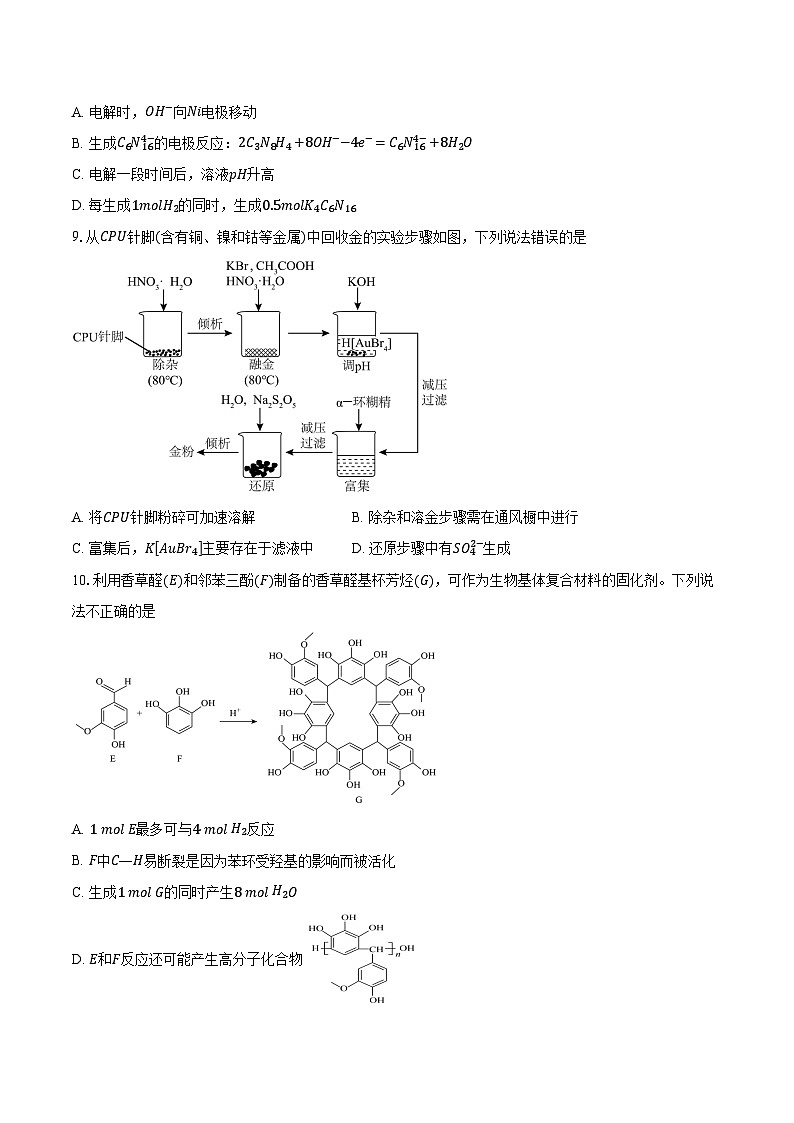
8.在KOH水溶液中,电化学方法合成高能物质K4C6N16时,伴随少量O2生成,电解原理如图所示,下列说法正确的是
A. 电解时,OH−向Ni电极移动
B. 生成C6N164−的电极反应:2C3N8H4+8OH−−4e−=C6N164−+8H2O
C. 电解一段时间后,溶液pH升高
D. 每生成1mlH2的同时,生成0.5mlK4C6N16
9.从CPU针脚(含有铜、镍和钴等金属)中回收金的实验步骤如图,下列说法错误的是
A. 将CPU针脚粉碎可加速溶解B. 除杂和溶金步骤需在通风橱中进行
C. 富集后,KAuBr4主要存在于滤液中D. 还原步骤中有SO42−生成
10.利用香草醛(E)和邻苯三酚(F)制备的香草醛基杯芳烃(G),可作为生物基体复合材料的固化剂。下列说法不正确的是
A. 1 ml E最多可与4 ml H2反应
B. F中C—H易断裂是因为苯环受羟基的影响而被活化
C. 生成1 ml G的同时产生8 ml H2O
D. E和F反应还可能产生高分子化合物
11.温度T下,向1L真空刚性容器中加入1mlCH32CHOH,反应达到平衡时,cY=0.4ml/L,
(CH3)2CHOH(g)&⇀↽&(CH3)2CO(g)&+&H2(g)X&&Y&&Z
下列说法正确的是
A. 再充入1ml X和1ml Y,此时v正
C. 再充入1mlN2,平衡向右移动
D. 若温度升高,X的转化率增加,则上述反应ΔH<0
12.常温下KaHCOOH=1.8×10−4,向20mL0.10ml⋅L−1NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是
A. 水的电离程度:M
C. 当VHCOOH=10mL时,cOH−=cH++2cHCOOH+cHCOO−
D. N点:cNa+>cHCOO−>cOH−>cH+>cHCOOH
13.研究CNH36SO4溶液的制备、性质和应用。
①向CSO4溶液中逐滴加入氨水,得到CNH36SO4溶液。
②分别将等浓度的CSO4溶液、CNH36SO4溶液放置于空气中,一段时间后,加入浓盐酸,前者无明显现象,后者产生使淀粉KI溶液变蓝的气体。
③CNH36SO4溶液可处理含NO的废气,反应过程如下。
下列说法正确的是
A. ①中,为避免CSO4溶液与氨水生成C(OH)2沉淀,可先加入适量的NH42SO4溶液
B. ②中,CSO4溶液中的C2+浓度比CNH36SO4溶液中的高,CSO4的还原性比CNH36SO4的强
C. ③中,CNH362+转化为NH35C−O−O−CNH354+,C元素的化合价不变
D. ③中,降低pH可显著提高NO的脱除率
14.向丙烷脱氢制丙烯的反应体系中加入CO2,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的CO2−C3H8、N2−C3H8混合气体以相同流速持续通过同种催化剂表面,C3H8转化率和C3H6选择性随通入气体时间的变化如图:
已知:
I.反应①C3H8(g)⇀↽C3H6(g)+H2(g)ΔH1=+124kJ⋅ml−1
反应②H2(g)+CO2(g)⇀↽H2O(g)+CO(g)ΔH2=+41.2kJ⋅ml−1
Ⅱ.反应体系中存在C3H8的裂解和生成积炭等副反应。
Ⅲ.C3H6的选择性=n生成C3H6所用的C3H8n反应消耗的C3H8×100%
下列说法正确的是
A. C3H8(g)+CO2(g)⇀↽C3H6(g)+H2O(g)+CO(g)ΔH=+82.8kJ⋅ml−1
B. 30min内,两体系中C3H6选择性相同,生成C3H6的速率也相同
C. iii中的C3H8转化率高于iv中的,是因为反应②使反应①的平衡正向移动
D. iii、iv对比,150min后iv中C3H8转化率为0,可能是因为积炭使催化剂失效
二、填空题:本大题共1小题,共8分。
15.很多物质具有杀菌消毒的作用,不同杀菌剂的作用原理、合成方法也有区别。
Ⅰ.氯气是合成漂白液、漂白粉的重要原料。
(1)写出氯碱工业生产Cl2的离子方程式__________。由氯气生产漂白粉的化学方程式为__________。
Ⅱ.双氧水(过氧化氢的水溶液)被称为“绿色氧化剂”,一定浓度下也有杀菌消毒的作用。
(2)一种火箭推进器中含有液态肼(N2H4)和液态过氧化氢。已知0.4ml液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.6kJ的热量。该反应的热化学方程式为__________。
(3)双氧水能将碱性废水中的CN−转化成碳酸盐和一种对环境无污染的气体。CN−的电子式为___________,该反应的离子方程式为__________。
Ⅲ.在一些特定环境中也可用作杀菌剂。
(4)一种利用废弃铜锌合金制取CuCl的流程如下图所示:
①与Al类似,碱溶Zn时还会产生H2。写出碱溶时Zn反应的化学方程式__________。
②写出沉铜时反应的离子方程式__________。
三、简答题:本大题共4小题,共32分。
16.稀土是国家的战略资源之一、以下是一种以独居石(主要成分为CePO4,含有Tℎ3PO44、U3O8和少量镭(Ra)杂质)为原料制备CeCl3⋅nH2O的工艺流程图。
已知:i.KspTℎOH4=4.0×10−45,KspCeOH3=1.6×10−20,KspCeOH4=2.0×10−48
ii.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是__________(填标号)。
a.降低压强,分解速率增大 b.降低温度,分解速率降低
c.反应时间越长,分解速率越大 d.提高搅拌速度,分解速率降低
(2)Na2U2O7中铀元素的化合价为__________,热分解阶段U3O8生成Na2U2O7的化学反应方程式为__________。
(3)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解CeOH4的离子方程式为__________。
②当溶液pH=4.5时,cTℎ4+=__________ml/L,此时完全转化为氢氧化钍沉淀。
(4)以BaSO4为载体形成共沉淀,目的是去除杂质__________。
17.硼的化合物有重要应用。
(1)写出基态B的电子排布式__________。
(2)硼酸(H3BO3)的结构如下图所示。在水溶液中硼酸的电离方程式:H3BO3+H2O⇀↽BOH4−+H+,25℃时,Ka=10−9.23。
①将“−OH”视为一个原子,硼酸分子的空间结构名称为__________。
②硼酸能够结合OH−形成BOH4−的原因是__________。
③电离过程中,B原子的杂化轨道类型变为__________。
④由于硼酸的酸性极弱,无法直接用NaOH标准液滴定其浓度。甘油可以与BOH4−形成稳定的硼酸甘油酯离子A−,从而促进硼酸的电离:H3BO3+2甘油=A−+H++3H2O。A−含两个六元环,它们共用一个顶点B原子,试写出A−的结构简式__________。
⑤常温常压下硼酸H3BO3晶体结构为层状,其二维平面结构如下图所示。
i.1mlH3BO3晶体中含有__________ml氢键。
ii.请解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因__________。
18.抗溃疡药奥美拉唑合成路线如下.
已知:的某些性质和相似,都能与R−NH2发生加成.
(1)写出A的结构简式_____________。
(2)B→C的反应试剂及条件是_____________;C中所含官能团名称为:硝基、_____________。.
(3)C→D的化学方程式是:_____________。
(4)D→E过程中,氧化剂与还原剂的物质的量之比为_____________。
(5)一定条件下,E与过量反应形成高分子,每形成1ml该高分子的同时,还会产生某种小分子产物,其物质的量为_____________ml.E的比值越大,则高分子的分子量越_____________.(填“大”或“小”)。
(6)Ⅰ的结构简式是_____________。
(7)下列有关J的说法正确的是_____________(填序号)。
a.分子式是C9H12NO2 b.能使酸性KMnO4溶液褪色
c.核磁共振氢谱有6组峰 d.具有碱性 e.能与Na2CO3溶液反应
(8)E经三步反应形成F,请写出中间体1和中间体2的结构简式_____________、_____________。
19.某化学小组探究硫酸铁铵NH4FeSO42与Na2CO3、Na2SO3的反应。
已知:Fe3++HSO3−⇀↽FeHSO32+(棕红)。
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为__________。
②由实验Ⅰ可得出与OH−结合的能力:NH4+__________Fe3+(填“>”“<”或“=”)。
(2)资料显示,Fe3+可以氧化SO32−。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中Fe3+与SO32−生成Fe2+的离子方程式为__________。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了Fe3+的氧化性或SO32−的还原性,并实施实验。
①a、b分别是__________。
②结合电极反应解释步骤3中电压表示数减小的原因__________。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到Fe2+。
结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因__________。
综合以上实验,盐溶液反应多样性与微观粒子种类、试剂的相对用量、pH等有关。
参考答案
1.D
2.C
3.B
4.B
5.D
6.B
7.D
8.B
9.C
10.C
11.A
12.D
13.A
14.D
15.(1) 2Cl−+2H2O通电 Cl2↑+H2↑+2OH− 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=−641.38kJ⋅ml−1
(3) 5H2O2+CN−+2OH−=2CO 32−+N2+6H2O
(4) Zn+2NaOH=Na2ZnO2+H2↑ 2Cu2++SO2+2Cl−+2H2O=2CuCl↓+SO42−+4H+
16.(1)b
(2) +6 2U3O8+O2+6NaOH=3Na2U2O7+3H2O
(3) 2Ce(OH)4+8H++2Cl−=2Ce3++Cl2↑+8H2O 4×10−7
(4)RaSO4
17.(1)1s22s22p1
(2) 平面三角形 B原子提供空轨道,OH−(或H2O)提供孤电子对,二者形成配位键 sp3 3 加热破坏了硼酸分子之间的氢键,使更多硼酸分子与水分子之间形成氢键,溶解度增大
18.(1)
(2) 浓硝酸、浓硫酸,加热 醚键、酰胺基
(3)
(4)1:3
(5) n+2 小
(6)
(7)bcd
(8)
19.(1)2Fe3++3CO32−+3H2O=2FeOH3↓+3CO2↑ <
(2) H2O+2Fe3++SO32−=2Fe2++SO42−+2H+ 反应Fe3++HSO3−⇀↽FeHSO32+的速率大于Fe3+与+4价硫发生氧化还原反应的速率;实验Ⅱ中Na2SO3过量,cFe3+较低:实验 Ⅳ中Fe3+过量,cFe3+较高,发生氧化还原反应的速率比实验 Ⅱ快,并不断促进Fe3++HSO3−⇀↽FeHSO32+逆向移动
(3) 石墨0.3ml⋅L−1Na2SO3溶液 SO32−−2e−+H2O=SO42−+2H+,cH+增大,SO32−还原性减弱,电压表读数减小 平衡HSO3−+H+⇀↽H2SO3正移,c(HSO3−)降低,平衡Fe3++HSO3−⇀↽FeHSO32+逆移,c(Fe3+)增大,Fe3+与+4价硫化合物的氧化还原反应速率加快
实验事实
结论
A
铝和氧化铁反应需要引燃
该反应ΔH>0
B
KI溶液加热浓缩后加入淀粉溶液,溶液变蓝
氧化性:O2>I2
C
久置的NaOH溶液试剂瓶口出现白色固体
NaOH结晶析出
D
久置的FeCl2溶液中出现红褐色沉淀
KspFeOH3>KspFeOH2
实验
操作
现象
Ⅰ
向2ml0.2ml⋅L−1NH4FeSO42溶液(pH=2.03)中逐滴加入0.3ml⋅L−1Na2CO3溶液
迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝
Ⅱ
向2ml0.2ml⋅L−1NH4FeSO42溶液(pH=2.03)中逐滴加入0.3ml⋅L−1Na2SO3溶液
溶液立即变棕红色(无丁达尔现象),继续滴加Na2SO3溶液至过量,溶液依然为棕红色,放置两天无明显变化
实验
操作
现象
Ⅲ
向2ml0.1ml⋅L−1Fe2SO43溶液(pH=1.78)中加入⋅L−1Na2SO3溶液
溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到Fe2+
Ⅳ
向2ml0.2ml⋅L−1NH4FeSO42溶液(pH=2.03)中加入⋅L−1Na2SO3溶液
溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到Fe2+
实验
实验装置
实验步骤及现象
Ⅴ
1.按左图搭好装置,接通电路,电压表读数为0.6V。 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变。 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。
2024-2025学年北京市铁路第二中学高三上学期开学测试化学试题(含答案): 这是一份2024-2025学年北京市铁路第二中学高三上学期开学测试化学试题(含答案),共11页。试卷主要包含了单选题,实验题,简答题等内容,欢迎下载使用。
2024-2025学年北京市第五中学高三上学期开学考试化学试题(含答案): 这是一份2024-2025学年北京市第五中学高三上学期开学考试化学试题(含答案),共12页。试卷主要包含了选择题题,综合题等内容,欢迎下载使用。
2024-2025学年北京市八一学校高三上学期开学摸底考试化学试题(含答案): 这是一份2024-2025学年北京市八一学校高三上学期开学摸底考试化学试题(含答案),共11页。试卷主要包含了单选题,填空题,简答题等内容,欢迎下载使用。












