
还剩31页未读,
继续阅读
所属成套资源:人教版九年级化学上册尖子生必备考点精讲精练(原卷版+解析)
成套系列资料,整套一键下载
初中化学人教版(2024)九年级上册课题4 化学式与化合价课堂检测
展开这是一份初中化学人教版(2024)九年级上册课题4 化学式与化合价课堂检测,共34页。
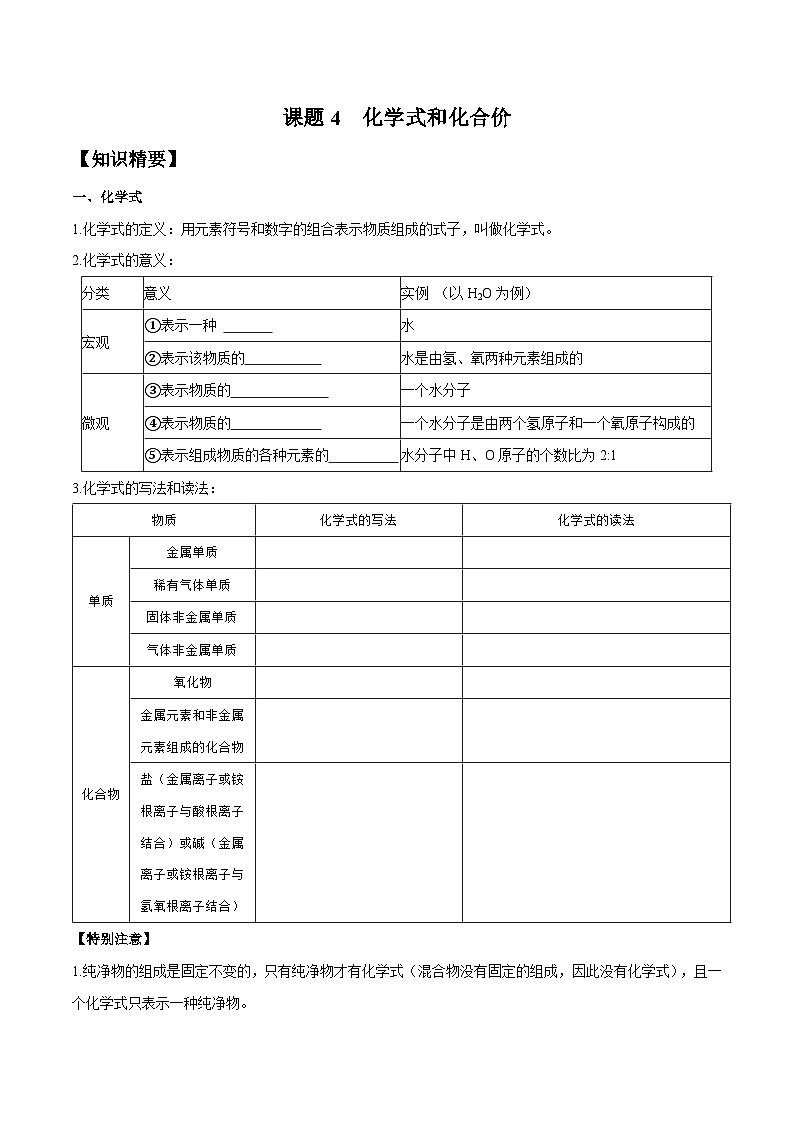
一、化学式
1.化学式的定义:用元素符号和数字的组合表示物质组成的式子,叫做化学式。
2.化学式的意义:
3.化学式的写法和读法:
【特别注意】
1.纯净物的组成是固定不变的,只有纯净物才有化学式(混合物没有固定的组成,因此没有化学式),且一个化学式只表示一种纯净物。
2.化学式右下角的数字为整数,原子个数为“1”时一般不写出。化学式中数字的含义(以水为例):
二、化合价
1.概念: 。
2.常见元素化合价
3.常见根(原子团)
补充:根——有些物质中的一些 的原子团,常作为一个 参加反应,这样的原子团叫根。
4.元素化合价与原子最外层电子数的关系: 。
5.化合价的表示方法:化合物中各元素的化合价通常在化学式中 。如 。
6.化合价规律
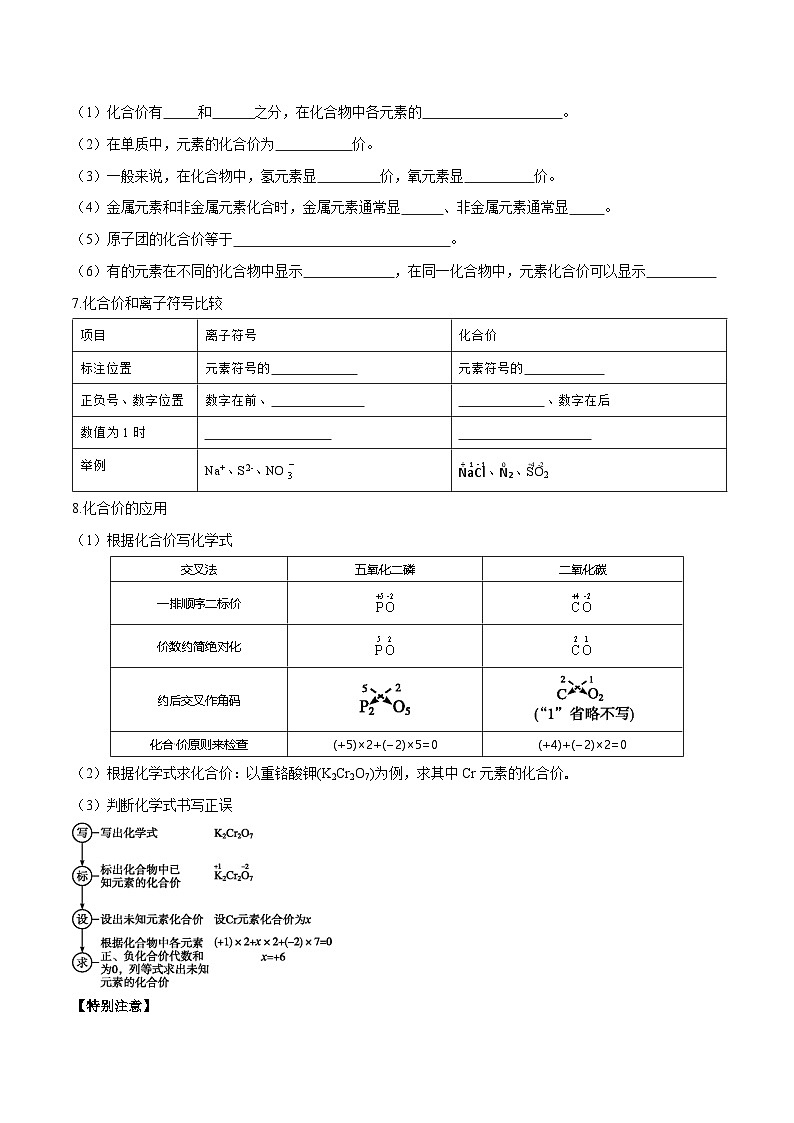
(1)化合价有 和 之分,在化合物中各元素的 。
(2)在单质中,元素的化合价为 价。
(3)一般来说,在化合物中,氢元素显 价,氧元素显 价。
(4)金属元素和非金属元素化合时,金属元素通常显 、非金属元素通常显 。
(5)原子团的化合价等于 。
(6)有的元素在不同的化合物中显示 ,在同一化合物中,元素化合价可以显示
7.化合价和离子符号比较
8.化合价的应用
(1)根据化合价写化学式
根据化学式求化合价:以重铬酸钾(K2Cr2O7)为例,求其中Cr元素的化合价。
判断化学式书写正误
【特别注意】
1.化合价口诀:
一价氢氯钾钠银,二价氧钙钡镁锌,
三铝四硅五氮磷,二、三铁,二、四碳,二四六硫都齐全,
铜汞二价最常见,莫忘单质零价现。
三、化学式的计算
1.相对分子质量:化学式中各原子的相对原子质量的总和就是相对分子质量,用符号Mr表示。
2.化合物中的原子个数之比:在化学式中,元素符号右下角的数字就是表示该元素原子的个数,因此这些数字的比值就是化合物中的原子个数之比。
3.物质组成中各元素的质量比:即各元素的相对原子质量总和的比。
4.化合物中某元素的质量分数==
该元素的相对原子质量×该元素的原子个数化合物的相对分子质量×100%
5.一定质量的物质中某元素的质量==物质的质量×该元素在物质中的质量分数。
【拓展】
1.基本计算类型(以Fe2O3为例):
2.有关混合物的计算
①纯净物的质量:
②混合物中某元素的质量分数:
③混合物中某物质的质量分数:
【题典精讲】
【例题1】下列关于化合价的叙述:
①化合价是元素的一种性质,因此称为元素的化合价,而不应称为原子的化合价。
②化合物中化合价有正价和负价,其数值由元素的一个原子得失电子数目或形成共用电子对的数目决定的。
③一种元素只有一种化合价。
④在化合物中非金属元素的化合价为负值。其中正确的是( )
A.①② B.①③ C.②③④ D.①
【例题2】根据下列四种粒子的结构示意图,所获取的信息不正确的是
A.他们表示四种元素的原子 B.①③④表示的是阳离子
C.④表示的元素是非金属元素 D.②表示的元素在化合物中通常显+2价
【例题3】对比、分析得出结论是化学学习中重要的科学方法和手段。如对下列三组内的符号或式子分别进行对比分析,你会发现它们有许多相似之处。请你任选两组,写出组内符号或式子的两点相似之处。
【例题4】下列有关化合价的说法中,正确的是( )
A.在NaCl和HClO里,氯元素均为﹣1价 B.在H2中,氢元素显+1价
C.一种元素在同一种化合物里,可能显不同的化合价 D.非金属元素在化合物里,一定显负价
【例题5】化学就在我们身边,它与我们的生活息息相关。
现有C、H、O、Cl、Na、Ca五种元素,请选择其中的元素写出符合下列要求的物质各一种(用化学式表示):
①供给动植物呼吸的物质 ; ②胃酸的成分 ;
③用于炼铁的气体 ; ④用于改良酸性土壤的碱 。
【例题6】请根据下列提示,猜猜A、B、C、D各是何种物质,写出它们的化学式。
A.金属 液体 温度计 B.厨房 防腐剂 调味品的主要成分
C.气体 密度很小 电解水 D.氧化物 黑色 磁铁矿
A. B. C. D.
【例题7】下列化学用语书写错误的是( )
A.两个氮原子:2NB.两个氨分子:2NH3
C.氧化铝的化学式:Al2O3D.一个钙离子:Ca+2
【例题8】下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
A.OB.N2C.CuD.CO2
【例题9】下列化学符号中“2”的含义表述正确的是( )
A.2H —2个氢元素B.O2 —2个氧原子
C.2Cl-—2个氯离子 D.CO2 —二氧化碳中含有2个氧原子
【例题10】用黑钨矿[主要含钨酸亚铁(FeWO4)]可制得金属钨。钨酸亚铁中钨元素(W)的化合价为( )
A.﹣2 B.+2 C.+4 D.+6
【例题10】某元素M的相对原子质量为32,M的氧化物中氧元素的质量分数为60%,则M在此氧化物中的化合价为( )
A.+6B.+4C.+2D.+1
【例题11】油画上使用的白色颜料经一段时间后会变为黑色的PbS(硫化铅),使颜料恢复白色的方法是蘸涂双氧水,发生反应的化学方程式为:PbS+4H2O2=PbSO4+4H2O,此反应中Pb元素、H元素的化合价不变,O元素的化合价变化为:-l→-2。则S元素的化合价变化为( )
A.+2→+4B.+2→+6C.-2→+4D.-2→+6
【例题12】.小华初步构建了“氯及其化合物的价﹣类关系图”请根据图,回答下列问题。
(1)依次写出 A、B 两点所表示的物质的化学式,并标出各元素的化合价: 、 。
(2)C常用于实验室制取氧气,同时生成 D,写出该反应的化学方程式 ;D 是由 和 构成的(用化学符号表示)
【例题13】科学家研究发现,以Y2O3,BaCO3,和CuO为原料经研磨烧结后可以合成一种高温超导物质,其化学式可写成Y2Ba4CuO13,且在合成过程中各元素的化合价均无变化,则( )
A.此合成过程的反应类型是化合反应,Y的化合价是+2价
B.此合成过程的反应类型是化合反应,Y的化合价是+3价
C.此合成过程的反应类型不是化合反应,Y的化合价是+2价
D.此合成过程的反应类型不是化合反应,Y的化合价是+3价
【例题14】世卫组织(WHO)发表声明称,地塞米松(C22H29FO3)可挽救新冠肺炎重症患者生命。下列说法正确的是( )
A.地塞米松属于氧化物 B.地塞米松由4种元素组成
C.地塞米松中氢元素的质量分数最大 D.地塞米松中碳元素与氧元素质量比是22:5
【例题15】.对下面符号或示意图的理解,正确的是( )
A.Fe2+、Fe3+都属于铁元素,是同一种离子
B.NO2和N2O4中氮元素化合价都是+4价,是同一化合物
C.NH4NO3中氮元素有两种不同的化合价,分别是+3、+5
D.和两种粒子的电子排布情况相同,属于同一元素
【例题16】已知元素M的化合价为+3价,其氧化物的相对分子质量为160,则M的相对原子质量是
【例题17】某正三价的金属元素A,它的氧化物中含氧元素的质量分数是30%,则A的相对原子质量是( )
A.56 B.27 C.32 D.16
【例题18】已知Fe2O3和Fe3O4中氧元素质量相等,则其中铁元素质量比为
【例题19】某物质含有A、B两种元素,已知A、B两种元素原子的相对原子质量之比为7:2经测定该物质A、B两元素的质量比为7:3,则该位置的化学式为( )
A.A2B3 B.AB2 C.A2B D.A3B2
【例题20】某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制钢。首先通过高炉炼铁得到生铁,其过程中损失 20%铁元素,然后将生铁经过炼钢炉中,通入纯氧,其过程损失 2%铁元素,最终得到含铁 98%的钢 100t,则理论上需要含杂质 20%的赤铁矿石的质量是( )
A. 223t B. 143t C.179t D.120t
【考点训练】
1.在太空舱里常用NiFe2O4作催化剂将宇航员呼出的CO2转化为O2。已知NiFe2O4中Fe元素的化合价为+3价,则Ni元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
2.下列化学用语与所表达的意义对应正确的是( )
A.Fe2+——铁离子 B. ——铝原子
C.2He——2个氦元素 D.2NO2——2个二氧化氮分子
3.下列符号好的“2”与O2中的“2”所表示的含义相似的是( )
A.H2O B.2Zn C.2CO D.SO42-
4.意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如图所示。下列有关N4的说法正确的是( )
A. N4约占空气体积的78%
B. N4是一种单质
C. N4属于一种新型的化合物
D. 由于N4与N2的组成元素相同,所以他们的性质相同
5.绿原酸(C16H18O9)是中药金银花的成分之一,可抗菌抗病毒,下列关于该物质说法正确的是( )
A.相对分子质量为354g
B.由三种元素组成
C.碳、氢元素的质量比是8:9
D.绿原酸分子由16个碳原子、18个氢原子、9个氧原子组成
6.决定元素化合价的因素不可能是( )
A.得到电子的数目 B.失去电子的数目
C.化学计量数 D.形成共用电子对的数目
7. 现有H+1、Na+1、S+6、O−2四种元素,如果用指定化合价将它们按两种或三种元素结合成化合物,则最多可形成化合物的种数是( )
A.4种 B.5种 C.6种 D.7种
8.用数轴表示某些化学知识直观、简明、易记,下列数轴表示错误的是( )
A.地壳中元素含量由高到低
B.不同种原子的原子序数依次递增
C.空气中气体体积分数由大到小
D.含氮物质中氮元素的化合价由低到高
9. 已知某物质的化学式为RNO3,相对分子质量是85,则R元素的相对原子质量是( )
A.55B.55 gC.23D.23 g
10. 下列物质中均含有氯元素,它们按下列顺序排列①AgCl②Cl2③X④NaClO3⑤KClO4根据这种排布规律推测,X可能是( )
A.NaCl B.KClO3 C.HClO2 D.Cl2O5
11. 异烟肼(化学式:C6H7N3O;相对分子质量:137)是治疗肺结核药物的有效成分。下列说法正确的是( )
A.异烟肼属于氧化物 B.异烟肼分子中H、O原子个数比为7∶1
C.异烟肼中C、H两种元素的质量比为36∶7 D.异烟肼中N元素质量分数的计算式为eq \f(14,137)×100%
12. 含氧元素质量相同的SO2和SO3,具有相同的( )
A.硫元素质量 B.质量 C.氧原子个数 D.分子个数
13. 单晶硅和单质铁都是由原子构成的单质,试求质量比为2:1的单晶硅和单质铁中,所含有的原子个数之比为( )
A.4:1 B.2:1 C.1:1 D.1:2
14.某家庭式空气净化器在工作时会释放臭氧(O3),利用其强氧化性杀菌消毒并转化为无污染的氧气(O2)。下列分析合理的是( )
A.O3的强氧化性是由O3分子结构决定的
B.相同质量的O3与O2所含的分子个数相同
C.相同分子个数的O3和O2中,所含氧原子的个数相同
D.O3和O2都由氧元素组成,他们的化学性质完全相同
【培优训练】
1.过氧乙酸(C2H4O3)是常见的消毒剂。下列关于过氧乙酸的说法正确的是( )
A.分子中含O3分子 B.氢、氧原子个数比为4:3
C.分子中有9种元素 D.碳的质量分数为24%
2.测定铁与氧气反应的产物时,测得5.6铁在足量的氧气中燃烧得到7.8g固体,不考虑其他误差因素,则该固体产物的组成可能是( )
A.Fe3O4和Fe B. Fe3O4和FeO C. Fe3O4和Fe2O3 D. Fe3O4、FeO和Fe
3.意大利化学家阿伏加德罗在化学上的重大贡献是建立分子学说,他提出:同温同压下,相同体积的任何气体含有相同数目的分子。现有两个密闭容器,分别装有等质量的甲、乙两种气体,若两容器内气体温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是( )
A.气体体积:甲>乙 B.原子数目:甲<乙
C.分子数目:甲<乙 D.相对分子质量:甲>乙
4.类推的思维方法在化学学习中应用广泛,例如:水(H2O)→过氧化氢(H2O2);氧化钠(Na2O)→过氧化钠(Na2O2)。由此可推断,过氧化钡的化学式为( )
A.Ba2OB.Ba3OC.Ba2O2D.BaO2
4. 经过研究发现,对任何气体而言,6.02×1023个分子具有下列定量关系:
①其质量在数值上等于该分子的相对分子质量,单位为克;
②在压强为101kPa和温度为0℃时其体积为22.4升.
据此可知,32克二氧化硫的分子数为 个,含有的氧原子数为 个,在压强为101kPa和温度为0℃时其体积为 升.
5. 铁具有可变的化合价,将14.4g草酸亚铁(FeC2O4)在隔绝空气的条件下加热分解,最终可得到7.2g铁的氧化物,则该铁的氧化物是( )
A.Fe2O3 B.FeO C.Fe3O4 D.无法确定
6. 已知 (NH4)2SO4和(NH4)2HPO4组成的混合物中氮元素质量分数为21.2%,则氧元素的质量分数为( )
A.42.4% B.48.5% C.81% D.无法确定
7.儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,图中葡萄糖酸锌化学式已不完整,请根据相关信息回答下列问题:
(1)葡萄糖酸锌的化学式量是455,则葡萄糖酸锌化学式氢原子右下角的数字为 ;
(2)若儿童lkg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半。体重为20kg的儿童,理论上一天还需服该口服液 支?
8.近年来,染发俨然已成为人们的时尚选择,据央视国际网络调查显示,在接受调查的2600多人中,染过发的人占到了90%以上,而且在30岁以前开始染发的人占到了被调查者的半数左右。染发化妆品具有改变头发颜色的作用,俗称染发剂。染发剂普遍含有对苯二胺这种致癌物质,化学式为C6H8N2。请回答:
(1)一个对苯二胺分子中含 个原子。
(2)对苯二胺的化学式量(或相对分子质量)为 。
9. 中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变。已知某种可燃冰的化学式为CH4•8H2O.请回答:
(1)这种可燃冰中含有 种元素,碳、氢、氧元素的原子个数比为 。
(2)这种可燃冰的相对分子质量为 。
【拔尖训练】
1.已知由CuS、CuSO3、CuSO4组成的混合物中,硫元素的质量分数为x,则混合物中氧元素的质量分数为( )
A.1-3x B.1-2x C.1-x D.无法计算
2.已知某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,则该甲醛溶液的溶质质量分数为( )
A.15%B.20%C.25%D.30%
3.经测定,某混合气体中含有C、O两种元素,其中C元素的质量分数为20%。则关于该混合物组成的说法中,不正确的是( )
A.可能由CO2、O2组成B.可能由CO 、 O2组成
C.可能由CO2、CO、O2组D.可能由CO2 、CO组成
4.已知NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为a%,则混合物中氧元素的质量分数为( )
A.a% B.2a% C.(100-1.75a)% D.(1-0.75a)%
5.某气体由CH4、C2H2、C2H4中的一种或几种组成,测得其中碳元素和氢元素的质量比为6:1,下列对该气体组成判断正确的是( )
A.该气体中一定含有C2H2 B.该气体中一定没有CH4
C.该气体中可能含有C2H2 D.该气体不可能同时含有CH4、C2H2、C2H4
6.我国科学家在实验室实现以CO2和H2为原料人工合成淀粉[(C6H10O5)n],若用44gCO2人工合成淀粉(假设反应过程中无含碳物质的加入和损失),理论上制得淀粉的质量为 g。
7.根据下表中物质的分子排列规律,空格中物质的分子式应该是( )
A. C6H12 B. C5H10 C. C4H10 D. C5H12
8.已知FeO、Fe2O3 、Fe3O4组成的混合物中,铁与氧的质量比是21:8,则混合物中FeO、Fe2O3 、Fe3O4三种物质的质量比可能是( )
A.9:20:5 B.18:40:33 C.2:5:3 D.5:6:3
9.已知铁的氧化物中通常只有+2、+3两种化合价,测得铁的某种氧化物晶体的化学式为Fe23O25,则其中Fe2+,Fe3+的粒子个数比是 。分类
意义
实例 (以H2O为例)
宏观
①表示一种
水
②表示该物质的
水是由氢、氧两种元素组成的
微观
③表示物质的
一个水分子
④表示物质的
一个水分子是由两个氢原子和一个氧原子构成的
⑤表示组成物质的各种元素的
水分子中H、O原子的个数比为2:1
物质
化学式的写法
化学式的读法
单质
金属单质
稀有气体单质
固体非金属单质
气体非金属单质
化合物
氧化物
金属元素和非金属元素组成的化合物
盐(金属离子或铵根离子与酸根离子结合)或碱(金属离子或铵根离子与氢氧根离子结合)
元素和根
的名称
元素和根的符号
常见的化合价
元素和根
的名称
元素和根的符号
常见的化合价
元素和根
的名称
元素和根的符号
常见的化合价
钾
K
+1
铁
Fe
+2,+3
溴
Br
-1
钠
Na
+1
铝
Al
+3
氧
O
-2
银
Ag
+1
锰
Mn
+2,+4,+6,+7
硫
S
-2,+4,+6
钙
Ca
+2
锌
Zn
+2
碳
C
+2,+4
镁
Mg
+2
氢
H
+1
硅
Si
+4
钡
Ba
+2
氟
F
—1
氮
N
-3,+2,+3,+4,+5
铜
Cu
+1,+2
氯
Cl
-1,+1,+5,+7
磷
P
-3,+3,+5
氢氧根
硝酸根
硫酸根
碳酸根
铵根
OH-
NO3-
SO42-
CO32-
NH4+
-1
-1
-2
-2
+1
项目
离子符号
化合价
标注位置
元素符号的
元素符号的
正负号、数字位置
数字在前、
、数字在后
数值为1时
举例
Na+、S2-、NO
EQ \* jc2 \* hps12 \\ad(\s\up 9(+),N)EQ \* jc2 \* hps12 \\ad(\s\up 9(1),a)EQ \* jc2 \* hps12 \\ad(\s\up 9(-),C)EQ \* jc2 \* hps12 \\ad(\s\up 9(1),l)、EQ \* jc2 \* hps10 \\ad(\s\up 9(0),N)2、EQ \* jc2 \* hps10 \\ad(\s\up 9(+4),S)EQ \* jc2 \* hps10 \\ad(\s\up 9(-2),O)2
交叉法
五氧化二磷
二氧化碳
一排顺序二标价
价数约简绝对化
约后交叉作角码
化合价原则来检查
(+5)×2+(−2)×5=0
(+4)+(−2)×2=0
计算物质的相对分子质量
Fe2O3的相对分子质量==56×2+16×3==160
计算组成物质的各元素质量比
Fe2O3中各元素的质量比是:铁元素:氧元素==(56×2):(16×3)==7:3
计算物质中某元素的质量分数
Fe2O3中Fe的质量分数==【56×2/(56×2+16×3)】×100%
==(112/160)×100%==70%
计算一定量化合物中某元素的质量
例:50吨Fe2O3 中含铁元素多少吨?
解:【50吨×56×2/(56×2+16×3)】×100%==50吨×70%==35吨(答略)
第一组
第二组
CO2与SO2
与
相似之处:
(1)
(2)
相似之处:
(3)
(4)
1
2
3
4
5
6
7
8
CH4
C2H4
C3H8
C4H8
C6H12
C7H16
C8H10
课题4 化学式和化合价
【知识精要】
一、化学式
1.化学式的定义:用元素符号和数字的组合表示物质组成的式子,叫做化学式。
2.化学式的意义:
3.化学式的写法和读法:
【特别注意】
1.纯净物的组成是固定不变的,只有纯净物才有化学式(混合物没有固定的组成,因此没有化学式),且一个化学式只表示一种纯净物。
2.化学式右下角的数字为整数,原子个数为“1”时一般不写出。化学式中数字的含义(以水为例):
二、化合价
1.概念: 元素的原子之间相互化合时表现出来的一种性质,用来表示原子之间相互化合的原子数目。
2.常见元素化合价
3.常见根(原子团)
补充:根——有些物质中的一些带电 的原子团,常作为一个整体参加反应,这样的原子团叫根。
4.元素化合价与原子最外层电子数的关系:金属元素的化合价=其最外层电子数;非金属元素化合价=最外层电子数-8。
5.化合价的表示方法:化合物中各元素的化合价通常在化学式中元素符号或原子团正上方标出,正负号在前,数字在后。如H2EQ \* jc2 \* hps10 \\ad(\s\up 9(-2),O) 。
6.化合价规律
(1)化合价有正价 和 负价 之分,在化合物中各元素的化合价正负代数和为0 。
(2)在单质中,元素的化合价为0价。
(3)一般来说,在化合物中,氢元素显-1 价,氧元素显 -2 价。
(4)金属元素和非金属元素化合时,金属元素通常显正价 、非金属元素通常显负价。
(5)原子团的化合价等于各元素正负化合价的代数和
(6)有的元素在不同的化合物中显示 不同的价态,在同一化合物中,元素化合价可以显示 不同的化合价
7.化合价和离子符号比较
8.化合价的应用
(1)根据化合价写化学式
根据化学式求化合价:以重铬酸钾(K2Cr2O7)为例,求其中Cr元素的化合价。
判断化学式书写正误
【特别注意】
1.化合价口诀:
一价氢氯钾钠银,二价氧钙钡镁锌,
三铝四硅五氮磷,二、三铁,二、四碳,二四六硫都齐全,
铜汞二价最常见,莫忘单质零价现。
三、化学式的计算
1.相对分子质量:化学式中各原子的相对原子质量的总和就是相对分子质量,用符号Mr表示。
2.化合物中的原子个数之比:在化学式中,元素符号右下角的数字就是表示该元素原子的个数,因此这些数字的比值就是化合物中的原子个数之比。
3.物质组成中各元素的质量比:即各元素的相对原子质量总和的比。
4.化合物中某元素的质量分数==
该元素的相对原子质量×该元素的原子个数化合物的相对分子质量×100%
5.一定质量的物质中某元素的质量==物质的质量×该元素在物质中的质量分数。
【拓展】
1.基本计算类型(以Fe2O3为例):
2.有关混合物的计算
①纯净物的质量:混合物质量×纯净物质量分数
②混合物中某元素的质量分数:混合物中某元素质量混合物质量×100%或=纯度×纯净物中某元素质量分数
③混合物中某物质的质量分数: 混合物中某元素质量分数纯净物中某元素质量分数×100%
【题典精讲】
【例题1】下列关于化合价的叙述:
①化合价是元素的一种性质,因此称为元素的化合价,而不应称为原子的化合价。
②化合物中化合价有正价和负价,其数值由元素的一个原子得失电子数目或形成共用电子对的数目决定的。
③一种元素只有一种化合价。
④在化合物中非金属元素的化合价为负值。其中正确的是( )
①② B.①③ C.②③④ D.①
【答案】A
【解析】①化合价是元素的一种性质,因此称为元素的化合价,而不应称为原子的化合价,正确。
②化合物中化合价有正价和负价,其数值由元素的一个原子得失电子的数目或形成共用电子对的数目决定的,正确。
③一种元素可能有不同的化合价,错误。
④在化合物中非金属元素的化合价不一定为负值,比如氢氧化钠中氢元素为+1价,错误。
故选:A。
【例题2】根据下列四种粒子的结构示意图,所获取的信息不正确的是
A.他们表示四种元素的原子 B.①③④表示的是阳离子
C.④表示的元素是非金属元素 D.②表示的元素在化合物中通常显+2价
【答案】ABC
【解析】A、原子中质子数=核外电子数,①质子数8<核外电子数10,是阴离子,③质子数11>核外电子数10是阳离子,④质子数12>核外电子数10是阳离子。错误。
B、①表示阴离子,错误。
C、圆圈内数字为质子数,质子数=原子序数,所以④是镁元素,是金属元素。错误。
D、②有多个电子层,最外层电子数为2,小于4,所以容易失去最外层的2个电子变为带2个单位正电荷的阳离子,在化合物中通常显+2价,正确。故选:ABC。
【例题3】对比、分析得出结论是化学学习中重要的科学方法和手段。如对下列三组内的符号或式子分别进行对比分析,你会发现它们有许多相似之处。请你任选两组,写出组内符号或式子的两点相似之处。
【答案】(1)都是氧化物 (2)每个分子中都有两个氧原子 (3) 两种粒子的最外层电子数相等 (4)都是非金属元素
【解析】第一组:根据化学符号中所含的元素,原子个数等方面比较,可知CO2与SO2的相似之处是:都是氧化物;每个分子中都有3个原子或每个分子中都有两个氧原子。
第二组:根据粒子结构示意图可知:两种粒子的最外层电子数相等;根据非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;因此两种粒子都是非金属元素。
【例题4】下列有关化合价的说法中,正确的是( )
A.在NaCl和HClO里,氯元素均为﹣1价 B.在H2中,氢元素显+1价
C.一种元素在同一种化合物里,可能显不同的化合价 D.非金属元素在化合物里,一定显负价
【答案】C
【解析】A、在NaCl和HClO里,钠元素显+1价,氢元素显+1价,根据在化合物中各元素正负化合价代数和为零,则NaCl中氯元素为-1价;HClO里设氯元素的化合价是x,根据在化合物中各元素正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价,A选项不正确,不符合题意;
B、单质中元素化合价为0,在H2中,氢元素为0价,B选项不正确,不符合题意;
C、同一种元素在同一种物质中可能显示不同的价态,如在NH4NO3中,由于硝酸铵中含有铵根离子和硝酸根离子,在铵根离子中,铵根离子显+1价,而氢元素显+1价,所以可得氮元素为-3价;在硝酸根离子中,硝酸根离子显-1价,而氧元素显-2价,所以氮元素显+5价;所以硝酸铵中氮素分别显-3价和+5价,C选项正确,符合题意;
D、非金属元素在化合物中不一定均显负价,例如,H2O中氢元素显+1价,D选项不正确,不符合题意。故选C。
【例题5】化学就在我们身边,它与我们的生活息息相关。
现有C、H、O、Cl、Na、Ca五种元素,请选择其中的元素写出符合下列要求的物质各一种(用化学式表示):
①供给动植物呼吸的物质 ; ②胃酸的成分 ;
③用于炼铁的气体 ; ④用于改良酸性土壤的碱 。
【答案】 O2 HCl CO Ca(OH)2
【解析】①能供给动植物呼吸的物质是氧气;②胃酸的成分是盐酸;③一氧化碳具有还原性,可用于炼铁;④用于改良酸性土壤的碱是氢氧化钙。
【例题6】请根据下列提示,猜猜A、B、C、D各是何种物质,写出它们的化学式。
A.金属 液体 温度计 B.厨房 防腐剂 调味品的主要成分
C.气体 密度很小 电解水 D.氧化物 黑色 磁铁矿
A. B. C. D.
【答案】 Hg NaCl H2 Fe3O4
【解析】A、液体金属是汞,汞是体温计里的液体;故答:Hg;
B、氯化钠是厨房里的防腐剂,是调味品的主要成分;故答:NaCl;
C、电解水生成氢气和氧气两种气体,其中氢气密度很小;故答:H2;
D、磁铁矿的主要成分是四氧化三铁,黑色,属于氧化物;故答:Fe3O4。
【例题7】下列化学用语书写错误的是( )
A.两个氮原子:2NB.两个氨分子:2NH3
C.氧化铝的化学式:Al2O3D.一个钙离子:Ca+2
【答案】D
【解析】A、氮原子的元素符号为N。两个氮原子需要在原子前标注数字2,即2N。A正确;
B、一个氨分子是由1个氮原子和3个氢原子构成的。在分子前标注数字表示分子的个数。所以两个氨分子的书写为:2NH3。B正确;
C、一个氧化铝分子中有两个铝原子和三个氧原子,所以氧化铝的化学式为Al2O3。C正确;
D、一个钙离子带两个单位的正电荷,先写数字后写正负号,即Ca2+。D错误。故选D。
【例题8】下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
OB.N2C.CuD.CO2
【答案】C
【解析】元素符号能表示一种元素,还能表示该元素的一个原子;化学式能表示一种物质,当元素符号又是化学式时,就同时具备了上述三层意义。
A、O属于气态非金属元素,可表示氧元素,表示一个氧原子,但不能表示一种物质,故选项不符合题意。
B、该符号是氮气的化学式,不是元素符号,故选项不符合题意。
C、Cu属于金属元素,可表示铜元素,表示一个铜原子,还能表示铜这一纯净物,故选项符合题意。
D、该符号是二氧化碳的化学式,不是元素符号,故选项不符合题意。故选C。
【例题9】下列化学符号中“2”的含义表述正确的是( )
A.2H —2个氢元素B.O2 —2个氧原子
C.2Cl-—2个氯离子 D.CO2 —二氧化碳中含有2个氧原子
【答案】C
【解析】A.标在元素符号前面的数字表示原子的个数,2H中的“2”表示氢原子的个数为2,故选项A说法错误;
B.标在化学式中元素右下角的数字表示一个分子中所含原子的数目,O2中的“2”表示1个氧分子中含有2个氧原子,故选项B说法错误;
C.标在离子符号前面的数字表示离子的个数,2Cl-中的“2”表示氯离子的个数为2,故选项C说法正确;
D.标在化学式中元素右下角的数字表示一个分子中所含原子的数目,CO2中的“2”表示1个二氧化碳分子中含有2个氧原子,故选项D说法错误。故选C。
【例题10】用黑钨矿[主要含钨酸亚铁(FeWO4)]可制得金属钨。钨酸亚铁中钨元素(W)的化合价为( )
﹣2 B.+2 C.+4 D.+6
【答案】D
【解析】亚铁元素显+2价,氧元素显-2价,设钨元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+(-2)×4=0,则x=+6价。 故选D。
【例题10】某元素M的相对原子质量为32,M的氧化物中氧元素的质量分数为60%,则M在此氧化物中的化合价为( )
+6B.+4C.+2D.+1
【答案】A
【解析】设M在此氧化物中的化合价为x,根据化合物中各元素化合价代数和为0,氧化物中氧元素化合价为-2价,可知x大于0,则该氧化物中氧元素与M的原子个数比为2:x,M的相对原子质量为32,M的氧化物中氧元素的质量分数为60%,则M的质量分数为1-60%=40%,M的质量分数=×100%=40%,x=+6,故则M在此氧化物中的化合价为+6价,故选A。
【例题11】油画上使用的白色颜料经一段时间后会变为黑色的PbS(硫化铅),使颜料恢复白色的方法是蘸涂双氧水,发生反应的化学方程式为:PbS+4H2O2=PbSO4+4H2O,此反应中Pb元素、H元素的化合价不变,O元素的化合价变化为:-l→-2。则S元素的化合价变化为( )
+2→+4B.+2→+6C.-2→+4D.-2→+6
【答案】D
【详解】铅元素的化合价反应前后没变都是+2价,
设反应前硫元素的化合价为x,则(+2)+x=0,x=-2,反应前硫元素的化合价为-2价;
设反应后硫元素的化合价为y,则(+2)+y+(-2)×4=0,y=+6,反应后硫元素的化合价变为+6价。故选:D。
【例题12】小华初步构建了“氯及其化合物的价﹣类关系图”请根据图,回答下列问题。
(1)依次写出 A、B 两点所表示的物质的化学式,并标出各元素的化合价: 、 。
(2)C常用于实验室制取氧气,同时生成 D,写出该反应的化学方程式 ;D 是由 和 构成的(用化学符号表示)
【答案】(1) (2) 2KClO32KCl+3O2↑ K+ Cl﹣
【解析】(1)A、B 点对应物质分别是氯元素形成的单质、+4价氯元素的氧化物,氯气属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为:Cl2;氯元素显+4价,氧元素显﹣2价,其氧化物的化学式为:ClO2。故填:;;
(2)C中氯元素显+5价,可在实验室中制取氧气,则C是氯酸钾,D中氯元素显﹣1价,是C制取氧气的产生,因此D是氯化钾;在二氧化锰的催化作用下,加热氯酸钾分解为氯化钾和氧气,氯化钾是由钾离子和氯离子构成的。故填:2KClO32KCl+3O2↑;K+、Cl﹣。
【例题13】科学家研究发现,以Y2O3,BaCO3,和CuO为原料经研磨烧结后可以合成一种高温超导物质,其化学式可写成Y2Ba4CuO13,且在合成过程中各元素的化合价均无变化,则( )
A.此合成过程的反应类型是化合反应,Y的化合价是+2价
B.此合成过程的反应类型是化合反应,Y的化合价是+3价
C.此合成过程的反应类型不是化合反应,Y的化合价是+2价
D.此合成过程的反应类型不是化合反应,Y的化合价是+3价
【答案】D
【解析】试题分析: 从该反应知生成高温超导物质,化学式可写成Y2Ba4Cu6O13,不含碳元素,故还生成一种物质,故不为化合反应,在合成过程中各元素的化合价均无变化,在Y2O3中氧为—2价,则Y为+3价,故选D
【例题14】世卫组织(WHO)发表声明称,地塞米松(C22H29FO3)可挽救新冠肺炎重症患者生命。下列说法正确的是( )
A.地塞米松属于氧化物 B.地塞米松由4种元素组成
C.地塞米松中氢元素的质量分数最大 D.地塞米松中碳元素与氧元素质量比是22:5
【答案】B
【解析】由题意地塞米松的化学式为C22H29FO3,则有:
A、由两种元素组成,其中一种元素为氧元素的化合物叫做氧化物,地塞米松是由碳、氢、氟、氧四种元素组成的化合物,不属于氧化物,A选项说法不正确,不符合题意;
B、地塞米松是由碳、氢、氟、氧四种元素组成的化合物, B选项说法正确,符合题意;
C、地塞米松中碳、氢、氟、氧四种元素的质量比为,碳元素的质量分数最大,C选项说法不正确,不符合题意;
D、地塞米松中碳元素与氧元素的质量比为,D选项说法不正确,不符合题意。故选B。
【例题15】对下面符号或示意图的理解,正确的是( )
A.Fe2+、Fe3+都属于铁元素,是同一种离子
B.NO2和N2O4中氮元素化合价都是+4价,是同一化合物
C.NH4NO3中氮元素有两种不同的化合价,分别是+3、+5
D.和两种粒子的电子排布情况相同,属于同一元素
【答案】C
【解析】A.Fe2+、Fe3+质子数相同,都属于铁元素,但离子所带电荷数不同,不是同一种离子,说法错误; B.NO2、N2O4化学式不同,是不同的化合物,说法错误;C.NH4NO3中氮元素有两种不同的化合价,铵根中氮元素为-3价,硝酸根中氮元素为+5价,说法正确;D.元素种类由质子数决定,二种微粒的质子数不同,不属于同种元素,说法错误;故选C
【例题16】已知元素M的化合价为+3价,其氧化物的相对分子质量为160,则M的相对原子质量是
【答案】56
【详解】元素M的化合价为+3价,化合物中各元素化合价代数和为0,化合物中氧元素通常为-2价,则其氧化物的化学式为M2O3。其相对分子质量是160,则M×2+16×3=160,M=56。
【例题17】某正三价的金属元素A,它的氧化物中含氧元素的质量分数是30%,则A的相对原子质量是( )
A.56 B.27 C.32 D.16
【答案】A
【详解】根据元素的化合价可知该物质的化学式为A2O3,该氧化物中含氧元素的质量分数是30%,则该氧化物的化学式量是(16×3)/30%=160,则A的相对原子质量是(160-16×3)/2=56。故选A。
【例题18】已知Fe2O3和Fe3O4中氧元素质量相等,则其中铁元素质量比为
【答案】8:9
【解析】由Fe2O3和Fe3O4中氧元素质量相等,则氧原子个数相同时,氧元素的质量相等,4个Fe2O3分子和3个Fe3O4分子中氧元素质量相等,铁元素质量之比是;
【例题19】某物质含有A、B两种元素,已知A、B两种元素原子的相对原子质量之比为7:2经测定该物质A、B两元素的质量比为7:3,则该位置的化学式为( )
A.A2B3 B.AB2 C.A2B D.A3B2
【答案】A
【解析】假设该物质的化学式为AxBy,则有7x:2y=7:3,所以x:y=2:3,则该物质的化学式是A2B3。
【例题20】某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制钢。首先通过高炉炼铁得到生铁,其过程中损失 20%铁元素,然后将生铁经过炼钢炉中,通入纯氧,其过程损失 2%铁元素,最终得到含铁 98%的钢 100t,则理论上需要含杂质 20%的赤铁矿石的质量是( )
A. 223t B. 143t C.179t D.120t
【答案】A
【解析】含铁 98%的钢 100t中铁的质量为,其过程中损失20%铁元素,然后将生铁经过炼钢炉中,通入纯氧,其过程损失2%铁元素,则理论上所炼铁的质量为;
设理论上需要含杂质 20%的赤铁矿石的质量为x
x≈223t
则理论上需要含杂质 20%的赤铁矿石的质量约为223t。故选A
【考点训练】
1.在太空舱里常用NiFe2O4作催化剂将宇航员呼出的CO2转化为O2。已知NiFe2O4中Fe元素的化合价为+3价,则Ni元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
【答案】B
【解析】NiFe2O4中Fe元素为+3价,氧元素显-2价,设Ni元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:x+(+3)×2+(-2)×4=0,x=+2。故选B。
2.下列化学用语与所表达的意义对应正确的是( )
A.Fe2+——铁离子 B. ——铝原子
C.2He——2个氦元素 D.2NO2——2个二氧化氮分子
【答案】D
【解析】A.Fe2+——亚铁离子,故A错误;B. ——铝离子,故错误;C.2He——2个氦原子,故错误D.正确。故选D
3.下列符号好的“2”与O2中的“2”所表示的含义相似的是( )
A.H2O B.2Zn C.2CO D.SO42-
【答案】A
【解析】元素符号右下角的数字表示一个分子中所含的原子个数,O2中的“2”表示一个氧分子中含有2个氧原子。
A、H2O中的2表示一个水分子中含有2个氢原子,符合题意;
B、元素符号前面的数字表示原子的个数,故2Zn中的2表示锌原子的个数为2个,不符合题意;
C、化学式前面的数字表示分子的个数,故2CO中的2表示一氧化碳分子的个数为2个,不符合题意;
D、元素符号或原子团右上角的数字表示离子所带的电荷数,故中的2表示一个硫酸根离子带2个单位的负电荷,不符合题意;故选:A。
4.意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如图所示。下列有关N4的说法正确的是( )
A. N4约占空气体积的78%
B. N4是一种单质
C. N4属于一种新型的化合物
D. 由于N4与N2的组成元素相同,所以他们的性质相同
【答案】B
【详解】A、N2约占空气体积的78%,不是N4,不符合题意;
B、N4是由氮元素组成的纯净物,属于单质,符合题意
C、N4是由氮元素组成的单质,不属于化合物,不符合题意;
D、由分子构成的物质,分子是保持物质化学性质的最小粒子,N4与N2的组成元素相同,但是分子构成不同,所以它们的化学性质不相同,不符合题意。故选B。
5.绿原酸(C16H18O9)是中药金银花的成分之一,可抗菌抗病毒,下列关于该物质说法正确的是( )
A.相对分子质量为354g
B.由三种元素组成
C.碳、氢元素的质量比是8:9
D.绿原酸分子由16个碳原子、18个氢原子、9个氧原子组成
【答案】B
【解析】A.绿原酸的相对分子质量为,相对分子质量单位为1,一般省略不写,选项错误。 B.绿原酸由碳元素、氢元素和氧元素组成,选项正确。
C.绿原酸中碳元素、氢元素的质量比为,原子个数比为16:18=8:9,选项错误。
D.一个绿原酸分子由16个碳原子、18个氢原子、9个氧原子构成,选项错误。故选:B。
6.决定元素化合价的因素不可能是( )
A.得到电子的数目 B.失去电子的数目
C.化学计量数 D.形成共用电子对的数目
【答案】C
【解析】决定元素化合价的因素主要是金属元素的原子失去电子的数目、非金属元素的原子得到电子的数目以及非金属元素之间形成的共用电子对数。与化学计量数无关。故选:C。
7. 现有H+1、Na+1、S+6、O−2四种元素,如果用指定化合价将它们按两种或三种元素结合成化合物,则最多可形成化合物的种数是( )
A.4种 B.5种 C.6种 D.7种
【答案】C
【解析】四种元素中两种元素组成的化合物有水、氧化钠、三氧化硫三种物质;三种元素组成的化合物有氢氧化钠、硫酸、硫酸钠三种物质,所以由上述四种元素按两种或三种元素结合组成的化合物共六种,故选C。
8.用数轴表示某些化学知识直观、简明、易记,下列数轴表示错误的是( )
A.地壳中元素含量由高到低
B.不同种原子的原子序数依次递增
C.空气中气体体积分数由大到小
D.含氮物质中氮元素的化合价由低到高
【答案】C
【解析】A、在地壳中元素含量由多到少的顺序是氧、硅、铝、铁、钙,故选项正确;但不符合题意。
B、钠、镁、铝、硅的原子序数依次递增,故选项正确;但不符合题意。
C、空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、其他气体和杂质:0.03%.故选项错误;但符合题意。
D、利用化合价代数和为零的原则,根据H为+1、Na为+1价、O为﹣2价,K为+1价,可计算NH3中N为﹣3价、N2中N为0价、NaNO2中N为+3价、KNO3中N为+5价,单质中化合价规定为0,与数轴关系一致,故选项正确,但不符合题意。故选:C。
9. 已知某物质的化学式为RNO3,相对分子质量是85,则R元素的相对原子质量是( )
A.55B.55 gC.23D.23 g
【答案】C
【解析】设R的相对原子质量为X。则:X+14+16×3=85 解得 X=23。故选C。
10. 下列物质中均含有氯元素,它们按下列顺序排列①AgCl②Cl2③X④NaClO3⑤KClO4根据这种排布规律推测,X可能是( )
A.NaCl B.KClO3 C.HClO2 D.Cl2O5
【答案】C
【解析】根据在单质中元素化合价为0,化合物中正负化合价代数和为零,可知含氯物质化合价为:-1,0,x,+5,+7;排列规律为化合价由低到高。
A、NaCl中氯元素的化合价为:-1,不符合题意;
B、KClO3,中氯元素的化合价为:(+1)+b+(-2)×3=0,b=+5,不符合题意;
C、HClO2中氯元素的化合价为:(+1)+c+(-2)×2=0,c=+3,符合题意;
D、Cl2O5中氯元素的化合价为:2d+(-2)×5=0,d=+5,不符合题意。故选C。
11. 异烟肼(化学式:C6H7N3O;相对分子质量:137)是治疗肺结核药物的有效成分。下列说法正确的是( )
A.异烟肼属于氧化物 B.异烟肼分子中H、O原子个数比为7∶1
C.异烟肼中C、H两种元素的质量比为36∶7 D.异烟肼中N元素质量分数的计算式为eq \f(14,137)×100%
【答案】B
【解析】A、异烟肼中有四种元素,不属于氧化物,故错误;
B、异烟肼分子中 H、O 原子个数比为 7﹕1,故正确;
C、异烟肼中 C、H 两种元素的质量比为 72﹕7,故错误;
D、异烟肼中 N 元素质量分数的计算式为,故错误。故选B
12. 含氧元素质量相同的SO2和SO3,具有相同的( )
A.硫元素质量 B.质量 C.氧原子个数 D.分子个数
【答案】C
【解析】A、二氧化硫中氧元素、硫元素的质量比为:1:1,三氧化硫中硫元素、氧元素的质量比为:2:3,故当氧元素的质量相等时,硫元素的质量不能相等,故A错误;
B、SO2和SO3中氧元素的质量分数不等,故含氧量相同的SO2和SO3的质量不相等,故错误;
C、SO2和SO3的分子个数比为3:2时,含氧元素质量相同,故含有氧原子的个数相同,故正确;
D、含氧元素质量相同的SO2和SO3的分子的个数不可能相同,故错误;故选C。
13. 单晶硅和单质铁都是由原子构成的单质,试求质量比为2:1的单晶硅和单质铁中,所含有的原子个数之比为( )
A.4:1 B.2:1 C.1:1 D.1:2
【答案】A
【解析】设硅原子的数目为x,铁原子的数目为y,则28x:56y=2:1,x:y=4:1,故选A。
14.某家庭式空气净化器在工作时会释放臭氧(O3),利用其强氧化性杀菌消毒并转化为无污染的氧气(O2)。下列分析合理的是( )
A.O3的强氧化性是由O3分子结构决定的
B.相同质量的O3与O2所含的分子个数相同
C.相同分子个数的O3和O2中,所含氧原子的个数相同
D.O3和O2都由氧元素组成,他们的化学性质完全相同
【答案】A
【解析】A.结构决定性质,O3的分子结构决定了O3的化学性质,此选项符合题意
B、等质量的O3与O2所含的分子个数不相同,此选项不符合题意;
C、相同分子个数的O3和O2中,所含氧原子的个数不相同
D、分子是保持物质化学性质的最小微粒,构成O3与O2的分子不同,化学性质也不相同,此选项不符合题意。故选A
【培优训练】
1.过氧乙酸(C2H4O3)是常见的消毒剂。下列关于过氧乙酸的说法正确的是( )
A.分子中含O3分子 B.氢、氧原子个数比为4:3
C.分子中有9种元素 D.碳的质量分数为24%
【答案】B
【解析】A、分子是由原子构成的,过氧乙酸分子中含有氧原子而不是O3分子,故错误;
B、由化学式可知,过氧乙酸(C2H4O3)中氢、氧原子的个数比为4:3,故正确;
C、元素是宏观概念,分子中不含元素,故错误;
D、过氧乙酸(C2H4O3)中碳元素的质量分数为:×100%=31.6%,故错误。故选B。
2.测定铁与氧气反应的产物时,测得5.6铁在足量的氧气中燃烧得到7.8g固体,不考虑其他误差因素,则该固体产物的组成可能是( )
A.Fe3O4和Fe B. Fe3O4和FeO C. Fe3O4和Fe2O3 D. Fe3O4、FeO和Fe
【答案】C
【解析】5.6g铁在足量的氧气中燃烧,生成物中不可能有铁,排除A、D。根据质量守恒定律,固体产物中铁元素的质量为5.6g,氧元素的质量为:7.8g-5.6g=2.2g,该固体产物中铁与氧的原子个数比为::=8:11,而Fe3O4中铁元素与氧元素的原子个数比为3:4,Fe2O3中铁元素与氧元素的原子个数比为2:3,FeO中铁元素与氧元素的原子个数比为1:1。
B. Fe3O4和FeO的混合物中铁元素与氧元素的原子个数比小于3:4,此选项不符合题意;
C.Fe3O4和Fe2O3的混合物中铁元素与氧元素的原子个数比介于3:4与2:3之间,此选项符合题意。故选C。
3.意大利化学家阿伏加德罗在化学上的重大贡献是建立分子学说,他提出:同温同压下,相同体积的任何气体含有相同数目的分子。现有两个密闭容器,分别装有等质量的甲、乙两种气体,若两容器内气体温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是( )
A.气体体积:甲>乙 B.原子数目:甲<乙
C.分子数目:甲<乙 D.相对分子质量:甲>乙
【答案】D
【解析】由题意知,甲、乙两种气体质量相等,若甲的密度大于乙的密度,则甲的相对分子质量
>乙的相对分子质量;由密度=的公式得,甲的体积<乙的体积;由同温同压 下,相同体积的任何气体含有相同数目的分子可知,所以甲的分子数目<乙的分子数目;由于甲、乙气体分子未知,所以原子数目无法比较。故符合甲大于乙的是④,故选D。
4.类推的思维方法在化学学习中应用广泛,例如:水(H2O)→过氧化氢(H2O2);氧化钠(Na2O)→过氧化钠(Na2O2)。由此可推断,过氧化钡的化学式为( )
A.Ba2OB.Ba3OC.Ba2O2D.BaO2
【答案】D
【解析】水的化学式为H2O,过氧化氢的化学式为H2O2,可知,1个过氧化氢分子比1个水分子多1个氧原子,氧化钠的化学式为Na2O,过氧化钠的化学式为Na2O2,故可知,1个过氧化钠分子比1个氧化钠分子多1个氧原子,故可知,1个过氧化钡分子比1个氧化钡分子多1个氧原子,故过氧化钡的化学式为:BaO2。故选D。
4. 经过研究发现,对任何气体而言,6.02×1023个分子具有下列定量关系:
①其质量在数值上等于该分子的相对分子质量,单位为克;
②在压强为101kPa和温度为0℃时其体积为22.4升.
据此可知,32克二氧化硫的分子数为 个,含有的氧原子数为 个,在压强为101kPa和温度为0℃时其体积为 升.
【答案】 3.01×1023 6.02×1023 11.2
【解析】试题分析:有题干叙述可知64g二氧化硫中含有,6.02×1023个分子,在压强为1.01×105Pa和0℃时其体积为22.4升。据此可知,32克二氧化硫的分子数为3.01×1023个;因为1分子的二氧化硫中含有2个氧原子,所以含有氧原子数为6.02×1023个,在压强为1.01×105Pa和0℃时其体积为11.2升。
5. 铁具有可变的化合价,将14.4g草酸亚铁(FeC2O4)在隔绝空气的条件下加热分解,最终可得到7.2g铁的氧化物,则该铁的氧化物是( )
A.Fe2O3 B.FeO C.Fe3O4 D.无法确定
【答案】B
【解析】14.4g草酸亚铁(FeC2O4)中铁元素的质量=14.4g×56144×100%=5.6g,铁元素的质量比在化学反应前后不变,7.2g铁的氧化物中铁元素的质量=5.6g,氧元素的质量=7.2g-5.6g=1.6g铁的氧化物中铁元素和氧元素质量比为5.6g:1.6g=56:16,得出化学式为FeO。故选B.
6. 已知 (NH4)2SO4和(NH4)2HPO4组成的混合物中氮元素质量分数为21.2%,则氧元素的质量分数为( )
A.42.4% B.48.5% C.81% D.无法确定
【答案】B
【解析】(NH4)2SO4中氮元素和氧元素的质量比为28:64,(NH4)2HPO4中氮元素和氧元素的质量比为28:64,则(NH4)2SO4和(NH4)2HPO4组成的混合物中氮元素和氧元素的质量比为28:64,各元素的质量比等于质量分数之比,得出氧元素的质量分数为48.5%
7.儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,图中葡萄糖酸锌化学式已不完整,请根据相关信息回答下列问题:
(1)葡萄糖酸锌的化学式量是455,则葡萄糖酸锌化学式氢原子右下角的数字为 ;
(2)若儿童lkg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半。体重为20kg的儿童,理论上一天还需服该口服液 支?
【答案】(1)22;(2)1
【解析】(1)葡萄糖酸锌的化学式量是455,即12×12+x+16×14+65=455,x=22;故填:22;
(2)儿童1kg体重每日需要0.5mg锌,则体重为20kg的儿童每天需要锌的质量为0.5mg×20=10mg;每天从食物中只能摄入所需锌的一半,则每天从该口服液中摄入所需锌的质量为10mg×12=5mg;而每支口服液中含锌5.0mg/支,故体重为20kg的儿童每天还需服该口服液1支;故填:1。
8.近年来,染发俨然已成为人们的时尚选择,据央视国际网络调查显示,在接受调查的2600多人中,染过发的人占到了90%以上,而且在30岁以前开始染发的人占到了被调查者的半数左右。染发化妆品具有改变头发颜色的作用,俗称染发剂。染发剂普遍含有对苯二胺这种致癌物质,化学式为C6H8N2。请回答:
(1)一个对苯二胺分子中含 个原子。
(2)对苯二胺的化学式量(或相对分子质量)为 。
【答案】(1)16;(2)108。
【解析】(1)由苯二胺的化学式(C6H8N2)可知,1个苯二胺分子中含有6个碳原子、8个氢原子和2个氮原子,共16个原子;故填:16;
(2)对苯二胺的化学式量(或相对分子质量)为12×6+1×8+14×2=108。故填:108。
9. 中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变。已知某种可燃冰的化学式为CH4•8H2O.请回答:
(1)这种可燃冰中含有 种元素,碳、氢、氧元素的原子个数比为 。
(2)这种可燃冰的相对分子质量为 。
【答案】(1)3;1:20:8。(2)160。
【解析】(1)由CH4•8H2O可知:含有三种元素,C、H、O原子个数比为1:20:8;故填:3;1:20:8。
(2)可燃冰的化学式为:CH4•8H2O,它的相对分子质量为12+1×4+8×(1×2+16)=160;故填:160。
【拔尖训练】
1.已知由CuS、CuSO3、CuSO4组成的混合物中,硫元素的质量分数为x,则混合物中氧元素的质量分数为( )
A.1-3x B.1-2x C.1-x D.无法计算
【答案】A
【详解】混合物中Cu、S原子个数比为1:1,二者的质量比为64:32;硫元素的质量分数为x,设Cu的质量分数为a,则有解得:a=2x,所以氧元素的质量分数为:1-x-2x=1-3x。故选A。
2.已知某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,则该甲醛溶液的溶质质量分数为( )
A.15%B.20%C.25%D.30%
【答案】C
【解析】甲醛中氢氧元素的质量比为:(1×2):16=1:8,水中氢氧元素的质量比为:(1×2):16=1:8,甲醛溶液中,氢元素的质量分数为10%,则氧元素的质量分数为:80%,故碳元素的质量分数为:1-10%-80%=10%,则该溶液中甲醛的质量分数为:。故选C。
3.经测定,某混合气体中含有C、O两种元素,其中C元素的质量分数为20%。则关于该混合物组成的说法中,不正确的是( )
A.可能由CO2、O2组成B.可能由CO 、 O2组成
C.可能由CO2、CO、O2组D.可能由CO2 、CO组成
【答案】D
【解析】CO中碳元素的质量分数= ,如果气体全部是CO,碳元素的质量分数应该为43%;
CO2中C元素的质量分数=,如果气体全部是CO2,则碳元素的质量分数应该为27%;
A、如果是CO2与O2混合,一个高于20%,一个低于20%,混合后碳元素只能在27%与0%之间,可以混合出20%,即这种情况可能,不符合题意;
B、如果是CO与O2混合,一个高于20%,一个低于20%,混合后碳元素只能在43%与0%之间,可以混合出20%,即这种情况可能,不符合题意;
C、三种气体同时存在,混合后碳元素只能在43%与0%之间,可以混合出20%,即这种情况可能,不符合题意;
D、如果是CO2与CO混合,那么碳元素的质量分数必然介于43%与27%之间,不包含20%,即这种情况不可能,符合题意。故选D。
4.已知NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为a%,则混合物中氧元素的质量分数为( )
A.a% B.2a% C.(100-1.75a)% D.(1-0.75a)%
【答案】C
【解析】由于Na和H的相对原子质量和(1+23=24)等于Mg的相对原子质量(24),所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,其相对原子质量可作24)。根据A、S质量比为24:32以及硫的质量分数为a%,设A的质量分数为x,则有24:32=x:a%,解之得,混合物中A的质量分数为,氧的质量分数为1-a%-=1-1.75a%=(100-1.75a)%;故选C。
5.某气体由CH4、C2H2、C2H4中的一种或几种组成,测得其中碳元素和氢元素的质量比为6:1,下列对该气体组成判断正确的是( )
A.该气体中一定含有C2H2 B.该气体中一定没有CH4
C.该气体中可能含有C2H2 D.该气体不可能同时含有CH4、C2H2、C2H4
【答案】C
【详解】碳元素和氢元素的质量比为6:1,故碳氢原子的个数比为:,
A、若气体中只含有C2H4,则碳氢原子个数比为1:2,该气体中不一定有C2H2,说法错误,不符合题意;
B、若是含一个CH4和一个C2H2,则能达到碳氢原子个数比是1:2,说法错误,不符合题意;
C、该气体中可能含有C2H2,说法正确,符合题意;
D、该气体可能同时含有CH4、C2H2、C2H4,说法错误,不符合题意。故选C。
6.我国科学家在实验室实现以CO2和H2为原料人工合成淀粉[(C6H10O5)n],若用44gCO2人工合成淀粉(假设反应过程中无含碳物质的加入和损失),理论上制得淀粉的质量为 g。
7.根据下表中物质的分子排列规律,空格中物质的分子式应该是( )
A. C6H12 B. C5H10 C. C4H10 D. C5H12
【答案】D
【解析】从1到8物质的分子中C原子个数递增,因此物质5的分子中应含有5个碳原子,故AC不符合规律,各物质的分子构成中H原子符合1与2、3与4、7与8的H原子个数相等,即物质5的分子中含有12个H原子,故物质5的化学式为D
8.已知FeO、Fe2O3 、Fe3O4组成的混合物中,铁与氧的质量比是21:8,则混合物中FeO、Fe2O3 、Fe3O4三种物质的质量比可能是( )
A.9:20:5 B.18:40:33 C.2:5:3 D.5:6:3
【答案】AB
【解析】由化学式可知Fe3O4中铁元素和氧元素的质量比为21:8,则任意量都可满足混合物中铁、氧元素的质量之比为21:8;FeO和Fe2O3可写成FeO·Fe2O3=Fe3O4形式,即它们的分子个数的比应保持在1:1,即质量比为9:20时,两种物质的混合物中铁元素和氧元素的质量比也恰好为21:8。
A、三种物质的质量比可以是9:20:5,选项A符合题意;
B、FeO和Fe2O3的质量比为72:160=9:20时,符合要求;FeO、Fe2O3和Fe3O4三种物质的质量比可能为18:40:33,选项B符合题意;
C、FeO和Fe2O3的质量比为72:160=9:20时,符合要求;FeO、Fe2O3和Fe3O4三种物质的质量比不可能为2:5:3,选项C不符合题意;
D、三种物质的质量比不可以是5:6:3,选项D不符合题意。故选:AB。
9.已知铁的氧化物中通常只有+2、+3两种化合价,测得铁的某种氧化物晶体的化学式为Fe23O25,则其中Fe2+,Fe3+的粒子个数比是 。
【答案】19:4;
【解析】(1)Fe23O25由FeO和Fe2O3组成,设Fe2+的数目为x,Fe3+的数目为y,根据化合物中各元素的化合价代数和为零,则有:,则有:x=19,y=4,
所以Fe2+、Fe3+的粒子个数比为19:4。
分类
意义
实例 (以H2O为例)
宏观
①表示一种物质
水
②表示该物质的元素组成
水是由氢、氧两种元素组成的
微观
③表示物质的一个分子
一个水分子
④表示物质的分子构成
一个水分子是由两个氢原子和一个氧原子构成的
⑤表示组成物质的各种元素的原子个数比
水分子中H、O原子的个数比为2:1
物质
化学式的写法
化学式的读法
单质
金属单质
用元素符号做化学式
元素名称,如Al—铝
稀有气体单质
用元素符号做化学式
某气,如He—氦气
固体非金属单质
用元素符号做化学式
名称名称,如C—碳
气体非金属单质
化学式是其分子式
某气,如O2—氧气
化合物
氧化物
氧元素符号在后,另一元素符号在前,如氧化铜—CuO
从后向前读作“氧化某或几氧化几某”,如MgO—氧化镁;Fe3O4—四氧化三铁
金属元素和非金属元素组成的化合物
一般金属元素写在前、非金属元素写在后,
从后向前读作“某化某”,如ZnS—硫化锌
盐(金属离子或铵根离子与酸根离子结合)或碱(金属离子或铵根离子与氢氧根离子结合)
一般金属元素(或铵根)在前,酸根(或氢氧根)在后;且原子团的个数为多个时,应将原子团用小括号括起来,在小括号的外面右下角标上相应的个数。如硫酸钠—Na2SO4;氢氧化钠—NaOH
含酸根的化合物读作“某酸某”,如CuSO4—硫酸铜;含氢氧根的读作“氢氧化某”,如Ca(OH)2—氢氧化钙
元素和根
的名称
元素和根的符号
常见的化合价
元素和根
的名称
元素和根的符号
常见的化合价
元素和根
的名称
元素和根的符号
常见的化合价
钾
K
+1
铁
Fe
+2,+3
溴
Br
-1
钠
Na
+1
铝
Al
+3
氧
O
-2
银
Ag
+1
锰
Mn
+2,+4,+6,+7
硫
S
-2,+4,+6
钙
Ca
+2
锌
Zn
+2
碳
C
+2,+4
镁
Mg
+2
氢
H
+1
硅
Si
+4
钡
Ba
+2
氟
F
—1
氮
N
-3,+2,+3,+4,+5
铜
Cu
+1,+2
氯
Cl
-1,+1,+5,+7
磷
P
-3,+3,+5
氢氧根
硝酸根
硫酸根
碳酸根
铵根
OH-
NO3-
SO42-
CO32-
NH4+
-1
-1
-2
-2
+1
项目
离子符号
化合价
标注位置
元素符号的右上角
元素符号的 正上方
正负号、数字位置
数字在前、 正负号在后
正负号在前、数字在后
数值为1时
省略
不能省略
举例
Na+、S2-、NO
EQ \* jc2 \* hps12 \\ad(\s\up 9(+),N)EQ \* jc2 \* hps12 \\ad(\s\up 9(1),a)EQ \* jc2 \* hps12 \\ad(\s\up 9(-),C)EQ \* jc2 \* hps12 \\ad(\s\up 9(1),l)、EQ \* jc2 \* hps10 \\ad(\s\up 9(0),N)2、EQ \* jc2 \* hps10 \\ad(\s\up 9(+4),S)EQ \* jc2 \* hps10 \\ad(\s\up 9(-2),O)2
交叉法
五氧化二磷
二氧化碳
一排顺序二标价
价数约简绝对化
约后交叉作角码
化合价原则来检查
(+5)×2+(−2)×5=0
(+4)+(−2)×2=0
计算物质的相对分子质量
Fe2O3的相对分子质量==56×2+16×3==160
计算组成物质的各元素质量比
Fe2O3中各元素的质量比是:铁元素:氧元素==(56×2):(16×3)==7:3
计算物质中某元素的质量分数
Fe2O3中Fe的质量分数==【56×2/(56×2+16×3)】×100%
==(112/160)×100%==70%
计算一定量化合物中某元素的质量
例:50吨Fe2O3 中含铁元素多少吨?
解:【50吨×56×2/(56×2+16×3)】×100%==50吨×70%==35吨(答略)
第一组
第二组
CO2与SO2
与
相似之处:
(1)
(2)
相似之处:
(3)
(4)
1
2
3
4
5
6
7
8
CH4
C2H4
C3H8
C4H8
C6H12
C7H16
C8H10
相关试卷
人教版(2024)课题2 水的净化课后复习题:
这是一份人教版(2024)课题2 水的净化课后复习题,共29页。
人教版(2024)九年级上册课题2 氧气当堂达标检测题:
这是一份人教版(2024)九年级上册课题2 氧气当堂达标检测题,共43页。
初中化学人教版(2024)九年级上册课题1 空气巩固练习:
这是一份初中化学人教版(2024)九年级上册课题1 空气巩固练习,共38页。













