

河南省焦作市博爱县博爱县第一中学2024-2025学年高三上学期9月月考化学试题
展开
这是一份河南省焦作市博爱县博爱县第一中学2024-2025学年高三上学期9月月考化学试题,共18页。试卷主要包含了可能用到的相对原子质量等内容,欢迎下载使用。
考生注意:
1.答题前,考生务必用黑色签字笔将自己的姓名、准考证号、座位号在答题卡上填写清楚;
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,在试卷上作答无效;
3.考试结束后,请将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32
一、选择题:本题共15小题,每小题3分,共计45分。在每小题列出的四个选项中,只有一项是符合题目要求的。
1.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是( )
A.Cu2+将H2O2还原为O2
B.H2O2既表现氧化性又表现还原性
C.Cu2+是H2O2分解反应的催化剂
D.发生了反应:Cu2O+H2O2+4H+2Cu2++3H2O
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LCH3CHO中含有π键的数目为0.5NA
B.1ml基态Ni原子中含有未成对电子数为3NA
C.100mL8ml/L浓硝酸与6.4g的Cu完全反应转移的电子数目为0.2NA
D.工业合成氨的反应通入14gN2和14gH2充分反应后生成NH分子的数目为NA
3.可用作焙烤食品的添加剂,《中华人民共和国国家标准》规定焙烤食品中铝的残留量。取加热分解,加热过程中固体质量随温度的变化如图所示,a、b、c点对应的固体均为纯净物。下列说法错误的是( )
A.在水中的电离方程式为
B.a点剩余的固体可能为
C.b点剩余的固体可能为
D.c点剩余的固体可能为
4.W、X、Y、Z为原子序数依次增大的前10号元素,W原子半径最小,X、Y、Z为同一周期相邻的三种元素且电负性依次增大;元素Y的最高正价与最低负价的代数和为2;第四周期元素M的基态原子有两个单电子,且价层电子的空间运动状态有6种;由以上五种元素形成的配合物结构如图所示,该结构中Y原子组成正方形且两个五元环共面。下列说法正确的是( )
A.同周期中第一电离能比元素Y大的有三种
B.元素M位于元素周期表中的第9列
C.该物质中的M为价,杂化类型不是
D.简单氢化物的稳定性:,是因为分子间氢键
5.一定温度下,探究铜与稀HNO3反应过程如下:
下列说法不正确的是( )
A.过程Ⅰ中生成无色气体的离子方程式是3Cu+2NOeq \\al(-,3)+8H+3Cu2++2NO↑+4H2O
B.步骤Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
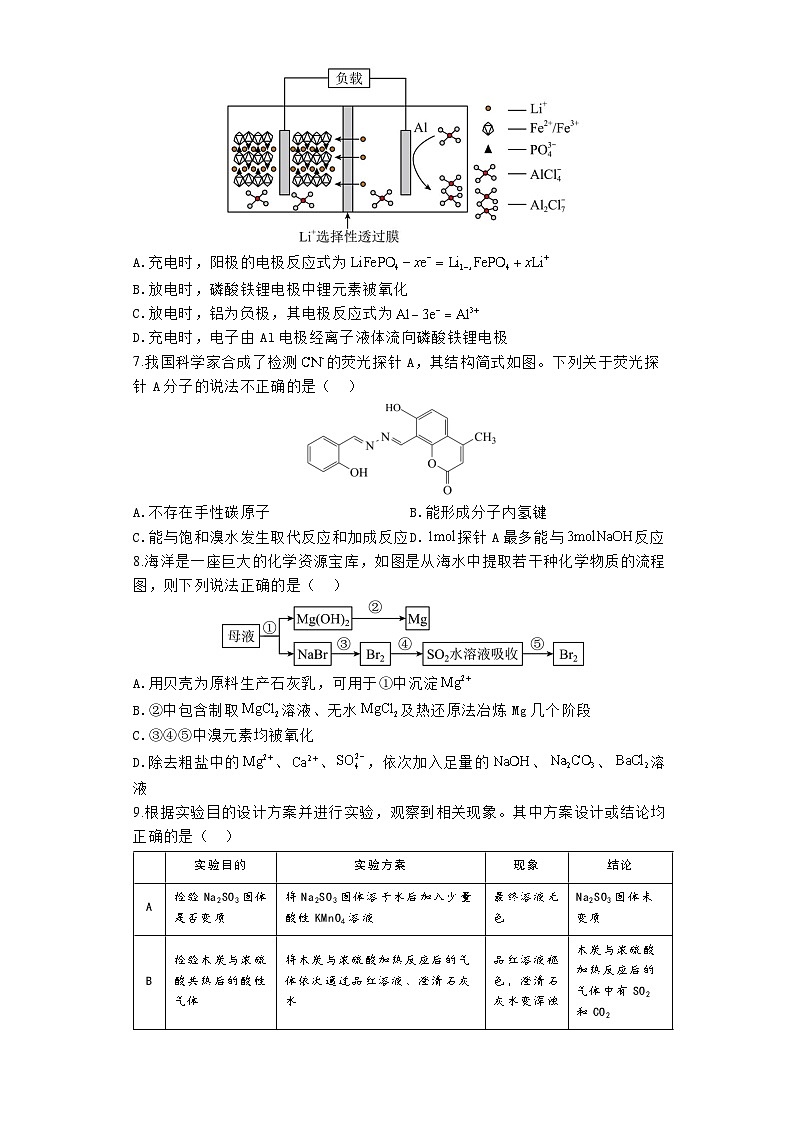
6.离子液体是指在室温或接近室温下呈现液态的、完全由阴阳离子所组成的盐,也称为低温熔融盐。一种以离子液体为电解质溶液的铝—磷酸铁锂二次电池放电时的工作原理如图所示。下列说法正确的是( )
A.充电时,阳极的电极反应式为
B.放电时,磷酸铁锂电极中锂元素被氧化
C.放电时,铝为负极,其电极反应式为
D.充电时,电子由Al电极经离子液体流向磷酸铁锂电极
7.我国科学家合成了检测的荧光探针A,其结构简式如图。下列关于荧光探针A分子的说法不正确的是( )
A.不存在手性碳原子B.能形成分子内氢键
C.能与饱和溴水发生取代反应和加成反应D.探针A最多能与反应
8.海洋是一座巨大的化学资源宝库,如图是从海水中提取若干种化学物质的流程图,则下列说法正确的是( )
A.用贝壳为原料生产石灰乳,可用于①中沉淀
B.②中包含制取溶液、无水及热还原法冶炼Mg几个阶段
C.③④⑤中溴元素均被氧化
D.除去粗盐中的、、,依次加入足量的、、溶液
9.根据实验目的设计方案并进行实验,观察到相关现象。其中方案设计或结论均正确的是( )
A.AB.BC.CD.D
10.25℃时,某酸H2R溶液中存在的各种含R元素微粒在总浓度中所占分数δ随溶液pH的变化关系如图所示。已知常温下Ksp(MR)=1.0×10-18,M2+不水解。下列叙述正确的是( )
A.常温下H2R的二级电离常数K的数量级为10-11
B.NaHR溶液中,c(H2R)O,所以同周期中第一电离能比元素N大的只有Ne和F两种,A选项错误;B.元素M为28号元素Ni,位于元素周期表中的第10列,B选项错误;C.元素M为28号元素Ni,Ni易失去两个电子变为Ni2+,故该物质中M为+2价,由结构图所示,该结构中N原子组成正方形且两个五元环共面,若Ni2+杂化类型sp3杂化,则为四面体结构,不可能出现N原子组成正方形且两个五元环共面的情况,因此Ni2+杂化类型不是sp3杂化,C选项正确;D.X元素为C元素,Y元素为N元素,简单氢化物的稳定性:XKa2,水解程度大于电离程度,c(H2R)>c(R2-),B错误;C.反应H2R(aq)+M2+(aq)MR(s)+2H+(aq)的平衡常数K==101.8,C正确;D.向MR的饱和溶液中加酸调节至中性,根据电荷守恒可知2c(M2+)+c(H+)=c(OH-)+2c(R2-)+c(HR-)+nc(酸根离子)(n取决于酸根离子的电荷数),中性溶液中氢离子浓度等于氢氧根离子浓度,溶液中还含有酸根阴离子,则有2c(M2+)>2c(R2-)+c(HR-),D错误;故答案选C。
11.【答案】D
【解析】电解时,阳极上水中的氢氧根离子放电:2H2O-4e-O2↑+4H+,故CrOeq \\al(2-,4)通过阴(b)离子交换膜向阳极移动,因2CrOeq \\al(2-,4)+2H+Cr2Oeq \\al(2-,7)+H2O为可逆反应,故外电路中转移2 ml电子时,阳极室生成的Cr2Oeq \\al(2-,7)小于1 ml;阴极上水中的氢离子放电:2H2O+2e-H2↑+2OH-,混合物浆液中的Na+通过阳(a)离子交换膜进入阴极,故阴极反应生成H2和NaOH。
12.【答案】A
【解析】吡啶()含有与苯环类似的大π键,则吡啶中N原子也发生sp2杂化,所以价层孤电子对占据了一个参与杂化的p轨道,A不正确;吡啶是极性分子且能与水分子间形成氢键,而苯为非极性分子,故吡啶在水中的溶解度比苯大,B正确;因为吡啶呈碱性,能与盐酸反应生成水溶性物质,所以除去苯中含有的少量吡啶,可用盐酸洗涤、分液、干燥有机层,C正确;烷基是推电子基团,分子中N原子电子云密度比大,故碱性较强,D正确。
13.【答案】D
【解析】A.由分析可知,Y为O,Z为Mg,故其简单离子半径为O2->Mg2+即,A错误;B.由分析可知,X为C,X在自然界中存在单质,如金刚石,B错误;C.由分析可知,W为P,白磷易自燃,红磷也易燃烧,错误;D.由分析可知,X、Y、Z依次为C、O、Mg ,则X、Y、Z可形成,属于离子化合物,正确;故答案为:D。
14.【答案】D
【解析】A.由结构简式可知,K分子中含有的酚酯基能与氢氧化钠溶液发生水解反应,则1mlK最多可以与2ml氢氧化钠发生反应,故A正确;B.由结构简式可知,L分子中含有2类氢原子,核磁共振氢谱有两组峰,故B正确;C.由结构简式可知,N分子的含氧官能团为醚键、酯基,共有2种,故C正确;D.由分析可知,1mlK与1mlL先发生取代反应、后发生消去反应生成2ml甲醇和1mlN,则生成物M与N的化学计量数之比是2:1,故D错误;故选D。
15.【答案】B
【解析】A.由分析可知氢氧化钠和硫酸铜反应生成氢氧化铜,氢氧化铜受热分解生成氧化铜所以存在c→d→e的转化,A合理;B.钠和氧化钠(过氧化钠)都能与反应都能生成氢氧化钠,B不合理;C.新制氢氧化铜可用于检验葡萄糖中的醛基,C合理;D.若b能与反应生成,则b为过氧化钠,结构中含共价键和离子键,D合理;故选B。
二、非选择题:本题共5小题,共计55分。
16.(10分)【答案】
(1)Cu+H2O2=Cu(OH)2↓
(2)Cu+H2O2+2H+=Cu2++2H2O 产生的铜离子催化了过氧化氢分解
(3)氨水与铜离子形成Cu[(NH3)4]2+,使铜离子浓度减小,提高了Cu的还原性 酸性增强可提高H2O2的氧化性
(4)酸碱性
(5)AC
【解析】(1)根据溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体可知,产物为Cu(OH)2,所以方程式为:Cu+H2O2=Cu(OH)2↓;
(2)溶液变蓝的原因是产生了Cu2+,所以方程式为Cu+H2O2+2H+=Cu2++2H2O;经检验产生的气体为氧气,氧气是由H2O分解得到,产生氧气先慢后快的原因是产生的铜离子催化了过氧化氢分解;
(3)①根据已知,氨水与铜离子形成Cu[(NH3)4]2+,使铜离子浓度减小,还原性减弱,提高了H2O2与铜离子溶液的氧化性与还原性强弱差异;
②若向U型管左侧溶液中滴加硫酸后,电压不变,继续向U型管右侧溶液中滴加硫酸后,电压增大了z,则说明酸性增强可提高H2O2的氧化性,增大了两侧溶液氧化性与还原性强弱差异;加入硫酸后,石墨发生的电极反应式为:;
(4)基于以上实验,影响Cu与H2O2反应的因素有溶液的酸碱性、溶液的浓度等;
(5)A.该实验用电化学研究物质氧化性、还原性,操作简便,现象明显,且易于量化,是该类研究的重要手段之一,故A正确;
B.实验ii发生的反应中,H2O2分解生成了氧气,体现氧化性与还原性,故B错误;
C.实验iii体现了在还原反应(氧化反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强,故C正确;
故答案为:AC。
17.(14分)【答案】
(1)Ag++2NH3⇌[Ag(NH3)2]+
(2)固体溶解,产生无色气体,遇空气后变为红棕色
(3)b a
(4)①红色石蕊试纸变蓝 ②Mg+2[Ag(NH3)2]++2NH3·H2O Mg(OH)2+2Ag+4NH3↑+2NH4+
(5)2.00
(6)c{[Ag(NH3)2]+}增大,Mg与[Ag(NH3)2]+生成Ag的反应速率增大,单位时间内生成Ag的量增多,形成更多的Mg-Ag原电池,产生H2的速率加快
(7)合理 c(NH3·H2O)改变,会使[Ag(NH3)2]+⇌Ag++2NH3平衡移动,从而改变c(Ag+),进而影响生成银的速率
【解析】(1)实验1是配制银氨溶液,结合电荷守恒、质量守恒可书写反应的离子方程式:Ag++2NH3⇌[Ag(NH3)2]+。
(2)实验2-1中产生灰白色固体,实验2-2中灰白色固体与过量稀硝酸反应,根据现象证明2-1中有Ag生成,则银与稀硝酸发生氧化还原反应溶解,同时生成无色的NO气体,NO迅速与氧气反应生成红棕色的NO2。
(3)已知由实验2-3可证明2-1中有Ag2O生成,根据图示可知实验2-3加入试剂甲后没有明显现象,则推测试剂甲不是稀硝酸,加入试剂乙后固体中的银溶解且剩余少量白色沉淀,则推测试剂乙为稀硝酸;结合实验2-2可知,白色沉淀为AgCl,则试剂甲为稀盐酸,Ag2O与盐酸反应生成AgCl(白色固体)和水,所以没有明显现象,再加入稀硝酸,AgCl不溶于硝酸,Ag与硝酸反应溶解,进一步证实推测正确。
(4)氨气溶于水溶液显碱性,可使石蕊试纸变蓝;镁与银氨溶液反应生成NH3、Ag,故化学方程式为Mg+2[Ag(NH3)2]++2NH3·H2O Mg(OH)2+2Ag+4NH3↑+2NH4+。
(5)根据控制变量的要求,只改变一个条件,即[Ag(NH3)2]+的浓度,其他条件保持相同,则总体积相同,均为8.00 mL,则a=2.00。
18.(11分)【答案】
(1)H-O-Cl
(2)Cl (或)
(3) (或)
(4)431
(5) f
【解析】(1)由分析可知,A是H,B是O,E是Cl,则A、B、E三种元素形成的三核分子的结构式为H—O—Cl;
(2)由分析可知,D是S,E是Cl,同周期越靠右非金属性越强,则非金属性更强的是Cl;可以通过置换反应来证明,故判断依据是(或);
(3)已知C-D新型一次高能电池工作时的总反应为2C+xDC2Dx即2Na+xSNa2Sx,则该电池工作时负极发生氧化反应,故电极反应式为Na-e-Na+,正极发生还原反应,故电极反应式为xS+2e-,故答案为 Na-e-Na+;(或);
(4)已知气态单质A与气态单质E完全反应生成1ml气态AE放出91.5kJ的热量,单质A中共价键的键能为436kJ/ml,单质E中共价键的键能为243kJ/ml,设单质A与单质E形成的化合物中共价键的键能为xkJ/ml,根据反应热为:E(H-H)+E(Cl-Cl)-2E(H-Cl)=-183kJ/ml,即436kJ/ml+243kJ/ml-2x=-183kJ/ml,解得:x=431kJ/ml,故答案为:431;
(5)根据反应速率之比等于化学计量系数比,结合上图中数据,用A2表示该反应在0~10min内的反应速率:;
a.由于D是固体,故往该体系中加入更多单质D,D的浓度不变,故该反应的反应速率不变,a错误;
b.由于往该体系中通入更多Ar,反应物的浓度不变,故反应速率不变,b错误;
c.由于体系加入0.2ml单质D和0.2ml的A2,若保持足够长的反应时间,该体系能够生成0.2mlA2D,即D和A2均完全反应,但题干告知是个可逆反应,故不可能完全转化,c错误;
d.10min至20min时间段,A2D浓度保持不变,说明该反应达到化学平衡状态,但反应并未停止,d错误;
e.由于该反应前后气体的化学计量数之和保持不变,故体积和温度一定时,容器内的压强一直保持不变,故容器内的压强不再改变不能说明反应达到平衡状态,d错误;
f.由于反应物中D是固体,故体积和温度一定时,混合气体的密度一直再改变,现在混合气体的密度不再改变说明反应达到平衡状态,f正确;
故答案为:;f。
19.(9分)【答案】
(1)温度超过80℃时加速浓盐酸挥发
(2)和结构相似,都属于分子晶体,的相对分子质量大,范德华力更大
(3)PbS和CuS
(4)310 低于该温度,TeCl4和SO2反应的△G>0,TeCl4不会被还原
(5)
(6)A
【解析】(1)“浸出”步骤中使用了浓盐酸,具有挥发性,则当温度超过80℃时,降低的主要原因是温度超过80℃时加速浓盐酸挥发;
(2)从晶体类型的角度分析,和结构相似,都属于分子晶体,的相对分子质量大,范德华力更大;
(3)根据分析可知,加入硫化钠可以和浸出液中的铅离子、铜离子分别生成PbS和CuS,则“净化”步骤中产生的滤渣主要含PbS和CuS;
(4)根据可知,当△G0,TeCl4不会被还原;
(5)“还原”步骤中和二氧化硫反应生成单质Te,方程式为:;
(6)综合还原效率、工艺成本和环保因素可知,氢气成本较高,结合流程可知,硫化钠对Te2+的还原效果不好,则用铁粉还原较好,故选A。
20.(11分)【答案】
(1)丙酮
(2)平面三角形 否
(3)加成反应
(4)
(5)
(6)7 HCOOCH2CH2CH3
(7)
【解析】(1)A的化学名称为丙酮;
(2)甲醛分子中心原子碳上没有孤电子对,价层电子数为3,VSEPR模型为平面三角形;分子中的键角不相等,因为碳原子所连的三个原子不完全相同;
(3)根据分析可知C+D→E的反应类型为加成反应;
(4)F分子的结构简式是 ;
(5)H和I发生缩聚反应合成PC的化学方程式是 ;
(6)能与新制反应说明含有醛基,不含醚键说明还应该有羟基或者是甲酸所形成的酯基,有CH2(OH)CH2CH2CHO、CH3CH(OH)CH2CHO、CH3CH2CH(OH)CHO、 、 、HCOOCH2CH2CH3、HCOOCH(CH3)2共7种,结合可发生水解反应,可知分子结构中存在甲酸所形成的酯基,核磁共振氢谱显示4组峰,且峰面积之比为3:2:2:1的结构简式,为HCOOCH2CH2CH3;
(7)苯甲醇氧化得到苯甲醛,2分子苯甲醛与1分子丙酮发生加成反应,得到 ,再与氢气加成反应得到 ,合成路线为。
实验目的
实验方案
现象
结论
A
检验Na2SO3固体是否变质
将Na2SO3固体溶于水后加入少量酸性KMnO4溶液
最终溶液无色
Na2SO3固体未变质
B
检验木炭与浓硫酸共热后的酸性气体
将木炭与浓硫酸加热反应后的气体依次通过品红溶液、澄清石灰水
品红溶液褪色,澄清石灰水变浑浊
木炭与浓硫酸加热反应后的气体中有SO2和CO2
C
探究1-溴丁烷消去后的有机产物
将2.0g NaOH、15mL无水乙醇、5mL 1-溴丁烷和碎瓷片共热后的气体直接通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
1-溴丁烷消去后有不饱和烃生成
D
探究浓度对化学平衡的影响
向5mL 0.005ml/L FeCl3溶液中加入5mL 0.015ml/L KSCN溶液,振荡后再加入4滴1ml/L KSCN溶液
溶液红色变深
增大反应物浓度,平衡向正方向移动
装置
序号
试剂a
现象
ⅱ
20mL30%与4mL5ml/L混合液
Cu表面产生少量气泡,溶液逐渐变蓝,后产生较多气泡
ⅲ
20mL30%与4mL5ml/L氨水混合液
溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物
序号
配制银氨溶液所用试剂
配好的银氨溶液的组成
时间s
H2O体积mL
AgNO3溶液体积mL
氨水体积mL
[Ag(NH3)2]+浓度ml·L-1
氨水浓度ml·L-1
3-1
6.00
1.00
1.00
0.25
1.00
600
3-2
4.00
2.50
1.50
0.625
1.00
300
3-3
2.00
4.00
a
1.00
1.00
60
相关试卷
这是一份河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题,共17页。
这是一份115,2024届河南省焦作市博爱县第一中学高三一模化学试题,共22页。
这是一份河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题,共18页。试卷主要包含了01ml/L、c=0等内容,欢迎下载使用。









