
辽宁省大连市2023_2024学年高一化学上学期12月学情反馈试题
展开一、单项选择题(每题4分,共64分)
1.下列有关铁及其化合物的说法中正确的是。
A.Fe3O4是一种红棕色粉末,俗称铁红
B.Fe2(SO4)3与KSCN反应产生血红色沉淀
C.除去FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量的铁粉,然后过滤
D.Fe(OH)2为白色固体,不溶于水,能在空气中稳定存在
2.茶叶中铁元素的检验可经过以下四步完成:灼烧灰化→6ml•L⁻¹硝酸溶解→过滤→检测滤液中的铁元素。下列说法正确的是
A.“灼烧灰化”选用的玻璃仪器有①②③
B.④用于配制6ml•L⁻¹硝酸时需洗净并烘干
C.“过滤”时需沿②向⑤中转移液体并小心搅拌
D.检测铁元素时,⑥悬垂于⑦的上方滴加KSCN溶液
3.下列溶液中,一定能大量共存的离子组是
A.无色透明溶液中:、、、
B.能溶解的溶液:、、、
C.含有的溶液:、、、
D.使酚酞变红的溶液:、、、
4.氧化物RO中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
A.A-x+8B.A-x-8C.A-x+16D.A+x-16
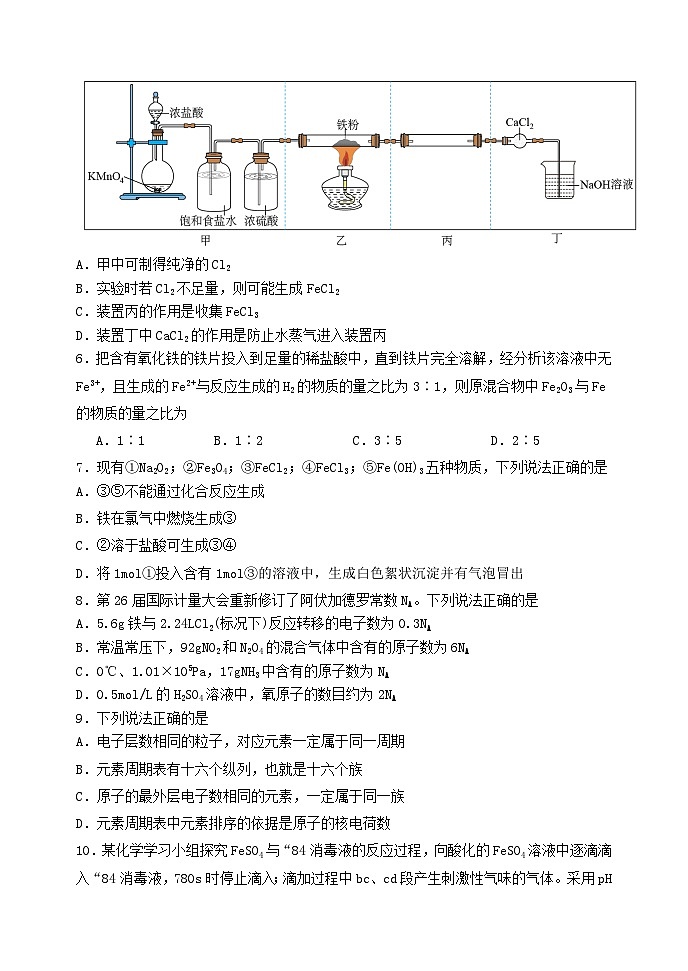
5.FeCl3是有机反应中常用的催化剂。实验室用如下图所示装置制备少量FeCl3.已知:FeCl3易升华,且易水解:FeCl3+3H2O⇌Fe(OH)3+3HCl。下列说法不正确的是
A.甲中可制得纯净的Cl2
B.实验时若Cl2不足量,则可能生成FeCl2
C.装置丙的作用是收集FeCl3
D.装置丁中CaCl2的作用是防止水蒸气进入装置丙
6.把含有氧化铁的铁片投入到足量的稀盐酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3∶1,则原混合物中Fe2O3与Fe的物质的量之比为
A.1∶1B.1∶2C.3∶5D.2∶5
7.现有①Na2O2;②Fe3O4;③FeCl2;④FeCl3;⑤Fe(OH)3五种物质,下列说法正确的是
A.③⑤不能通过化合反应生成
B.铁在氯气中燃烧生成③
C.②溶于盐酸可生成③④
D.将1ml①投入含有1ml③的溶液中,生成白色絮状沉淀并有气泡冒出
8.第26届国际计量大会重新修订了阿伏加德罗常数NA。下列说法正确的是
A.5.6g铁与2.24LCl2(标况下)反应转移的电子数为0.3NA
B.常温常压下,92gNO2和N2O4的混合气体中含有的原子数为6NA
C.0℃、1.01×105Pa,17gNH3中含有的原子数为NA
D.0.5ml/L的H2SO4溶液中,氧原子的数目约为2NA
9.下列说法正确的是
A.电子层数相同的粒子,对应元素一定属于同一周期
B.元素周期表有十六个纵列,也就是十六个族
C.原子的最外层电子数相同的元素,一定属于同一族
D.元素周期表中元素排序的依据是原子的核电荷数
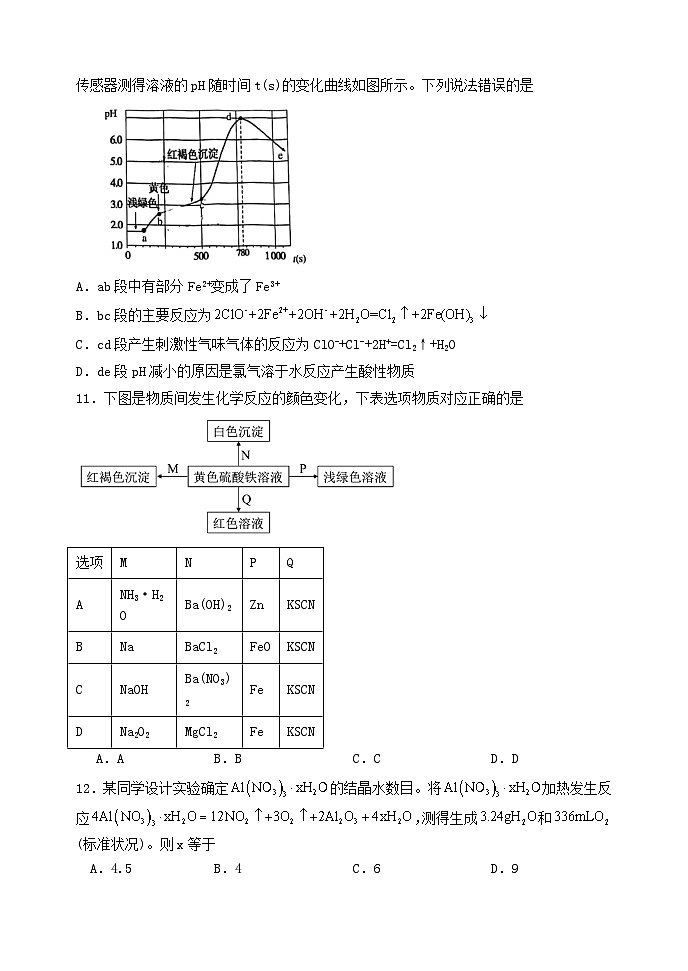
10.某化学学习小组探究FeSO4与“84消毒液的反应过程,向酸化的FeSO4溶液中逐滴滴入“84消毒液,780s时停止滴入;滴加过程中bc、cd段产生刺激性气味的气体。采用pH传感器测得溶液的pH随时间t(s)的变化曲线如图所示。下列说法错误的是
A.ab段中有部分Fe2+变成了Fe3+
B.bc段的主要反应为
C.cd段产生刺激性气味气体的反应为ClO-+Cl-+2H+=Cl2↑+H2O
D.de段pH减小的原因是氯气溶于水反应产生酸性物质
11.下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
A.AB.BC.CD.D
12.某同学设计实验确定的结晶水数目。将加热发生反应,测得生成和(标准状况)。则x等于
A.4.5B.4C.6D.9
13.铁黄是一种优质颜料。制备铁黄晶种时,向精制溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至时,开始通入空气,溶液随时间的变化曲线如图。下列分析不正确的是
A.产生白色沉淀的离子方程式为
B.0~t1发生的主要反应为
C.t1~t2发生的主要反应为
D.后仅发生反应4Fe2++O2+4H+=4Fe3++2H2O
14.下列对碱金属性质的叙述中,正确的是( )
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高
A.①③B.②④C.①④D.②③
15.下列有关实验装置进行的实验,能达到实验目的的是
A.图1MnO2与浓盐酸反应制备Cl2B.图2根据“侯氏制碱法”原理制备NaHCO3
C.图3制备Fe(OH)2白色沉淀D.图4用海水制取蒸馏水
16.将一定量的Fe、Fe2O3、Cu的混合物放入体积为100mL、浓度为2.2ml⋅L−1的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28g.过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL).向滤液中滴加2ml⋅L−1NaOH 溶液,直至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为
A.2ml⋅L−1B.1.8 ml⋅L−1C.1.4 ml⋅L−1D.无法计算
二、填空题 (共三道大题,每空3分,共36分)
17.现有下列八种物质:①盐酸;②小苏打;③FeSO4•7H2O;④二氧化碳;⑤蔗糖;⑥氢氧化铁胶体;⑦氨水;⑧NaHSO4固体。
(1)上述八种物质中,属于电解质的是(填序号,下同);属于非电解质的是。
(2)向⑥中滴加①产生的现象为。
(3)将少量②的溶液与澄清石灰水混合,发生反应的离子方程式为。
18.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: F。
(2)反应⑤的离子方程式为。
(3)反应①-⑦的7个反应属于氧化还原反应反应的有 (填选项代号)。
A.①②④⑤⑥ B.②③④⑥⑦ C.①②③④⑤⑦ D.全部
(4)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为。
19.甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热、搅拌仪器已省略)。
有关物质性质如下表:
实验过程:
I.合成:装置C中盛有0.1ml FeCO3和200mL 1.0ml·L−1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热C并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)装置B中盛有的试剂是。
(2)合成过程加入柠檬酸的作用是促进FeCO3溶解和 。
(3)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为。
(4)过程II中加入无水乙醇的目的是。
12月月考高一化学参考答案
一、选择题
1.C2.D3.D 4.A5.B6.D7.C8.B 9.D10.B
11.C 12.D 13.D14.A15.D16.B
二、填空题
17.(1) ②③⑧④⑤
(2)先产生红褐色沉淀后溶解
(3)HCO+Ca2++OH—=CaCO3↓+H2O
18.FeCl2 2Fe2++Cl2=2Fe3++2Cl- C
Na2CO3+Cl2+H2O=NaHCO3+NaCl+NaClO
19. 饱和NaHCO3溶液 防止Fe2+被氧化 Fe2++ 2OH−= Fe(OH)2↓
溶解柠檬酸,降低甘氨酸亚铁的溶液度,使其结晶析出
大连第十二中学2023-2024学年度上学期12月份学情反馈
高一年级化学答题纸
二、填空题 (共三道大题,每空3分,共36分)
17.
(1);。
(2)。
(3)。
18.
(1)。
(2)。
(3) 。
(4)。
19.
(1)。
(2) 。
(3)。
(4)。
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
Zn
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
Fe
KSCN
D
Na2O2
MgCl2
Fe
KSCN
甘氨酸
柠檬酸
甘氨酸亚铁
易溶于水,微溶于乙醇
易溶于水和乙醇
易溶于水,难溶于乙醇
两性化合物
强酸性、强还原性
辽宁省大连市第十二中学2023-2024学年高二下学期6月学情反馈化学试题(Word版附解析): 这是一份辽宁省大连市第十二中学2023-2024学年高二下学期6月学情反馈化学试题(Word版附解析),共29页。试卷主要包含了单选题,解答题等内容,欢迎下载使用。
辽宁省大连市第十二中学2023-2024学年高一下学期6月份学情反馈化学试卷: 这是一份辽宁省大连市第十二中学2023-2024学年高一下学期6月份学情反馈化学试卷,共6页。
2023-2024学年辽宁省大连市高一上学期12月学情反馈化学质量检测模拟试题(含答案): 这是一份2023-2024学年辽宁省大连市高一上学期12月学情反馈化学质量检测模拟试题(含答案),共7页。试卷主要包含了单项选择题,填空题等内容,欢迎下载使用。












