



高中化学苏教版选修4 化学反应原理第三单元 化学平衡的移动评课课件ppt
展开第三单元 化学平衡的移动第一课时
专题2 化学反应速率与化学平衡
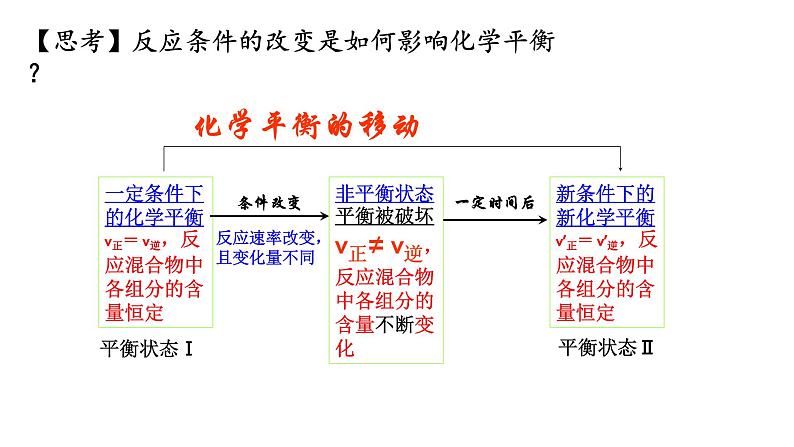
1、概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程
3、移动的原因:外界条件发生变化
2、研究对象: 已达到平衡的可逆反应体系
平衡向正反应方向移动。
平衡向逆反应方向移动。
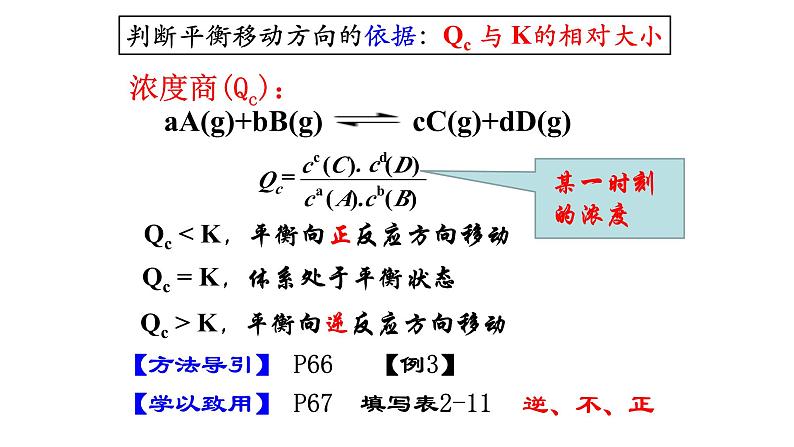
判断平衡移动方向的依据:V正与V逆的相对大小
Qc < K,平衡向正反应方向移动
Qc = K,体系处于平衡状态
Qc > K,平衡向逆反应方向移动
【方法导引】 P66 【例3】
【学以致用】 P67 填写表2-11
判断平衡移动方向的依据:Qc 与 K的相对大小
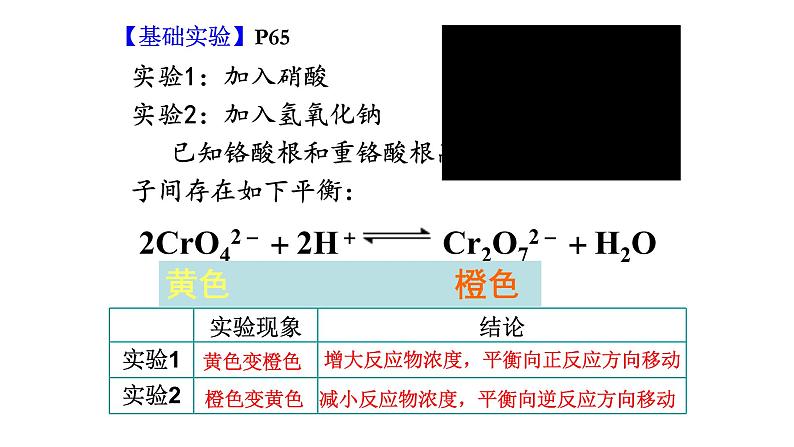
减小反应物浓度,平衡向逆反应方向移动
增大反应物浓度,平衡向正反应方向移动
实验1:加入硝酸实验2:加入氢氧化钠 已知铬酸根和重铬酸根离子间存在如下平衡:
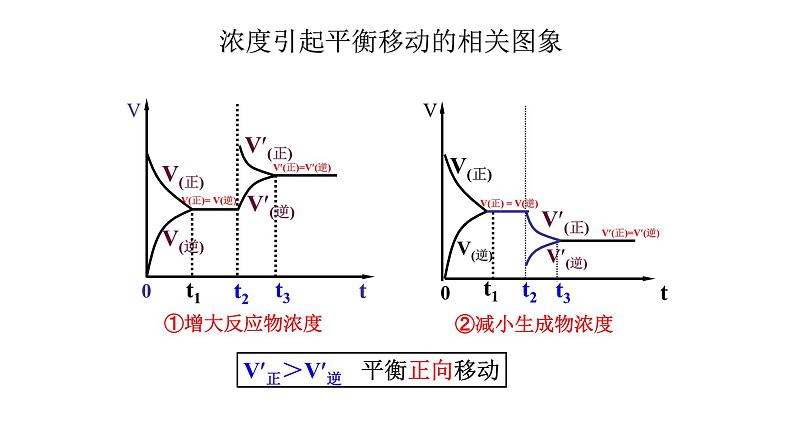
1、浓度变化对化学平衡的影响
二、影响化学平衡的因素
结论:在其他条件不变的情况下,增大反应物浓度或减小生成物的浓度都可使平衡向正反应方向移动。
V正>V逆 平衡正向移动
浓度引起平衡移动的相关图象
V逆>V正 平衡逆向移动
浓度引起平移图像特征:一突变,一渐变。
注意:①改变固体或纯液体的用量,化学平衡无影响
②增大反应物A的浓度,平衡右移,A的浓度在增大的基础上减小,但达到新平衡时,A的浓度一定比原平衡大。
【分析】在溶液中进行的反应,如果是稀释溶液,反应物浓度与生成物浓度同比减小,V(正) 、V(逆)都减小,但减小的程度可能不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动
③稀释溶液,化学平衡向化学计量数之和大的方向移动
例:将P65「基础实验」中溶液稀释十倍,试用Qc判断平衡移动的方向。
应用:在其他条件不变的情况下,通入过量的空气使平衡向正反应方向移动,从而得到更多的三氧化硫。
【导学案】 P2正误判断 P2深度思考
根据图2-18的数据,分析压强改变是如何影响合成氨的平衡的?
【观察思考】 P68
提醒:若没有特殊说明,压强的改变就默认为改变容器容积的方法来实现,如增大压强,就默认为压缩气体体积使压强增大。
Qc 与 K的相对大小
1 3 22 6 4
2、压强变化对化学平衡的影响
①若a>b,增大压强,平衡往(正向)气体分子数减少的方向移动
②若a=b,增大压强,平衡不移动
③若a
压强引起平衡移动的相关图象
⑴当 m + n > p + q时:
⑵当 m + n < p + q 时:
压强引起平移图像特征:两突变。
⑶当 m + n = p + q 时:
②无气体参与的平衡,改变压强平衡无影响。
①对于反应前后气体体积无变化的反应,压强改变对平衡无影响,但注意改变结果依然存在,如反应:2HI (g) H2 (g)+I2 (g)增大压强,体积减小,平衡不移动,但体系颜色变深。
③“惰性气体”对化学平衡的影响:
高中化学苏教版选修4 化学反应原理第一单元 化学反应速率教学演示ppt课件: 这是一份高中化学苏教版选修4 化学反应原理<a href="/hx/tb_c22679_t3/?tag_id=26" target="_blank">第一单元 化学反应速率教学演示ppt课件</a>,共35页。PPT课件主要包含了学习目标,课程导入,反之反应速率减慢,增大压强,气体体积缩小,反应物浓度增大,反应速率加快,催化剂,其他因素,课堂小结等内容,欢迎下载使用。
苏教版选修4 化学反应原理第一单元 化学反应速率说课ppt课件: 这是一份苏教版选修4 化学反应原理<a href="/hx/tb_c22679_t3/?tag_id=26" target="_blank">第一单元 化学反应速率说课ppt课件</a>,共26页。PPT课件主要包含了学习目标,课程导入,典例解析,课堂小结等内容,欢迎下载使用。
苏教版选修4 化学反应原理专题一 化学反应与能量变化第三单元 金属的腐蚀与防护评课ppt课件: 这是一份苏教版选修4 化学反应原理<a href="/hx/tb_c22677_t3/?tag_id=26" target="_blank">专题一 化学反应与能量变化第三单元 金属的腐蚀与防护评课ppt课件</a>,共40页。PPT课件主要包含了化学腐蚀,金属的腐蚀,2原理,1定义,3影响因素,家用燃气灶,电化学腐蚀,科学探究,不同条件下铁钉的腐蚀,水膜呈弱酸性或中性等内容,欢迎下载使用。













