

江西省稳派智慧上进联盟2025届高三上学期10月联考化学试题(Word版附解析)
展开化学试卷
试卷共8页,18小题,满分100分。考试用时75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改 动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷 上无效。
3.考生必须保持答题卡的整洁。考试结束后,请将答题卡交回。
可能用到的相对原子质量:H—1 N—140—16 F—19 Mg—24 S—32 Cl—35.5
C—59 Cu—64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是最符合 题目要求的。
1.文物是历史的产物,记录了人类历史的发展过程。下列文物的主要成分属于硅酸盐的是
2.中国美食文化是中国传统文化的重要组成部分,它承载了深厚的历史文化底蕴和地域特色。下 列与江西特色美食相关物质的叙述正确的是
A.南昌瓦罐汤:黏土烧制瓦罐过程只发生物理变化
B.安福火腿:保鲜火腿时添加调味剂NaNO₂
C.永和豆腐:制作豆腐时加入石膏,是利用了CaSO₄ 使豆浆中的蛋白质发生聚沉的原理
D.藜蒿炒腊肉:炒腊肉过程中使用的碘盐中的“碘”指I₂
江西 · 高三化学第1页(共8页)
A.纳西族羊皮披肩
B.三支俑铜灯
C.木雕窗棂
D.鸡形陶壶
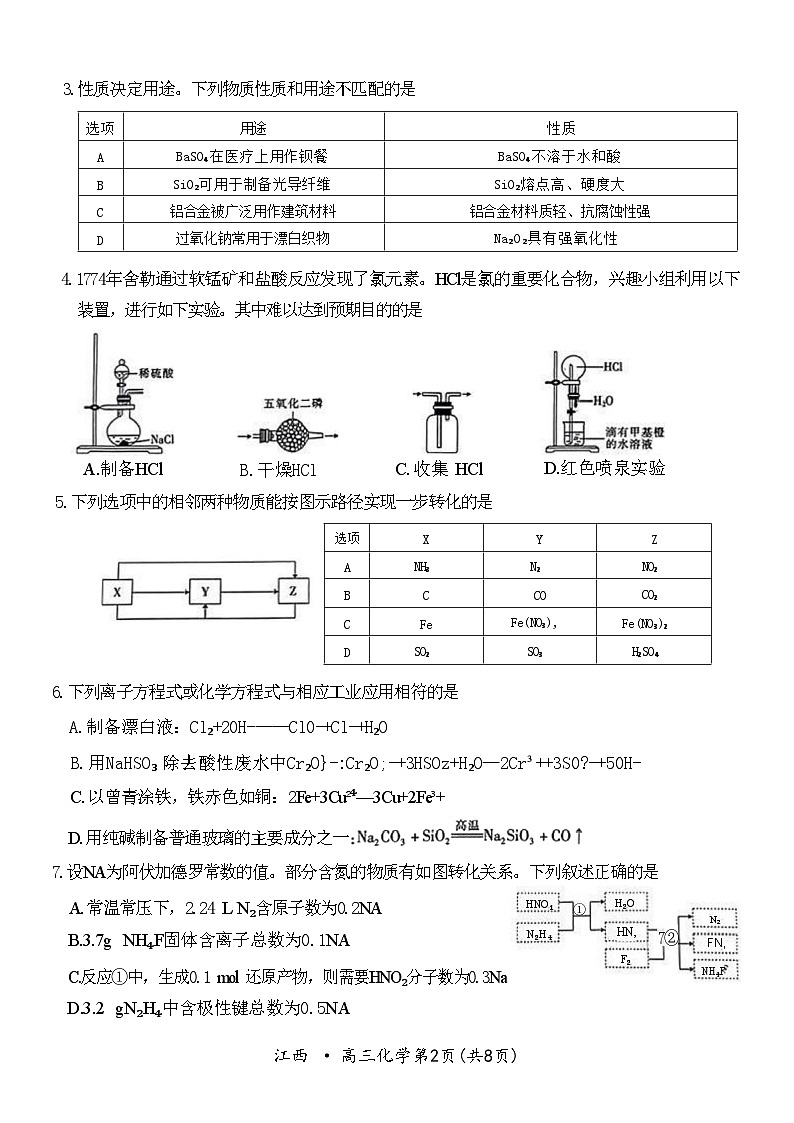
3.性质决定用途。下列物质性质和用途不匹配的是
4.1774年舍勒通过软锰矿和盐酸反应发现了氯元素。HCl是氯的重要化合物,兴趣小组利用以下 装置,进行如下实验。其中难以达到预期目的的是
A.制备HCl B.干燥HCl C. 收集 HCl D.红色喷泉实验
5.下列选项中的相邻两种物质能按图示路径实现一步转化的是
6.下列离子方程式或化学方程式与相应工业应用相符的是
A.制备漂白液:Cl₂+20H-——Cl0-+Cl-+H₂O
B.用NaHSO₃ 除去酸性废水中Cr₂O}-:Cr₂O;-+3HSOz+H₂O—2Cr³++3S0?-+50H-
C. 以曾青涂铁,铁赤色如铜:2Fe+3Cu²⁴—3Cu+2Fe³+
D. 用纯碱制备普通玻璃的主要成分之一
H₂O
N₂
HN,
FN,
F₂
NH₄F
HNO₁
N₂H₄
7②
①
7.设NA为阿伏加德罗常数的值。部分含氮的物质有如图转化关系。下列叙述正确的是
A. 常温常压下,2.24 L N₂含原子数为0.2NA
NH₄F固体含离子总数为0.1NA
C.反应①中,生成0.1 ml 还原产物,则需要HNO₂分子数为0.3Na
D.3.2 gN₂H₄中含极性键总数为0.5NA
江西 · 高三化学第2页(共8页)
选项
用途
性质
A
BaSO₄在医疗上用作钡餐
BaSO₄不溶于水和酸
B
SiO₂可用于制备光导纤维
SiO₂熔点高、硬度大
C
铝合金被广泛用作建筑材料
铝合金材料质轻、抗腐蚀性强
D
过氧化钠常用于漂白织物
Na₂O₂具有强氧化性
选项
X
Y
Z
A
NH₃
N₂
NO₂
B
C
CO
CO₂
C
Fe
Fe(NO₃),
Fe(NO₃)₂
D
SO₂
SO₃
H₂SO₄
8.某实验小组设计如图实验探究硫黄与稀硝酸反应产物。已知:FeSO₄溶液吸收NO,溶液呈棕黄 色;NO+MnOz+H*—NO₃+Mn²+H₂O (未配平)。观察到:Ⅱ装置中溶液褪色;Ⅲ装置中溶 液颜色变浅但不褪色;V 装置中溶液由浅绿色变为棕黄色。下列叙述错误的是
稀硝酸
S,
品红
溶液 Ⅱ
含酚酞的
NaOH 溶液 Ⅲ
FeSO. 酸性KMnO
溶 液 溶液
V V
A.I 装置中生成了SO₂
B.Sg和稀硝酸反应的还原产物一定是NO
C.Ⅲ 装置已除尽了SO₂
D.V 装置吸收尾气,避免尾气排入空气中
9.含Cl、Na、Al或 Fe 部分物质的“价一类”关系如图所示。下列叙述正确的是
化合价
A. 若a 能与碱反应生成两种盐,则a 和 c 都具有漂白性
B. 若f 分散于水中能形成红褐色胶体,则d 在空气中加热生成e
C.若 a 能与水剧烈反应,则a 在空气中最终转化成b
D.若f 是两性氢氧化物,则a 既能盐酸反应,又能与NaOH反应
10.下列实验操作及现象可以得出相应结论的是
江西 · 高三化学第3页(共8页)
选项
实验操作及现象
结论
A
将铜加入浓硝酸中,反应后溶液呈绿色
Cu(NO₃)₂溶液呈绿色
B
在K₂FeO₄溶液中滴加稀硫酸,溶液变为黄色,产生气体X
X 为 H₂
C
向某待测液Y中滴加盐酸,产生白色沉淀
Y可能含Ag*或[Al(OH).]-
D
将红热的木炭加入浓硝酸中,产生红棕色气体
木炭和浓硝酸一定发生了反应
11.某溶液可能含Fe²+、Cl-、Br 、I 、s²-中的若干种离子,标准状况下,向400 mL该混合液中缓慢 通入Cl₂, 混合溶液中部分离子的物质的量与氯气通入体积的关系如图所示。下列叙述正确的是
V(Cl₂L
A.通入标准状况下4.48 L Cl₂时总反应为2Fe²++Cl₂=—2Fe³++2Cl- B.通入标准状况下8.96 L Cl₂时,此时溶液c(Cl-)=2 ml·L- ¹
C.图像中b 为0.6
D.该溶液中一定不存在S²-
12.某透明溶液X的阴离子可能是CIO²、AS、S₂O3、NO₃^、ci-《、HCO₃中一种或几种且离子浓度均 为0.1 ml·L-¹, 为了测定其组成进行如下实验:
下列关于X 的推断合理的是
A.阳离子可能含有Fe³+、Al³+、Na+ B. 阴离子可能含Cl0- 、HCO₃和HS-
C.阴离子可能含HS-、HCO₃ 和NO₃ D.阴离子一定不含Cl0-、Cl-和 S₂O3-
13.1766年,科学家对西伯利亚的红铅矿(又名铬铅矿)进行了分析,铬酸铅被发现和研究。铬酸铅
俗称铬黄,难溶于水,常作颜料。以铅丹(Pb₃O₄, 其中Pb 的价态为+2、+4价)为原料制备铬黄 的微流程如下:
Pb(NO₂
K₂CrO₄
③
PbCl₂
PbO₂
气体P
浓盐酸、加热 ②
硝酸
①
铬 黄
Pb₂O
下列叙述错误的是
A.反应①中硝酸只表现酸性
B.反应②中气体P 为Cl₂, 生成0.5 ml P时转移电子数目为NA
C.反应③中,过滤分离铬黄,滤液含一种溶质
D.工业上,常用石灰乳吸收反应②的尾气
江西 · 高三化学第4页(共8页)
实验
操作
现象
①
取少量X溶液,用pH试纸测定pH
pH>7
②
取少量X溶液,滴加稀硫酸
产生气体和沉淀
14.某固体盐W 由三种短周期主族元素组成,化合物W 有如图所示转化关系。下列叙述正确的是
4.48 L气体d (标准状况)
浅黄色固体。 (6.4 g)
黑色固体b (9.6 g)
足量NaOH
△
洗涤、干燥
CuSO₄溶液
溶液
周体
气 体
固体W 过量盐酸 (13.2 g) 过滤
A.浅黄色固体可能是Na₂O₂ B.W 的化学式为(NH₄)₂S₃
C.b 的摩尔质量为160g·ml- ¹ D. 上述反应都是非氧化还原反应
二、非选择题:本题共4小题,共58分。
15. (14分)常见的几种物质有如图所示转化关系。
黑色粉末
A
④
刺激性 气体G
白色粉末 B
红色 粉 末F
溴水 ⑧
降温结品 ⑥
NaOH
空 气
②
稀硫酸 ①
溶液H
浅绿色 溶液C
红褐色 固体E
白色 粉 末B
黑色 粉末A
加热 ⑦
灼烧
③
铝粉
高温
蓝色 品 体
紫红色
粉末p
浓硫酸
强 酸K
回答下列问题:
(1)F 是 (填化学式,下同),J 的摩尔质量为250g ·ml-¹,J是 ,写出 反应④的原理在生产、生活中的一种应用:
(2)上述框图中,属于氧化还原反应的有 (填序号)。
(3)写出反应②的总反应的化学方程式:
(4)若反应①中产生一种无色无味气体,则A、B的物质的量之比范围为 ;实验室 完成反应③需要的硅酸盐仪器除酒精灯、泥三角、玻璃棒外,还需要 (填名称)。
(5)写出反应⑧的离子方程式:
16. (14分)氮化锂(Li₃N) 常用作固体电解质、催化剂等,某实验小组根据锂和氮气的反应原理设计 实验制备氮化锂并探究某些物质性质。实验装置如图所示。
已知部分信息如下:
①几种含铬的化合物颜色如下表所示:
江西 · 高三化学第5页(共8页)
②Li,N极易潮解。 回答下列问题:
(1)实验室将锂贮存于 中,锂在空气中加热会生成 (填化学式)。
(2)实验时,先点燃 ( 填“A”或“C”) 处酒精灯,后点燃另一处酒精灯。
(3)当A 装置中黄色粉末全部变为绿色时熄灭A 处酒精灯,写出该反应的化学方程式:
(4)实验完毕后,取A装置中绿色粉末X 进行如下实验:
①根据上述实验推知,Cr₂O₃性质与下列物质最相似的是 (填字母)。
a.Fe₂O₃ b.Al₂O₃ c.MgO d.P₂O₅
②已知:黑色固体Y 常用于实验室制备Cl,和O₂ 写出实验Ⅲ中反应的离子方程式:
,由此推知,该反应中氧化性:KMnO。 K₂Cr₂O₇(填“>”“<”或“=”)。
(5)设计实验探究C 装置残留固体中是否有锂: 0
(6)为了测定实验后B中固体(CCl₂·xH₂O) 组成,进行如下实验:取2.38 g B中固体溶于去离子 水,配制成250 mL 溶液,准确量取25.00 mL配制的溶液于锥形瓶,向其中加入0.1 ml ·L- ¹ AgNO₃ 溶液,测得消耗AgNO₃ 溶液体积为20.00 mL。实验室中用棕色试剂瓶盛放 AgNO₃ 溶
液,其原因是 , 第 = 0
17.(15分)1618年,英格兰一位农夫发现泻盐溶液对治疗擦伤和皮疹有效。泻盐(MgSO₄·7H₂O)被广 泛用于临床,如导泻、利胆等。以菱镁矿渣(主要成分是MgCO₃, 含少量Fe₂O₃、FeO、CaO、Al₂O₃、 SiO₂、MgO 等)为原料制备泻盐的流程如下,两种物质的溶解度与温度关系如图1所示。
稀硫酸
酸没 滤渣1
江西 · 高三化学第6页(共8页)
激沸 操作1
滤渣2 CaSO:·2H₂0
试剂X
调pH
操作2
滤液
NaC10
氧化
MgSO₂7H₂0
镁矿粉
物质
Cr₂O,(s)
Na[Cr(OH).](aq)
Cr₂ (SO₄),(aq)
(NH₄)₂Cr₂O,(s)
K₂Cr₂O,(aq)
颜色
绿色
绿色
棕红色
橘黄色
橙红色
序号
操作
现象
I
向X中加入稀硫酸,振荡
溶液变为棕红色
Ⅱ
向X中加入NaOH溶液、报荡
溶液变为绿色
Ⅲ
向X中加入KMnO₄溶液,煮沸
绿色粉末溶解,产生黑色沉淀Y,溶液变为橙红色
图1 回答下列问题:
(1)“酸没”前需将矿渣磨碎,其目的是 —
(2)“氧化”步骤中发生反应的离子方程式为 \l "bkmark1" 0
(3)“调pH”步骤中,试剂X宜选用 (填字母)。
A.MgO B. 氨水 C.Mg(OH)₂ D.NaOH
(4)“操作1”采用如图2装置过滤的原因是
图2
(5)“操作2”包括 、过滤、洗涤、干燥。
(6)MgSO₄·7H₂O 热重曲线如图3所示。
25
固体质长
20
15
10
5
a(20,24.6)
b(150,13.80)
c(200,12.00) d(780,9.33)
e(1124,4.00)
0+
200400600800100012001400160
温度/C 图3
写出b→c的化学方程式: ;780 ℃时所得固体的化学 式为 (填字母)。
A.MgO B.MgSO₄ C.MgSO₄·H₂O D.Mg₃O(SO₄)₂
江西 · 高三化学第7页(共8页)
(7)菱镁矿渣可能含有少量锰元素,实验室中可用如下方法检验某溶液中是否含有Mn²:
取适量待测液于试管、滴加稀硫酸,再加入少量NaBiO, (微溶),振荡、溶液变紫红色(还原产 物为Bi³*,无色),则证明该溶液中含Mn² (其他杂质离子不参与反应)。“溶液变紫红色” 原因是 (用离子方程式表示)。
18. (15分)NH₂CuSO₃(亚硫酸亚铜铵)是一种白色的难溶于水、难溶于泗精的化工产品。某小组设 计如下实验装置制备 NH₄CuSO,并测定 NH,CuSO₃的纯度。
98.3%硫酸
弹簧夹 浓氨水
8
a—
-CuSO(m) -NaCI0溶液
NaSO₃一
A B
请回答下列问题:
(1)仪器a 的名称为 P
(2)检查装置A气密性的操作方法为
(3)实验步骤:i.实验开始时,首先向仪器a 中逐滴加入氨水至过量;i. 然后向仪器 a 中通入 SO₂;ii. 反应完毕后,分离B中产品的主要操作是过滤、酒精洗涤、干燥。
①加入氨水至过量可观察到主要现象有 ,该过程的总反应的离子方程式为
O
②实验室打开装置A 中的分液漏斗滴加98.3%硫酸,发现产气的速率很慢,其原因可能为 ,把98.3%硫酸更换为70%硫酸后,产气速率明显加快。
③用酒精替代水洗涤的优点是 0
(4)测定产品中NH₄ 的含量。实验如下:
取a g样品加入仪器a 中,再加入足量 NaOH 溶液并加热,蒸出的 NH₃ 通入含有 V₁mLc₁ml·L-¹H₂SO₄ 标准溶液的锥形瓶中,加入2滴甲基橙作指示剂,用c₂ml·L¹NaOH
标准溶液滴定剩余的H₂SO₄,消耗V₂mLNaOH标准溶液。样品中含NH₄CuSO₃( 以NH₄ 计)的 质量分数是 %;下列操作使得NH₄ 的质量分数偏大的有 (填字母)。
a. 用NaOH标准溶液滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c. 滴定读数后,发现滴定管尖嘴处还悬有一滴氢氧化钠溶液
d. 用H₂SO₄溶液吸收NH₃操作缓慢,导致部分NH₃外逸到空气中
江西 · 高三化学第8页(共8页)
江西省2025届高三上学期10月阶段检测考 化学参考答案
1.【答案】D
【解析】羊皮披肩的主要成分为蛋白质,属于有机高分子材料,A项不符合题意;铜灯主要成分是铜锡合金,属于 金属材料,B项不符合题意;木雕窗棂的主要成分是纤维素,属于有机高分子材料,C 项不符合题意;陶壶属于陶 瓷制品,属于硅酸盐材料,D项符合题意。
2.【答案】C
【解析】黏土塑造瓦罐形状的过程属于物理变化,“烧”制过程有新物质生成,发生了化学反应,A项错误;腌制肉 类添加NaNO₂作为防腐剂,NaNO₂有毒,不能作为调味剂来使用,B项错误;豆浆是胶体,加入CaSO₄能使豆浆中 的蛋白质发生聚沉,C 项正确;碘盐中的“碘”是指KIO₃, 不是I₂,D 项错误。
3.【答案】B
【解析】SiO₂的透明度高,折射率合适,能够发生全反射,可用于制作光导纤维,B项符合题意。 4.【答案】A
【解析】稀硫酸和NaCI在常温下不反应,实验室通常用NaCl和浓硫酸反应来制备 HCI,A 项难以达到预期目的; 五氧化二磷是酸性干燥剂,可以微爆制化氢,高项能签到预棚除的缴化氢密度大于空气,采用向上排空气法收 集氯化氢,C 项能达到预期目的;氯化氢易溶于水,水溶液呈酸性,甲基橙遇盐酸变红色,可以形成红色喷泉,D 项能达到预期目的。
5.【答案】B
【解析】N₂ 在雷电作用下,与O₂ 一步生成NO, 而不是NO₂,A 项不符合题意;C 与少量O₂ 反应生成CO,CO 和O₂ 反应生成CO₂,C 和CO₂ 反应生成CO,C 和足量O₂ 反应生成CO₂,B 项符合题意;Fe 和 Fe(NO₃)₂ 不能生成 Fe(NO,),,C 项不符合题意;SO₂ 和 H₂SO, 不能生成SO₃,D 项不符合题意。
6.【答案】A
【解析】漂白液主要有效成分是NaClO,工业上用氢氧化钠溶液吸收氯气制备,A项正确;在酸性废水中不会大量 生 成OH~, 正确的离子方程式为Cr,O}+3HSO₃+5H*=2Cr*+3S0}-+4H₂O,B 项错误;铁与硫酸铜反应 生成铜和硫酸亚铁,C 项错误;Na₂CO₃与 SiO₂ 在高温下反应生成CO₂,D 项错误。
7.【答案】C
【解析】常温常压下,气体摩尔体积V>22.4L·ml¹,A 项错误;3.7g NH₂F固体的物质的量为0.1 ml,NH₂F
是离子化合物,含阴、阳两种离子,B项错误;反应①为3N₂H₄+3HNO₂=HN₃ (还原产物)+2HN,(氧化产物) +6H₂O, 生成0.1 ml 还原产物,需要0.3 ml HNO₂,C项正确;1个N₂H₄ 分子中有4个N—H键 和 1 个N—N 键,3.2g N₂H₂(0.1 ml)含极性共价键数目为0.4N,D 项错误。
8.【答案】B
【解析】品红溶液检验SO₂, 由品红溶液褪色及含酚酸的NaOH溶液颜色变浅但不褪色可表明I 装置中生成了 SO₂,A 项正确;NO可能是硝酸被还原的产物,也可能是NO₂与水反应的产物,B 项错误;若NaOH完全与SO₂ 反 应生成NaHSO₃,溶液会变无色;Ⅲ装置中溶液红色变浅,但不褪色,表明Ⅲ装置中NaOH 过量,即气体中SO₂已 除尽,C 项正确;NO能被酸性KMnO₂氧化吸收,D项正确。
9.【答案】D
【解析】Cl₂ 与碱反应生成两种盐:盐酸盐、次氯酸盐,则a 为氯气,c 为次氯酸,氯气没有漂白性,A 项错误; Fe(OH), 分散于水中形成红褐色胶体,则f 为 Fe(OH)₃,d 为 Fe0,e 为 Fe₂Oy, 在空气中加热FeO 迅速被氧化生 成Fe,O₄,B 项错误;钠能与水剧烈反应,则a 为Na, 在空气中Na最终变为Na₂CO₃,C 项错误;Al(OH), 是两性氢 氧化物,f 为Al(OH),, 则 a 为 Al,AI 能与强碱、强酸反应生成盐,D 项正确。
江西 · 高三化学第1页(共4页)
上进联考更专业更放心
一 站 式 号 试 服 务 专 家
10.【答案】C
【解析】Cu(NO,)₂ 溶液呈蓝色,NO₂饱和溶液呈黄色,二者混合后溶液呈绿色,A项错误;黄色溶液含铁离子,铁 元素化合价降低,则氧元素化合价升高,气体为O₂,B 项错误;AgCI、Al(OH),都是白色沉淀,C 项正确;HNO₃ 受热易分解生成NO₂,故产生红棕色气体不能说明木炭和浓硝酸一定发生了反应,D项错误。
11.【答案】D
【解析】离子还原性顺序:I⁻>Fe²+>Br⁴>Cl-, 从图像看出,L,代表反应:2I⁻+Cl₂=I₂+2CI-,L₂ 代表反 应:2Fe²*+Cl₂—2Fe+2CI,L, 代表反应:2Br”+Cl₂—Br₂+2CI- 。 根据电解质溶液呈电中性可知,该 溶液一定存在Fe²*,FeS 难溶于水,故一定不存在S² 。 通入标准状况下4.48 L.氯气时,发生总反应为2Fe²++ 21 +2Cl₂—2Fe¹*+I₂+4CI ,A项错误;氧化亚铁离子时消耗0.2 ml Cl₂,故 Fe²*的物质的量为0.4 ml, b=0.4; 通过上述分析,原溶液含有0.2 ml Br*,0.2 ml I,0.4 ml Fe²*,根据电荷守恒,原溶液中含0.4 ml CI”。从图像看出,共通入0.4 ml氯气,故此时溶液中·L¹=3 ml·L¹,B 、C项 错误;由分析可知,溶液含有Fe²*, 故一定不存在S²-,D 项正确。
12.【答案】C
【解析】由实验①可知,用pH 试纸测定溶液pH>7, 说明溶液呈碱性,在碱性溶液中AI³* 、Fe¹不能存在,A项 不合理;在碱性介质中CIO- 和HS° 不能大量共存,B项不合理;由实验②现象可知,产生气体和沉淀,且在弱碱 性条件下,HS~和 NO₂ 能大量共存信加稀碗酸,命能後丝反3HS~+2NO₃+5H*=3S↓+2NO↑+
4H₂0,HS⁻+H*=H₂St,HCO;+H*=CO₂T+H₂0,C 项合理;S₂0}-+2H*=S↓+SO₂T+H₂O,X 可
能存在S₂O³- 和CI-,D 项不合理。 13.【答案】C
【解析】反应①为Pb,O₄+4HNO₃—2Pb(NO₃)₂+PbO₂+2H₂O, 该反应不是氧化还原反应,硝酸只表现酸性,A 项正确;反应②为PbO₂+4HCI( 浓 ) =PbCl₂+Cl₂T+2H₂O, 生成0.5 ml Cl₂时转移电子数为N,B 项正确; 反应③为Pb²+CrO}-=-PbCrO₄1, 滤液含KNO₃、KCI,可能含K₂CrO₂等 ,C 项错误;气体P 为氯气,工业上 常用石灰乳吸收尾气中的Cl₂,D 项正确。
14.【答案】B
【解析】依题意,d 为NH,n(NH₃)=0.2 ml,固体W 在过量盐酸处理后生成浅黄色固体c,c 为硫,有单质生 成,则发生了氧化还原反应,A、D项错误;NH₃和S 物质的量均为0.2 ml,W为盐,则W为铵盐,又因为W含 3
种元素,故气体a 为 H₂S,b 为 CuS,b 的摩尔质量为96 g·ml', 又根据元素守恒,n(H)=
,W 中 n(H):n(S):n(N)=0.8 ml:0.3 nl:0.2 ml=8:3:2,W
的化学式为(NH₄)₂Sy,B 项正确,C项错误。
15.【答案】(1)Fe₂O₃(2 分) CuSO₄·5H₂O(2 分)焊接钢轨(1分,金属冶炼等其他正确答案也给分)
(2)①②④⑤⑧(2分)
(3)4FeSO₄+8NaOH+0₂+2H₂O=4Fe(OH),↓+4Na₂SO₄(2 分,反应物或生成物写错、未配平不得分,未 写“!”不扣分)
(4)大于1(2分,写>1也得分)坩埚(1分)
(5)SO₂+Br₂+2H₂O=4H*+S0}-+2Br-(2 分,反应物或生成物写错、未配平不得分)
【解析】依题意,E 为Fe(OH)₃,F 为Fe₂O₃,D 为Cu, 逆推:A为Fe,B 为CuSO,,C 为 FeSO₄溶液,G为SO₂,H 为 CuSO,溶液,J 为硫酸铜结晶水合物。K 为H₂SO₂ 和 HBr。
(1)根据摩尔质量计算,J 为五水硫酸铜,反应④为铝热反应,可利用该原理焊接钢轨、冶炼金属。
(2)上述框图中,①中发生了置换反应,②为氧气参与的氧化反应;④为置换反应;⑤为铜与浓硫酸反应;⑧为二 氧化硫与溴水反应,都是氧化还原反应。
江西 · 高三化学第2页(共4页)
上进联考更专业更放心 一 站 式 考 试 股 务 专 家
(3)可以看成两步:硫酸亚铁与氢氧化钠反应生成氢氧化亚铁和硫酸钠;氢氧化亚铁与氧气、水反应生成氢氧化 铁,加和得到总反应。
(4)铁先与硫酸铜反应,后与稀硫酸反应,由反应式知,当铁、硫酸铜的物质的量之大于1,铁与稀硫酸 反应产生H₂; 灼烧Fe(OH), 固体还需要坩埚。
(5)溴水能吸收SO₂ 生成氢溴酸和硫酸。
16.【答案】(1)石蜡油或石蜡(1分) Li₂O(1 分 )
(2)A(1 分 )
(3) 分,反应物或生成物写错、未配平不得分,未写反应条件和“个” 不扣分)
(4)①b(1 分 )
②Cr₂O₃+2MnO₄=—2MnO₂+Cr₂O}-(2 分,反应物或生成物写错、未配平不得分)>(1分)
(5)向装有少量Li₃N 样品的试管中加入足量稀硫酸,若产生气泡,则有锂,否则无锂等(2分,合理即可)
(6)AgNO, 见光易分解(1分,合理即可)6(2分)
【解析】(1)锂的密度小于煤油,应保存于石蜡油或石蜡中,Li和 O₂ 在加热条件下生成Li₂O。
(2)先点燃A处酒精灯,产生氮气排尽C 装置中空气。
(3)由实验原理及A 装置中实验现象可知,重铬酸铵受热分解先成氮气、三氧化二铬和水。
(4)①根据实验可知,三氧化二铬类似氧化铝,是两性氧化物;②三氧化二铬与高锰酸钾溶液反应生成二氧化 锰、重铬酸钾,由此知,氧化剂高锰酸钾的氧化性大于氧化产物重铬酸钾。
(5)本题属于开放性问题:利用氮化锂与水反应生成氢氧化锂和氨气,氨气极易溶于酸,锂与水反应生成氢氧化 锂和氢气检验,检验氢气可知锂是否存在,而检验氢气必须先除去氨气。方案1:产品溶于足量稀盐酸或硫酸 中,观察是否有气泡产生;方案2:加入足量水,将气体依次通过足量浓硫酸、灼热氧化铜和无水CaSO₂,若氧化铜变红 色,无水CuSO₄变蓝,则样品中有锂。
(6)硝酸银见光易分解,棕色试剂瓶有避光作用。根据AgNO,计算2.38 gB 中固体CI- 的物质的量:n(Cl-)=
0. l,根据固体组成,n(CCl₂·xH₂O)=0.01 ml,固体中H₂O的
17.【答案】(1)增大固体与酸的接触面积,加大浸取速率,提高镁元素的浸出效率(2分,合理即可)
(2)2Fe²⁴+ClO~+2H*—2Fe⁴+Cl⁻+H₂O(2 分,反应物或生成物写错、未配平不得分)
(3)AC(2 分,选对1个得1分,选错不得分)
(4)避免析出MgSO₄·7H₂O(1 分,合理即可)
(5)蒸发浓缩、冷却结晶(2分,写对1个得1分)
(6)M₂S₀.·H,O₁30~200-MaS₀.+H,01(2 分,反应物或生成物写错、未配平不得分,未写反应条件和“↑” 不扣分)
D(2 分)
(7)2Mn²⁴+5NaBiO₃+14H'—5Bi³*+2MnO[+5Na*+7H₂O(2 分,反应物或生成物写错、未配平不得分) 【解析】(1)将矿渣磨碎的目的是增大固体与酸的接触面积,加大浸取速率,提高镁元素的浸出效率。
(2)“氧化”过程中 NaClO与 Fe²+发生反应:2Fe²*+ClO~+2H*=2Fe³*+Cl-+H₂O。
(3)“调pH”中加入试剂X是为了沉淀Fe³*和A³*且不引其他杂质离子,故宜选用MgO和Mg(OH)₂。
(4)从题图1可知,硫酸镁晶体溶解度随着温度升高而增大,硫酸钙晶体溶解度受温度影响很小,趁热过滤,防 止硫酸镁晶体析出。
(5)根据图1可知,应蒸发浓缩、冷却结晶析出硫酸镁晶体。
江西 · 高三化学第3页(共4页)
上进联考更专业更放心 一 站 式 考 试 服 务 专 家
(6)初始取硫酸镁晶体的物质的量为0.1 ml, 失重时,先部分脱水,后全部脱水,最后硫酸镁部分分解,最终硫 酸镁全部分解,生成稳定的氧化镁。根据每个点数据,依据相对分子质量判断。在失重过程中镁元素始终存在 于固体中且质量不变。计算如下:
根据平均值原理,d 点组成介于c 和e 之间,即可以看成由MgSO₄和 MgO 组成,Mg₃O(SO₄)₂ 可以看 成MgO·2MgSO₄。
(7)溶液由无色变为紫红色,说明生成了高锰酸根离子,则反应的离子方程式为2Mn²++5NaBiO₃+14H*— 5Bi³+2MnOj+5Na*+7H₂O。
18.【答案】(1)三颈烧瓶(或三口烧瓶,1分)
(2)关闭弹簧夹,打开分液漏斗活塞,向圆底烧瓶中滴加液体,一段时间后,分液漏斗液体无法滴下,说明发生装 置气密性良好(2分,合理即可)
(3)①先产生蓝色沉淀,后沉淀溶解得到深蓝色溶液(2分,合理即可) Cu²+4NH,·H₂O=
[Cu(NH,).]²*+4H₂O 或 Cu²⁴+4NH,=[Cu(NH,).]²*(2 分,反应物或生成物写错、未配平不得分)
②生成的产物覆盖在反应物的表面,包裹结块(2分,或浓硫酸中溶质主要以分子形式存在,H* 浓度较小, 或其他合理叙述)
③酒精易挥发,产品易干燥(2分,合理即可) (4 (2分) a(2 分)
【解析】(1)仪器a 的名称为三颈(口)烧瓶。
(2)检查装置A气密性的操作方法为关闭弹簧夹,打开分液漏斗活塞,向圆底烧瓶中滴加液体,一段时间后,分 液漏斗液体无法滴下,说明发生装置气密性良好。
(3)①向三颈烧瓶中逐滴加入氨水时,硫酸铜溶液先与氨水反应生成氢氧化铜蓝色沉淀和硫酸铵,当氨水过量 后,氢氧化铜沉淀与氨水反应生成深蓝色的硫酸四氨合铜溶液,观察到的实验现象为先产生蓝色沉淀,后沉淀 溶解得到深蓝色溶液,总反应的离子方程式为Cu²⁴+4NH₃·H₂O=[Cu(NH₃)₄]²+4H₂O 或Cu²+4NH₃
=[Cu(NH₃)₄]²*;③ 用酒精替代水洗涤的优点是酒精易挥发,产品易干燥。
(4)硫酸总的物质的量n(H₂SO₄)=c₁·V₁×10-³ml, 含有氢离子的物质的量为n(H*)=2n(H₂SO₄)=2c,·V₁× 10³ml, 氢氧化钠的物质的量n(NaOH)=c₂·V₂×10~³ml, 所以氨气的物质的量n(NH₃)=2c,·V₁×10³ml-
c₂·V₂×10³ml, 样品中含 NH₄CuSO,(以NH₄ 计)的质量分数
%;滴定前仰视滴定管读数,氢氧化钠标准溶液读数变大,则标准溶液体积等于
(Vg-Vm), 即标准溶液的体积偏小,则样品中NH; 的质量分数变大,a 项正确;NaOH溶液使用前敞口放置于 空气中一段时间,会吸收空气的二氧化碳,但由于选择甲基橙做指示剂,滴定硫酸时消耗的体积不变,样品中 NH₄的质量分数无影响,b项错误;滴定读数后,发现滴定管尖嘴处还悬有一滴氢氧化钠溶液,则氢氧化钠标准 溶液读数变大,样品中NH₄ 的质量分数变小,c项错误;用H₂SO₄吸 收NH, 操作缓慢,导致部分NH,外逸到空 气中,则样品中NH₄ 的质量分数变小,d 项错误。
江西 · 高三化学第4页(共4页)代号
a
b
e
d
e
摩尔质量/g ·ml
246
138
120
280
40
组成
MgSO₂ ·7H₂0
MgSO₄ ·H₂O
MgSO₄
Mg,O(SO,):
MgO
广东省上进教育(稳派联考)2024-2025学年高三上学期10月月考化学试题(Word版附解析): 这是一份广东省上进教育(稳派联考)2024-2025学年高三上学期10月月考化学试题(Word版附解析),共19页。试卷主要包含了考生必须保持答题卡的整洁,化合物X,下列玻璃仪器,设为阿伏加德罗常数的值等内容,欢迎下载使用。
江西省稳派上进2025届高三上学期秋季入学摸底考试 化学试题(解析版): 这是一份江西省稳派上进2025届高三上学期秋季入学摸底考试 化学试题(解析版),共22页。试卷主要包含了考生必须保持答题卡的整洁,2ml SO时转移电子数为等内容,欢迎下载使用。
化学丨江西省智慧上进稳派联考2025届高三7月期末调研测试化学试卷及答案: 这是一份化学丨江西省智慧上进稳派联考2025届高三7月期末调研测试化学试卷及答案,共10页。












