
第16讲 硝酸-新高一化学暑假精品课程(鲁科版2019)(原卷版)
展开
这是一份第16讲 硝酸-新高一化学暑假精品课程(鲁科版2019)(原卷版),共8页。
1.掌握硝酸的主要性质。
2.了解硝酸的用途。
3.了解工业制硝酸的原理
【基础知识】
一、硝酸的性质
1.物理性质
(1)色味态:纯硝酸是一种____色有______气味的液体
(2)密度:比水_____,密度越大,浓度越______,常见浓硝酸浓度为68%~70%
(3)溶解性:以______比和水互溶
(4)挥发性:浓硝酸易挥发,同__________。浓度为95%以上的硝酸称为___________
2.与金属单质反应
(1)Al、Fe:遇到浓硝酸,常温______,加热_______
(2)Au、Pt:任何情况下都不反应
(3)其他金属(如铜):常温反应
①浓硝酸:________________________________________
②稀硝酸:________________________________________
3.与非金属单质反应:加热反应
(1)浓硝酸:________________________________________
(2)稀硝酸:________________________________________
4.不稳定性
(1)条件:光照或受热易分解
(2)反应:________________________________________
5.保存
(1)易挥发:_______保存,敞口放置,质量_______,浓度_______
(2)易分解:____色____口瓶避____、黑暗而且温度_____的地方
(3)强氧化性:不能用_______塞,而用_______塞
(4)大量存放:____制或____制的槽车内
1.打开盛放浓硝酸的试剂瓶的塞子,会有什么现象发生?其原因是什么?
2.浓硝酸通常显黄色,其原因是什么?如何除去该颜色?
3.常温下不溶于浓HNO3的金属有哪些?
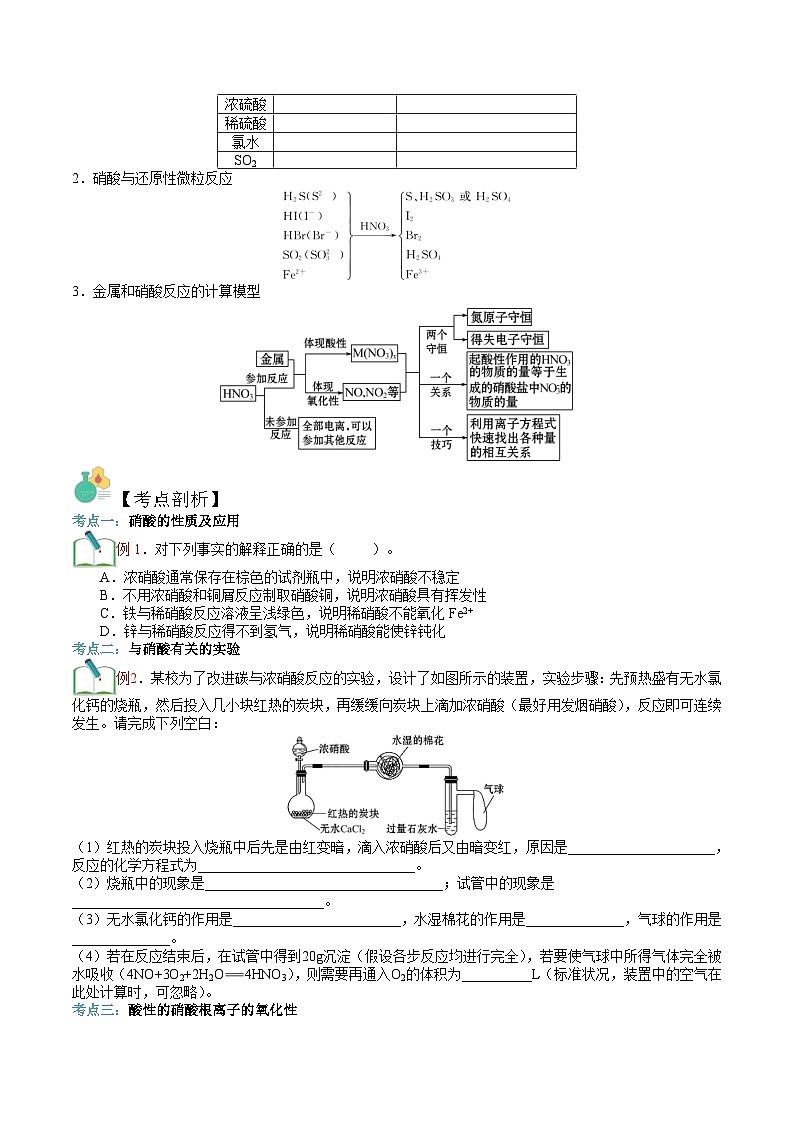
二、硝酸的强氧化性的应用
1.硝酸和蓝色石蕊试纸的反应
2.硝酸与还原性微粒反应
3.金属和硝酸反应的计算模型
【考点剖析】
考点一:硝酸的性质及应用
例1.对下列事实的解释正确的是( )。
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.不用浓硝酸和铜屑反应制取硝酸铜,说明浓硝酸具有挥发性
C.铁与稀硝酸反应溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化
考点二:与硝酸有关的实验
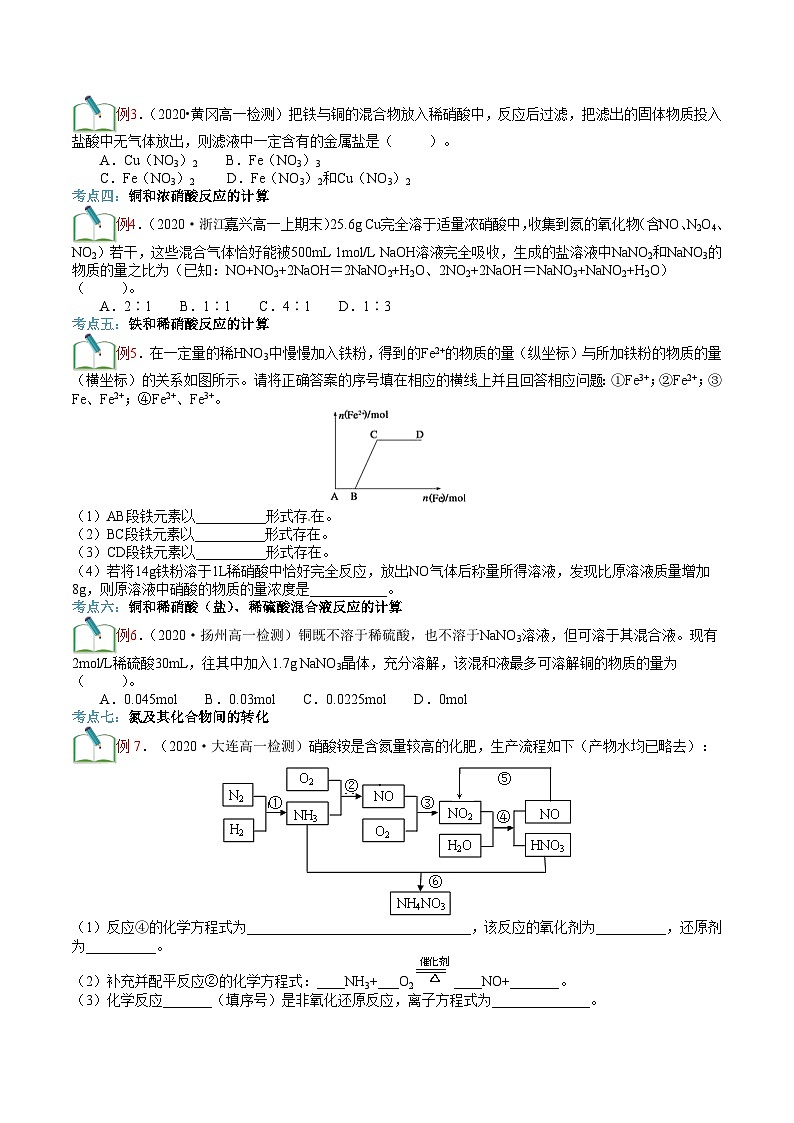
例2.某校为了改进碳与浓硝酸反应的实验,设计了如图所示的装置,实验步骤:先预热盛有无水氯化钙的烧瓶,然后投入几小块红热的炭块,再缓缓向炭块上滴加浓硝酸(最好用发烟硝酸),反应即可连续发生。请完成下列空白:
(1)红热的炭块投入烧瓶中后先是由红变暗,滴入浓硝酸后又由暗变红,原因是_____________________,反应的化学方程式为_______________________________。
(2)烧瓶中的现象是__________________________________;试管中的现象是____________________________________。
(3)无水氯化钙的作用是________________________,水湿棉花的作用是______________,气球的作用是______________。
(4)若在反应结束后,在试管中得到20g沉淀(假设各步反应均进行完全),若要使气球中所得气体完全被水吸收(4NO+3O2+2H2O4HNO3),则需要再通入O2的体积为__________L(标准状况,装置中的空气在此处计算时,可忽略)。
考点三:酸性的硝酸根离子的氧化性
例3.(2020•黄冈高一检测)把铁与铜的混合物放入稀硝酸中,反应后过滤,把滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的金属盐是( )。
A.Cu(NO3)2 B.Fe(NO3)3
C.Fe(NO3)2 D.Fe(NO3)2和Cu(NO3)2
考点四:铜和浓硝酸反应的计算
例4.(2020·浙江嘉兴高一上期末)25.6g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)若干,这些混合气体恰好能被500mL 1ml/L NaOH溶液完全吸收,生成的盐溶液中NaNO2和NaNO3的物质的量之比为(已知:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O)( )。
A.2∶1 B.1∶1 C.4∶1 D.1∶3
考点五:铁和稀硝酸反应的计算
例5.在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上并且回答相应问题:①Fe3+;②Fe2+;③Fe、Fe2+;④Fe2+、Fe3+。
(1)AB段铁元素以__________形式存在。
(2)BC段铁元素以__________形式存在。
(3)CD段铁元素以__________形式存在。
(4)若将14g铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加8g,则原溶液中硝酸的物质的量浓度是___________。
考点六:铜和稀硝酸(盐)、稀硫酸混合液反应的计算
例6.(2020·扬州高一检测)铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现有2ml/L稀硫酸30mL,往其中加入1.7g NaNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为( )。
A.0.045ml B.0.03ml C.0.0225ml D.0ml
考点七:氮及其化合物间的转化
例7.(2020·大连高一检测)硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):
(1)反应④的化学方程式为________________________________,该反应的氧化剂为__________,还原剂为__________。
(2)补充并配平反应②的化学方程式:____NH3+___O2____NO+_______。
(3)化学反应_______(填序号)是非氧化还原反应,离子方程式为______________。
(4)有人设计了一个反应来制备硝酸NO2+NH3→HNO3+H2O(未配平),你认为该反应______(填“能”或“不能”)发生,理由是______________________。
【真题演练】
1.(2020•江苏学考真题)下列气体排放到空气中,不会导致酸雨的是( )。
A.NO B.NO2 C.CO2 D.SO2
2.(2015·全国卷Ⅰ)我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )。
A.氨水 B.硝酸 C.醋 D.卤水
3.(2017·北京高考)下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )。
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【过关检测】
1.对于硝酸的物理性质,下列叙述中,不正确的是( )。
A.可以与水以任意比互溶
B.不易挥发
C.有刺激性气味
D.质量分数在95%以上的硝酸为发烟硝酸
2.久置的硝酸呈黄色的原因是( )。
A.硝酸露置在空气中被氧气氧化了
B.硝酸露置在空气中被氮气还原了
C.硝酸见光或受热分解产生的NO2再溶于硝酸中
D.硝酸是强氧化性酸
3.(2021·湖南株洲高一上期中)一些装有化学物质的容器上常贴有危险化学品的标志。下列标志中,应贴在装有浓硝酸的容器上的是( )。
A. B.
C. D.
4.在反应C+4HNO3(浓)CO2↑+4NO2↑+2H2O中浓硝酸表现出( )。
A.酸性 B.挥发性 C.强氧化性 D.不稳定性
5.(2021·福建泉州高一上期末检测)将浓HNO3滴在石蕊试纸上,产生的现象是( )。
A.变红色 B.先变红,后变黑
C.变蓝色 D.先变红,后褪色
6.(2020·福建厦门高一上期末)下列反应中硝酸既表现出酸性又表现出氧化性的是( )。
A.使石蕊试液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
7.对于反应Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O的叙述正确的是( )。
A.这是置换反应 B.反应中被氧化的是硝酸
C.所用的硝酸是稀硝酸 D.所用的硝酸是浓硝酸
8.(2020·四川攀枝花高一上期末)下列方法中不宜用浓HNO3作试剂的是( )。
A.判断黄金首饰中是否掺有铜
B.实验室制取二氧化碳
C.除去镀在铝表面的铜镀层
D.配制溶解金的王水
9.(2020•四川成都高一上期末)如图为酸雨的形成示意图,相关说法不正确的是( )。
A.HNO3、H2SO4均有腐蚀性
B.酸雨的pH:5.6≤pH≤7
C.汽车尾气中含NO
D.工业尾气中的SO2、NO2的应回收利用
10.现有下列物质:①浓硫酸;②浓盐酸;③浓硝酸;④稀盐酸;⑤稀硝酸;⑥稀硫酸,其中在常温时能用铝或铁容器盛放的一组物质是( )。
A.①②③ B.②③⑥ C.④⑤⑥ D.①③
11.(2020·南京师大附中高一上期末)下列关于NO2的制取、净化、收集及尾气处理的装置和原理不能达到实验目的的是( )。
A.制取NO2 B.净化NO2 C.收集NO2 D.尾气处理
12.(2020•福建南平高一上期末)某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是( )。
A.实验过程中气球体积会发生变化
B.广口瓶内中液体的pH减小
C.广口瓶中有化合反应发生
D.试管中不可能发生分解反应
13.(2020·陕西宝鸡高一上期末检测)关于氮的变化关系图如下,则下列说法不正确的是( )。
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
14.(2020·安徽淮北高一上期末)向Fe(OH)2悬浊液中滴入稀硝酸,悬浊液变澄清,对这一反应的叙述不正确的是( )。
A.该反应属于中和反应
B.该反应属于氧化还原反应
C.反应后溶液呈黄色
D.稀硝酸在反应中既表现酸性又表现氧化性
15.(2020·江苏常州高一上期末)铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色。有下列盐:①Fe2(SO4)3;②Na2CO3;③KNO3;④FeSO4;⑤Fe3O4;⑥Fe2O3;⑦HCl,符合条件的组合为( )。
A.①③⑤⑥ B.①③④⑥ C.①③⑤⑦ D.①③④⑦
16.(2020·江苏南京高一上期末)在氧化还原反应中,氧化剂可能全部被还原,也可能部分被还原,下列反应中,氧化剂被还原的比例从高到低的顺序正确的是( )。
①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
②C+4HNO3(浓)CO2↑+4NO2↑+2H2O
③Fe+4HNO3(稀)Fe(NO3)3+NO↑+2H2O
④3Zn+10HNO3(稀)4Zn(NO3)2+N2O↑+5H2O
A.②①③④ B.②④①③ C.④③①② D.③②①④
17.(2020·四川德阳高一上期末)某化学小组设计如下装置探究Cu与稀HNO3反应的产物,下列说法正确的是( )。
A.①中气体为红棕色,证明Cu与稀HNO3反应有NO2生成
B.②的作用是净化①中导出的气体
C.③中气体为红棕色,证明Cu与稀HNO3反应生成NO
D.用NaOH溶液吸收NO,防止污染
18.(2020·雅安高一上期末检测)木炭屑与浓HNO3共热,产生的气体X等分为①和②两份,将两份气体分别按下图实验:
则石灰水的变化可能是( )。
A.①不变浑浊②变乳白色
B.①变为乳白色浑浊②不变浑浊
C.①、②均变为乳白色浑浊
D.①、②都不变浑浊
19.(2021·广东珠海高一上期末)实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图,下列说法不正确的是( )。
A.反应温度如果过高,制得HNO3可能会呈现黄色
B.反应方程式为:NaNO3+H2SO4(浓)NaHSO4+HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈甑不适宜制备沸点过低的物质
20.下列装置应用于实验室制NO并回收硝酸铜的实验,能达到实验目的的是( )。
A.用装置甲制取NO
B.用装置乙收集NO
C.用装置丙分离炭粉和硝酸铜溶液
D.用装置丁蒸干硝酸铜溶液制Cu(NO3)2晶体
21.(2020·浙江宁波高一上期末)1.92g铜与过量的浓硝酸反应,收集到1.344L气体(折算成标准状况),则被还原的硝酸的物质的量是( )。
A.0.05ml B.0.06ml C.0.68ml D.0.12ml
22.(2020·重庆高一上期末检测)将3.2g铜投入到一定物质的量浓度的硝酸溶液中,恰好完全反应,产生的二氧化氮和一氧化氮混合气体的物质的量共0.08ml,原溶液中硝酸的物质的量为( )。
A.0.08ml B.0.18ml C.0.13ml D.0.05ml
23.(2021·北京东城区高一上期末检测)以空气中的氮气为原料制备硝酸,合成线路如下:N2NH3NONO2HNO3(反应条件及部分反应物、生成物已略去)。已知空气中含氮气的体积分数为78%,若用100L(已折算成标准状况下)空气制备硝酸,则理论上可制得硝酸的量的计算式正确的是( )。
A. B.ml
C.2××63g D.2×100×78%L
24.(2020·江苏南京高一上期末)将2.4g Fe、Mg合金投入到足量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V值可为( )。
A.0.986 B.1.12 C.3.36 D.6.72
25.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
(1)写出铜和稀硝酸反应的离子方程式___________________。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体(填“能”或“不能”)______,请简述理由(包括化学方程式)_____________________________________________。实验装置乙能否证明铜和稀硝酸反应的产物是NO气体(填:“能”或“不能”)______,请简述理由__________________________。
26.某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。
(1)请写出铜与稀硝酸反应的化学方程式_____________________。
(2)若证明无色气体是NO的实验操作和现象是__________________________。一氧化氮是大气污染物之一。目前,有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水,该反应的化学方程式为4NH3+6NO=5N2+6H2O,每有10mlN2生成,被还原的氧化剂为______ml。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体为______,将此气体通入水中,发生反应的化学方程式为_______________________________。
试剂
主要现象
原因
浓硝酸
稀硝酸
浓硫酸
稀硫酸
氯水
SO2
相关试卷
这是一份第15讲 氨气和铵盐-新高一化学暑假精品课程(鲁科版2019)(原卷版),共9页。
这是一份第13讲 硫的转化-新高一化学暑假精品课程(鲁科版2019)(原卷版),共10页。
这是一份第12讲 铁的多样性-新高一化学暑假精品课程(鲁科版2019)(原卷版),共9页。









