
上海市敬业中学2024-2025学年高三上学期10月月考化学试题
展开1. 本试卷满分100分,考试时间60分钟。
2. 选择类试题标注“不定项”的试题,每小题有1~2个正确选项; 只有1个正确选项的,多选不给分,有2个正确选项的,漏选一个给一半分,错选不给分; 未特别标注的试题,每小题只有一个正确选项。
相对原子质量:H-1 N-14 0-16 Na-23 S-32 Fe-56
一、硫及其化合物有许多用途,相关物质的物理常数如下表所示,回答下列问题:
1. 硫元素位于元素周期表的
A. s区 B. p区 C. d区 D. f区
2. 基态S原子价层电子轨道表示式是 ,其电子占据最高能级的电子云形状为
3. 基态 Mn原子的价电子构型是
A.3d⁷ B.3d⁷4s² C.3d⁵4s² D.3d⁹
4. 具有下列电子排布式的基态原子中原子半径最大的是
A.1s²2s²p³3s²³p² B.1s²2s²²γ³ C.1s²2s²2p² D.1s²2s²2p³3s²3p⁴
5. 关于 SO₂的说法正确的是 (不定项)
A. 中心原子的杂化类型为sp² B. 电负性: 0
6. 煤中掺入一定量的生石灰,能减少煤燃烧排放的SO₂,体现SO₂具有
A. 漂白性 B. 酸性氧化物的性质 C. 氧化性 D. 还原性
若用含4gNaOH的溶液吸收SO₂气体,理论上最多可以吸收SO₂的体积为 (折算为标况)
7. 根据价层电子对互斥理论,H₂S、SO₂、SO₃的气态分子中,中心原子价层电子对数不同
于其它分子的是 :气态三氧化硫以单分子形式存在,推测
其分子的立体构型为 形; 固体三氧化硫中存在如右图所示的三聚
分子,该分子中S原子的杂化轨道类型为
8. S与O、Se、Te位于同一主族,它们氢化物的沸点如图所示,分析它们氢化物沸点变化的原因是:
9.铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第一电离能 I₁小于锌的第一电离能,而铜的第二电离能 I却大于锌的第二电
1
离能,其主要原因是
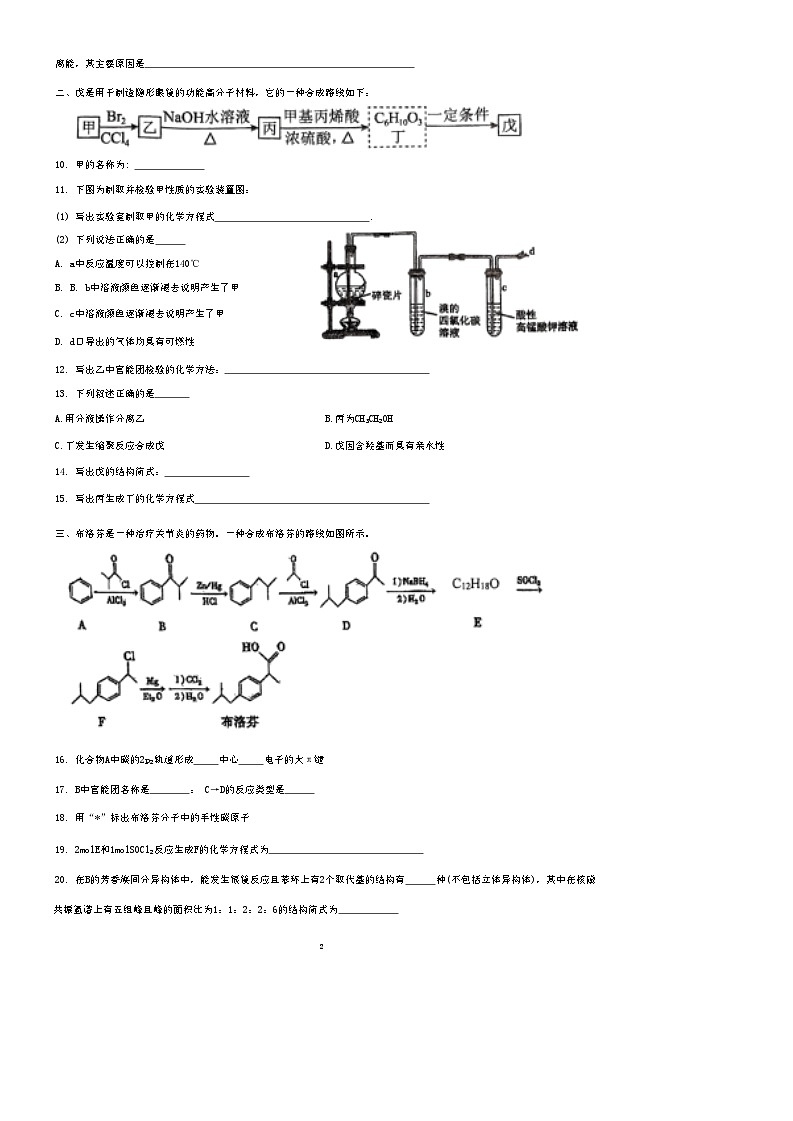
二、戊是用于制造隐形眼镜的功能高分子材料,它的一种合成路线如下:
10. 甲的名称为:
11. 下图为制取并检验甲性质的实验装置图:
(1) 写出实验室制取甲的化学方程式 .
(2) 下列说法正确的是
A. a中反应温度可以控制在140℃
B. B. b中溶液颜色逐渐褪去说明产生了甲
C. c中溶液颜色逐渐褪去说明产生了甲
D. d口导出的气体均具有可燃性
12. 写出乙中官能团检验的化学方法:
13. 下列叙述正确的是
A.用分液操作分离乙 B.丙为CH₃CH₂OH
C.丁发生缩聚反应合成戊 D.戊因含羟基而具有亲水性
14. 写出戊的结构简式:
15. 写出丙生成丁的化学方程式
三、布洛芬是一种治疗关节炎的药物。一种合成布洛芬的路线如图所示。
16. 化合物A中碳的2p₂轨道形成 中心 电子的大π键
17. B中官能团名称是 ; C→D的反应类型是
18. 用“*”标出布洛芬分子中的手性碳原子
19. 2mlE和1mlSOCl₂反应生成F的化学方程式为
20. 在B的芳香族同分异构体中,能发生银镜反应且苯环上有2个取代基的结构有 种(不包括立体异构体),其中在核磁共振氢谱上有五组峰且峰的面积比为1:1:2:2:6的结构简式为
2
21. 参照上述流程,以 O=-<>=O为原料设计合成 HOOC-◯-COOH 的路线:
四、能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。已知:
C(s)+O₂(g)=CO₂(g) △H₁=-393.5kJ·ml⁻¹
H2g+12Ozg=H2OgΔH2=241.8k)ml1
COg+12O2g=CO2gH3−283.0k
22. 煤气化主要反应 Cs+H₂Og=COg+H₂g的ΔH= .
23. 关于上述煤气化的反应: C(s)+H₂O(g)-CO(g)+H;(g), 下列说法正确的是
A.高温下自发 B.低温下自发 C.任意温度下均自发 D.任意温度下均不自发
24. CO₂与CH₄经催化重整, 制得合成气: CHₙg+CO₂g=2COg+2H₂g,
已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH= 。
为了减少CO的排放,某环境研究小组以CO和H₂为原料合成清洁能源二甲醚,反应如下:
4H₂(g)+2CO(g)⇌CH₃OCH₃(g)+H₂O(g) ΔH=-198kJ· ml-¹
25. 如图所示能正确反映平衡常数K 随温度变化关系的曲线为 (填曲线标记字母),
其判断理由是
在一定温度下,向2.0L固定容积的密闭容器中充入 2mlH₂和1mlCO, 经过一段时间后,反应 4Hz(g)+2COg∗CH3OCH,(g)+H2Og达到平衡。反应过程中测得的部分数据见下表:
26. 0~20min 的平均反应速率 v(CO)= ml·L⁻¹min⁻¹
27. 达到平衡时,H₂ 的转化率为
3
28. 在上述温度下,该反应的平衡常数K= (列出计算式即可)
29. 能表明该反应达到平衡状态的是 (不定项)
A. CO的转化率等于 H₂O的产率 B. 混合气体的平均相对分子质量不变
C. v(CO)与 uH₂的比值不变 D. 混合气体的密度不变
五、溶液的酸碱性会影响微粒的存在形式。已知 25°C下列弱酸的电离常数
30. 下列说法中不正确的是 (不定项)
A. 碳酸的酸性强于氢硫酸 B. 多元弱酸的酸性主要由第一步电离决定
C. 醋酸与碳酸钠反应一定生成CO₂ D. 结合H⁺的能力 CN>S²
31. 室温下,物质的量浓度均为 0.1ml⋅L 的四种溶液,其pH由小到大排列的顺序是 。(用序号表示)
a.Na₂CO₃ b. CH₃COONa c. NaCN d.NaHCO₃
32. 向 Na₂S 溶液与HCN能否发生反应 (填“能” “否”) , 若能,写出反应的化学方程式 ,若不能,说明理由
33. 关于 0.1mlLⁱNa₂S溶液中微粒关系正确的是 (不定项)
A. c(OH⁺)>c(HS⁻) B.cH⁺>cHS
C.cOH=cHS+cH⁺2cH₂S D.2cNa'−cHS+cS²⁺+2cH₂S
34. 不能证明 CH₃COOH是弱电解质的方法是
A. 常温下,测得 0.1mlL¹的 CH₃COOHpH>1
B. 常温下, 测得 CH₃COONa 溶液的pH>7
C. 常温下, pH=2的CH₃COOH 溶液加水稀释至100倍后 pH<4
D. 常温下, ⋅L¹的CH₃COOH溶液恰好与 10mL 0.1ml·L⁻¹NaOH 溶液完全反应
35. 室温下, 0.1miL⁻¹NaHCO₃溶液显 性,结合表中数据通过计算加以解释
计算过程:
H₂S
MnS
SO₂
SO₃
H₂SO₄
熔点/℃
-85.5
>1600
(分解)
-75.5
16.8
10.3
沸点/℃
-60.3
-10.0
45.0
337.0
电离能/(kJ.ml⁻ ¹)
I₁
I₂
锌
906
1733
铜
746
1958
化学键
C-H
C=0
H-H
C=O(CO)
键能/kJ·ml⁻¹
413
745
436
1075
时间/ min
0
20
40
80
100
n(H₂)/ ml
2.0
1.4
0.85
0.4
n(CO)/ ml
1.0
0.425
0.2
0.2
n(CH₃OCH₃)/ ml
0
0.15
—
—
0.4
n(H₂O)/ ml
0
0.15
0.2875
0.4
0.4
H₂S
CH₃COOH
H₂CO₃
HCN
Ka₁=9.1×10⁻⁸
Ka₂=1.1×10⁻¹²
Ka=1.8×10⁵
Ka/=4.3×10⁷
Ka₂=5.6×10⁻¹¹
Ka=6.2×10⁻¹⁰
湖南省长沙市雅礼中学2024-2025学年高三上学期月考(二)化学试题: 这是一份湖南省长沙市雅礼中学2024-2025学年高三上学期月考(二)化学试题,共13页。试卷主要包含了2 L 中原子总数为,1 ml⋅L 溶液中,数目为,4 g ,生成物中硫原子数目为等内容,欢迎下载使用。
江苏省扬州中学2024-2025学年高三上学期10月月考化学试题: 这是一份江苏省扬州中学2024-2025学年高三上学期10月月考化学试题,共10页。试卷主要包含了下列说法正确的,下列化学反应表示不正确的是等内容,欢迎下载使用。
上海市建平中学2024-2025学年高三上学期9月月考化学试题: 这是一份上海市建平中学2024-2025学年高三上学期9月月考化学试题,共7页。












