

江苏省连云港市灌南县惠泽高级中学2024-2025学年高二上学期10月月考 化学试题
展开命题人:汤芸 审核人:赵新全
注意事项:
考试时间75分钟,试卷总分100分。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
3.请用2B铅笔和0.5毫米黑色墨水签字笔在答题卡上指定区域内作答。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Zn-65 Fe-56
Zn-65
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意,第1-12题是教材原题或改编题。
1. 采取下列措施对增大化学反应速率有明显效果的是( )。
A. Na与水反应时,增加水的用量
B. Al与稀硫酸反应制取H2 时,改用浓硫酸
C. Na2SO4 溶液与BaCl2 溶液反应时,增大压强
D. 大理石与盐酸反应制取CO2 时,将块状大理石改为粉末状大理石
2. 已知:N2 (g) + 3H2 (g)=2NH3 (g) ΔH=-92.4 kJ/ml。若断裂1 ml H—H、1 ml N—H需要吸收的能量分别为436 kJ、391 kJ,则断裂1 ml 氮氮三键需要吸收的能量为( )。
A. 431.6 kJ B. 945.6 kJ C. 649.4 kJ D. 869.6 kJ
3. 在一定温度下的密闭容器中发生反应:xA(g) + yB(g) ⇌ zC(g),平衡时测得A的浓度为0.50 ml/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30 ml/L。下列有关判断正确的是( )。
A. x + y < z B. 平衡向正反应方向移动 C. B的转化率降低 D. C的体积分数增大
4. 向10 mL氨水中加入蒸馏水,将其稀释到1 L后,下列说法中不正确的是( )。
A. NH3 ·H2 O的电离程度增大 B.c(NH4 +) /c(NH3·H2 O) 增大
C. NH4 +的数目增多 D.溶液中所有离子浓度都减小
5. 下列说法中正确的是( )。
A.在100 ℃时,pH约为 6的纯水呈酸性
B.将1 mL 1×10-6 ml/L盐酸稀释至1 000 mL,所得溶液的pH为9
C.在常温下,当水电离出的c(H+ )为1×10-13 ml/L时,此溶液的pH可能为1或13
D.将pH=2的盐酸和醋酸各1 mL分别稀释至100 mL,所得醋酸的pH略大
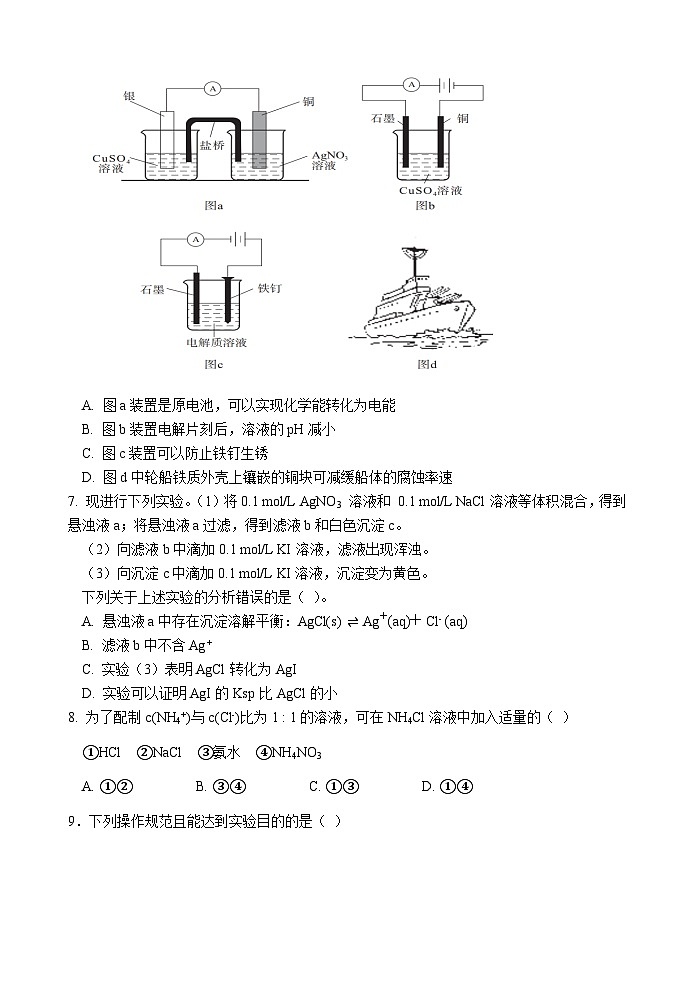
6. 下列有关原电池、电解、电镀和电化学腐蚀的说法中,正确的是( )
A. 图a装置是原电池,可以实现化学能转化为电能
B. 图b装置电解片刻后,溶液的pH减小
C. 图c装置可以防止铁钉生锈
D. 图d中轮船铁质外壳上镶嵌的铜块可减缓船体的腐蚀率速
7. 现进行下列实验。(1)将0.1 ml/L AgNO3 溶液和 0.1 ml/L NaCl溶液等体积混合,得到悬浊液a;将悬浊液a过滤,得到滤液b和白色沉淀c。
(2)向滤液b中滴加0.1 ml/L KI溶液,滤液出现浑浊。
(3)向沉淀c中滴加0.1 ml/L KI溶液,沉淀变为黄色。
下列关于上述实验的分析错误的是( )。
A. 悬浊液a中存在沉淀溶解平衡:AgCl(s) ⇌ Ag+(aq)+ Cl- (aq)
B. 滤液b中不含Ag+
C. 实验(3)表明AgCl转化为AgI
D. 实验可以证明AgI的Ksp比AgCl的小
8. 为了配制c(NH4+)与c(Cl-)比为1 : 1的溶液,可在NH4Cl溶液中加入适量的( )
①HCl ②NaCl ③氨水 ④NH4NO3
A. ①② B. ③④ C. ①③ D. ①④
9.下列操作规范且能达到实验目的的是( )
10. 为了除去MgCl2 酸性溶液中的Fe3+,可在加热并搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量盐酸,这种试剂是( )。
A. NH3·H2O B. NaOH C. Na2CO3 D. MgCO3
11. 在常温下,有关下列4种溶液的叙述中错误的是( )。
A.在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小
B.分别取1 mL稀释至10 mL,四种溶液的pH:①>②>④>③
C.将溶液①、④等体积混合,所得溶液中:c(Cl-)>c(NH4 +)>c(OH-)>c(H+)
D.将a L溶液④与b L溶液②混合后,若所得溶液的pH=4,则a∶b=11∶9
12. 用电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中发生反应: Cr2O72-+ 6Fe2++14H+== 2Cr3++ 6Fe3++ 7H2O,最后Cr3+以Cr(OH)3 形式除去。下列说法中错误的是( )。
A.阳极反应为Fe-2e- =Fe2+
B.电解过程中废水的pH增大
C.电解过程中有Fe(OH)3 沉淀生成
D.电路中每转移6 ml电子,最多有1 ml Cr2O72-被还原
13. 工业以草酸钠和硫酸铜为原料制备纳米铜粉原理如下图所示。时,的,。下列说法正确的是
A. NaHC2O4溶液呈碱性
B. 溶液中:
C. “沉铜”后的滤液中:
D. 在氩气中热分解可防止纳米铜粉被氧化,气体除氩气外还含有等量和气体
第II卷 非选择题
二、非选择题(共4大题,共61 分)
14.教材原题及改编题
Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·ml-1
H2(g)+O2(g)=H2O(g) ΔH2=-241.8kJ·ml-1
CO(g)+O2(g)=CO2(g) ΔH3=-283.0kJ·ml-1
(1)煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=_______。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g) ΔH=-198kJ·ml-1。
(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为_______(填曲线标记字母),其判断理由是_______。
(3)在一定温度下,向2.0L固定容积的密闭容器中充入2ml H2和1ml CO,经过一段时间后,反应4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
①0~20min的平均反应速率v(CO)=_______ml·L−1·min−1。
②达到平衡时,H2的转化率为_______。
③在上述温度下,该反应的平衡常数K=_______。
④能表明该反应达到平衡状态的是_______(填序号)。
A.CO的转化率等于H2O的产率 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
= 3 \* ROMAN III. 在化学分析中,以AgNO3 标准溶液滴定溶液中的Cl-时,采用K2 CrO4 为指示剂,利用Ag+与CrO4 2- 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全(浓度等于1.0×10-5 ml / L)时, 溶液中c(CrO4 2-)=_______ml / L。(已知25 ℃时Ag2CrO4 、AgCl的Ksp分别为2.0×10-12和1.8×10-10。)
IV.甲烷燃料电池用KOH溶液做电解质溶液,写出电池负极的电极反应式: 。
15. 以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4脱硫剂,可用于脱除煤气中的H2S。脱硫剂的制备、硫化、再生过程可表示为
“除杂”包括加足量锌粉、过滤加H2O2氧化等步骤。除Pb2+和Cu2+外,
与锌粉反应的离子还有 (填化学式)。
(2)“调配比”前,需测定ZnSO4溶液的浓度。准确量取2.50mL除去Fe3+的ZnSO4溶液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,滴加氨水调节溶液pH=10,用0.0150ml·L-1EDTA(Na2H2Y)溶液滴定至终点(滴定反应为Zn2++Y4-=ZnY2-),平行滴定3次,平均消耗EDTA溶液25.00mL。计算ZnSO4溶液的物质的量浓度_________________ (写出计算过程)。
(3)400℃时,将一定比例H2、CO、CO2和H2S的混合气体通过装有ZnFe2O4脱硫剂的硫化反应器。
①硫化过程中ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为___。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,反应前后ZnS的质量不变,该反应过程可描述为 。
将硫化后的固体在N2:O2=95:5(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是___。
16.(15分)实验室以二氧化铈()废渣为原料制备含量少的,其部分实验过程如下:
(1)“酸浸”时与反应生成并放出,该反应的离子方程式为____________。
(2)约为7的溶液与溶液反应可生成沉淀,该沉淀中含量与加料方式有关。得到含量较少的的加料方式为____________(填序号)。
A.将溶液滴加到溶液中 B.将溶液滴加到溶液中
(3)通过中和、萃取、反萃取、沉淀等过程,可制备含量少的。已知能被有机萃取剂(简称)萃取,其萃取原理可表示为
(水层)(有机层)(有机层)+(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是____________。
②反萃取的目的是将有机层转移到水层。使尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有____________(填两项)。
③与“反萃取”得到的水溶液比较,滤过沉淀的滤液中,物质的量减小的离子有____________(填化学式)。
(4)实验中需要测定溶液中的含量。已知水溶液中可用准确浓度的溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为。请补充完整实验方案:①准确量取溶液[约为],加氧化剂将完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到容量瓶中后定容;②按规定操作分别将和待测溶液装入如图所示的滴定管中:③____________。
17. 资源利用和环境保护是人类社会可持续发展的基础。
(1)选择性催化还原(SCR)技术是目前应用最广泛的降低内燃机排放技术,原理如图所示:
①尿素SCR技术(路径a)。
已知在中发生尿素的热解与水解:
尿素受热分解:(异氰酸);
异氩酸水解:。
在发动机低负荷或低速空载时,柴油机排气的温度只有150℃或者更低,可造成的问题是___________。
②固态铵SCR(路径b)技术在机外加热铵盐产生氨气。在S中发生的反应为,每生成时,反应转移的电子数为___________。
(2)在贵金属催化剂表面进行CO还原NO也是去除氮氧化物的方法之一,反应机理如图所示。
①生成的总反应为___________。
②图中虚线框内还原转化为反应机理可描述为___________。
(3)为减少排放,促进碳中和,在化工生产中,常用溶液捕捉烟气中的,过程如图所示。
①“热解”的化学反应方程式为___________。
②捕捉时常使用溶液吸收,而不使用更廉价的或溶液,结合下表数据,试从资源综合利用或物质性质及转化的角度分析原因___________。
编号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
时间/min
0
20
40
80
100
n(H2)/ml
2.0
1.4
0.85
0.4
—
n(CO)/ml
1.0
—
0.425
0.2
0.2
n(CH3OCH3)/ml
0
0.15
—
—
0.4
n(H2O)/ml
0
0.15
0.2875
0.4
0.4
试剂
K2CO3
NaOH
Na2CO3
价格(元/吨)
5700
2000
1400
常温下溶解度(g)
110
53
22
江苏省连云港市灌南县惠泽高级中学2024-2025学年高一上学期10月月考化学试题: 这是一份江苏省连云港市灌南县惠泽高级中学2024-2025学年高一上学期10月月考化学试题,共6页。试卷主要包含了中华文化中蕴含着丰富的化学知识,下列有关物质的分类正确的是,下列化学反应属于区域3的是, 下列化学用语正确的是等内容,欢迎下载使用。
江苏省连云港市灌南县惠泽高级中学2024-2025学年高三上学期10月月考化学试题: 这是一份江苏省连云港市灌南县惠泽高级中学2024-2025学年高三上学期10月月考化学试题,共9页。试卷主要包含了请用2B铅笔和0, 下列含氯物质转化正确的是,65 g,MnO2电极生成了0等内容,欢迎下载使用。
江苏省连云港市灌南惠泽高级中学2023-2024学年高一下学期第一次月考化学试题(含答案): 这是一份江苏省连云港市灌南惠泽高级中学2023-2024学年高一下学期第一次月考化学试题(含答案),文件包含高一月考化学试卷docx、高一月考化学答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。












