





黑龙江省哈尔滨师范大学附属中学2024-2025学年高三上学期10月月考化学
展开选项 实验目的 方案设计和现象 结论
化学试题
C. “雷蟠电掣云滔滔,夜半载雨输亭皋”,雷雨天可实现氮的固定
7. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W 为原子序数依次增大的短周期主族
B. 甲烷分子和四氯化碳分子的空间填充模型均为:
元素,基态 W 原子的 s 和 p 能级电子数之比为 2∶3。下列说法错误的是
D. CH3OH 分子中,碳原子与氧原子之间的共价键:sp3 p 键
C. 简单离子半径:Y>Z D. 该锂盐的熔点高于 LiCl
3. 下列离子方程式书写正确的是( )
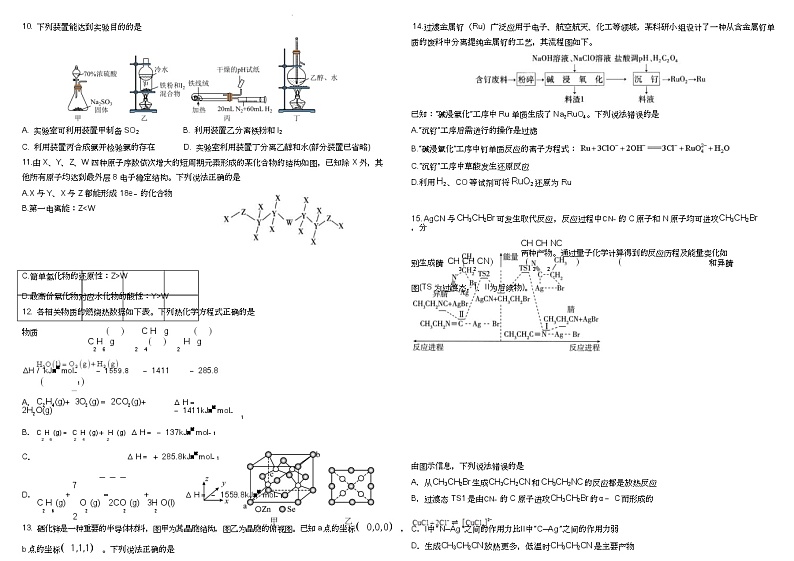
8. 1-溴丁烷是密度比水大、难溶于水的无色液体,常用作有机合成的烷基化试剂。将浓硫酸、NaBr 固
A.工业上生产漂白粉的原理:Cl2+2OH-=Cl-+ClO-+H2O
体、1-丁醇混合加热回流后,再经洗涤→干燥→蒸馏获得纯品。实验中涉及如下装置(部分夹持和加热装
B.氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH-+Ca2++HCO3-=CaCO3↓+H2O
置省略):
C.用氨水吸收烟气中少量的 SO2: NH3·H2O + SO2 = NH4++ HSO3-
下列说法错误的是
D.已知次磷酸钠(NaH2PO2)属于正盐,向次磷酸( H3PO2 为弱酸)溶液中加入足量 NaOH 溶液:
A.图中所示两处冷凝管中冷凝水方向均为从 a 口进 b 口出
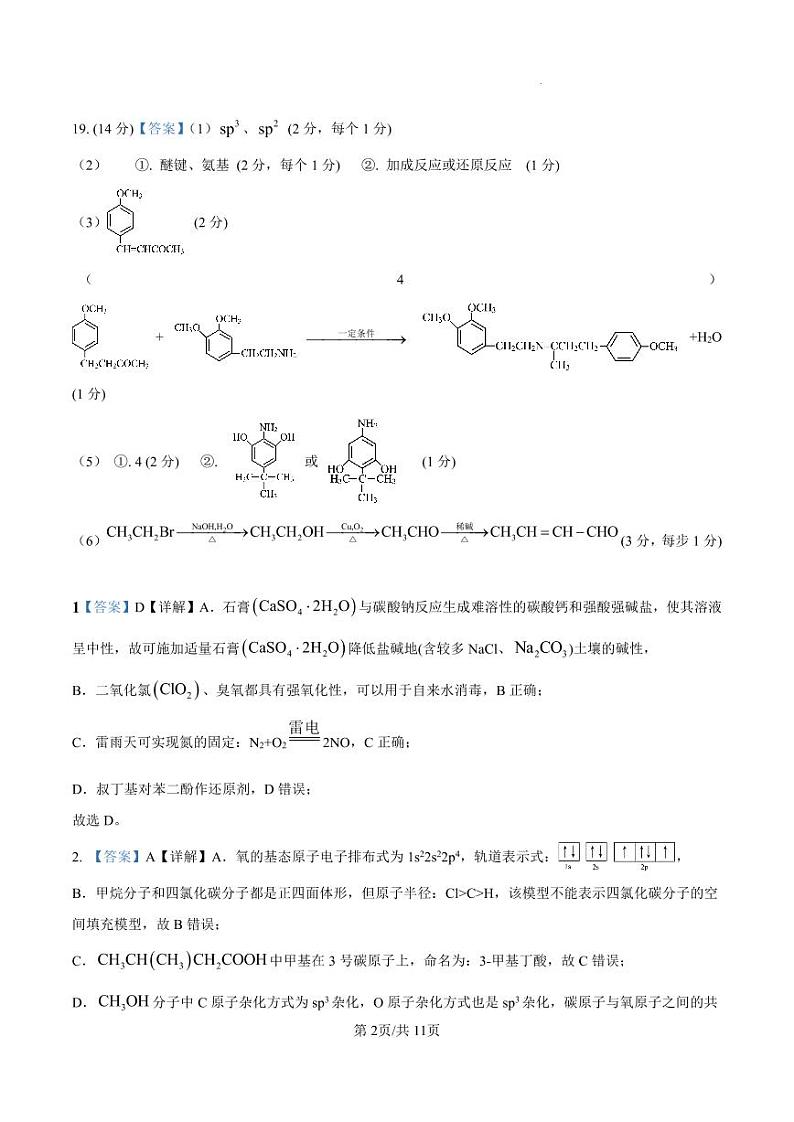
H3PO2 +3OH-=PO2-+3H2O
B.气体吸收装置的作用是吸收 HBr 等有毒气体
4. NA 为阿伏加德罗常数的值.下列叙述正确的是
C.浓硫酸的作用是作反应物、吸水剂等
A. 1ml 金刚石中 C-C 键的数目为 4NA
D.洗涤时,经“水洗→碱洗( Na2CO3 溶液)→水洗”可除去大部分杂质
C. 常温下,1L pH=9 的CH3COONa 溶液中,发生电离的水分子数为 1×10-9NA
D. 含0.1mlH3PO4 的溶液中含有的氧原子数为 0.4NA
5. 某有机物 M 的结构如图所示。下列有关 M 的说法错误的是
A. 能使酸性高锰酸钾溶液褪色 B. 1mlM 能与 5mlH2发生加成反应 A.a 的分子式C16H16O8 B.a 生成 b 的反应属于加聚反应
C. 所有原子不可能在同一平面 D. 与金属钠、NaOH 溶液均能反应
}
司可能用到的相对原子质量:C-12 O-16 Mn-55
一、选择题:本题共 15 小题,每小题 3 分,共 45 分。在每小题给出的 4 个选项中,只有一项符合题目
A 判断 AlCl3 的化学键类型
AlCl 固体溶于水,进行导电性实验,AlCl
将
3 3
溶液可导电
AlCl 中含
3
有离子键
要求。
1. 化学与生产、生活密切相关,下列说法不正确的是
A. 可施加适量石膏CaSO 2H O降低盐碱地(含较多 NaCl、 Na CO )土壤的碱性
4 2 2 3
B
验证某固体是
NaHCO
3
Na CO 还是
2 3
室温下取少量固体于试管中,插入温度计,加几
滴水,温度降低
该固体是
NaHCO
3
B. 二氧化氯ClO 、臭氧可以用于自来水消毒
2
C 探究乙炔的化学性质
将饱和食盐水滴入电石中,产生的气体通入溴的
四氯化碳溶液中,溶液褪色
乙炔具有
还原性
D. 市售食用油中加入微量叔丁基对苯二酚作氧化剂,以确保食品安全
2. 下列化学用语表达正确的是
A. 氧的基态原子的轨道表示式:
D
MgSO 溶液和
比较
4
CuSO 溶液的酸碱性
4
MgSO 溶液和
用洁净干燥的玻璃棒分别蘸取
比较,测得
4
CuSO 溶液,滴在 pH 试纸上,与标准比色卡
4
CuSO 溶液对应的 pH 更小
4
CuSO 溶
4
液的酸性
更强
C. CH CHCH CH COOH的名称:2-甲基丁酸
3 3 2
A. 电负性:Y>X B. 第一电离能:Z>W
B. 1mlNa2O2 与足量水反应,转移电子数为 NA
9. 高分子的循环利用过程如下图所示。下列说法错误的是(不考虑立体异构)
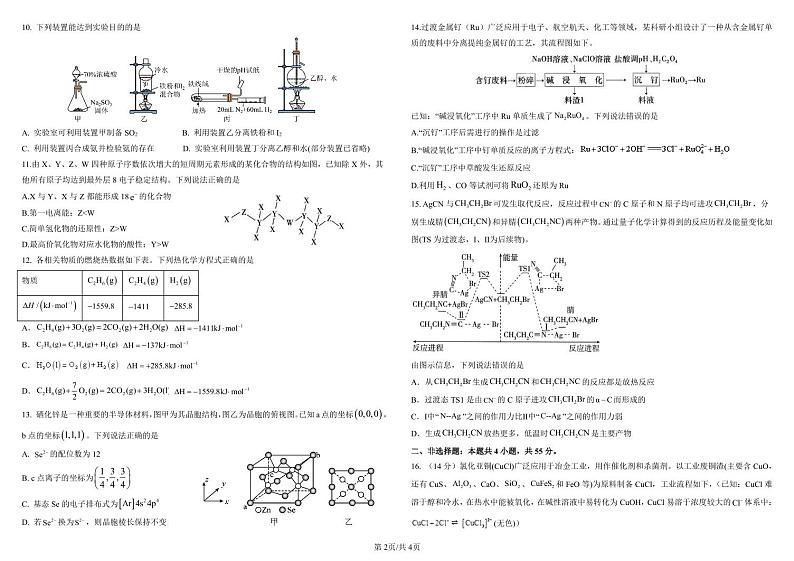
10. 下列装置能达到实验目的的是 14.过渡金属钌(Ru)广泛应用于电子、航空航天、化工等领域,某科研小组设计了一种从含金属钌单
质的废料中分离提纯金属钌的工艺,其流程图如下。
已知:“碱浸氧化”工序中 Ru 单质生成了 Na2RuO4 。下列说法错误的是
A. 实验室可利用装置甲制备 SO2 B. 利用装置乙分离铁粉和 I2 A.“沉钌”工序后需进行的操作是过滤
C. 利用装置丙合成氨并检验氨的存在 D. 实验室利用装置丁分离乙醇和水(部分装置已省略)
B.“碱浸氧化”工序中钉单质反应的离子方程式:
11.由 X、Y、Z、W 四种原子序数依次增大的短周期元素形成的某化合物的结构如图,已知除 X 外,其
C.“沉钌”工序中草酸发生还原反应
图(TS 为过渡态,Ⅰ、Ⅱ为后续物)。
D.最高价氧化物对应水化物的酸性:Y>W
12. 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是
物质 C H g
C H g H g
2 6 2 4 2
ΔH / kJml 1559.8 1411 285.8
1
B.C H (g) C H (g) H (g) H 137kJml1
2 6 2 4 2
C. H 285.8kJml1
由图示信息,下列说法错误的是
二、非选择题:本题共 4 小题,共 55 分。
A. Se2 的配位数为 12
D. 若Se2 换为S2 ,则晶胞棱长保持不变
}
司他所有原子均达到最外层 8 电子稳定结构。下列说法正确的是
D.利用 H2 、CO 等试剂可将 RuO2 还原为 Ru
A.X 与 Y、X 与 Z 都能形成 18e 的化合物
B.第一电离能:Z
CH CH NC 两种产物。通过量子化学计算得到的反应历程及能量变化如
别生成腈 CH CH CN 和异腈
3 2 3 2
C.简单氢化物的还原性:Z>W
A.C2H4 (g)3O2 (g) 2CO2 (g) 2H2O(g)
H 1411kJml
1
7
D. H 1559.8kJ ml1
C H (g) O (g) 2CO (g) 3H O(l)
2 6 2 2 2
2
A.从CH3CH2Br 生成CH3CH2CN 和CH3CH2NC 的反应都是放热反应
B.过渡态 TS1 是由CN 的 C 原子进攻CH3CH2Br 的α C而形成的
13. 硒化锌是一种重要的半导体材料,图甲为其晶胞结构,图乙为晶胞的俯视图。已知 a 点的坐标0, 0, 0,
C.Ⅰ中“ N--Ag ”之间的作用力比Ⅱ中“ C--Ag ”之间的作用力弱
b 点的坐标1, 1, 1。下列说法正确的是
D.生成CH3CH2CN 放热更多,低温时CH3CH2CN 是主要产物
1 3 3
, ,
B. c 点离子的坐标为
4 4 4
16. (14 分)氯化亚铜(CuCl)广泛应用于冶金工业,用作催化剂和杀菌剂。以工业废铜渣(主要含 CuO,
还有 CuS、 Al2O3 、CaO、SiO2 、CuFeS2 和 FeO 等)为原料制备 CuCl,工业流程如下,(已知:CuCl 难
C. 基态 Se 的电子排布式为 2 4
Ar 4s 4p
溶于醇和冷水,在热水中能被氧化,在碱性溶液中易转化为 CuOH,CuCl 易溶于浓度较大的Cl 体系中:
废料制备高纯 MnCO 和回收含铁化合物的工业流程如图:
3
回答下列问题:
(2)除杂后对滤液进行加热的目的是______________________________________________________。
B.本流程还可以得到一种常用作化肥的副产物
(1)“滤渣Ⅱ”的主要成分为 (填化学式)。
C.为了加快浸取速率,可以采取的措施:粉碎废渣、搅拌,高温等
(2)“还原”过程中发生的主要氧化还原反应的离子方程式为___________________________________、
D.“系列操作”可能是抽滤、依次用温度较低的SO2 水溶液与无水乙醇洗涤沉淀、真空干燥
__________________________________________________。
(4)CuSO4 参与反应的离子方程式为 ___________ __________ 。 (3)“氧化”时需要少量、多次加入 H2O2 ,其目的是___________________________________。
A. MnO2 B.CuO C. NH3 H2O D.FeO
低的原因是______________________________________________________。
(5)常温下,若“调 pH ”后所得溶液中 2+ 1
c Mn =0.2mlL 、
c Mg2+ 0.05mlL1 ,则所调pH 的范围为
_____________________。
(6)“沉锰”时发生反应的离子方程式为 _____________________ 。
(7) 若使用 100 kg 含 87% MnO2 的矿渣废料,最终获得 101.2 kg MnCO3,则 MnCO3 产率为 。
温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
致变色材料,在温度传感器、变色涂料等领域应用广泛。
(1)某化学小组用 Cr2O3 和 CCl4 在高温下制备无水三氯化铬,部分实验装置如图所示,其中三颈烧瓶
CCl ,其沸点为 76.8℃。 内装有
4
①A 中氢原子与其它原子之间存在的作用力类型有
②已知:当 Cu(II)配合物 A 和 B 配位构型由八面体转变为四方平面时,配合物颜色会发生变化,现要实
现这一变化,需要进行的简单操作为 。
}
司17. (13 分)某工业矿渣废料的主要成分为SiO2 、 MnO2 和
Fe O ,还含有少量 CaO 和 MgO 。利用该矿渣
2 3
(1)滤渣 1 含有淡黄色固体,此外还含______________________________。
已知:i.当微粒浓度低于105 mlL1 时,认为溶液中不存在该微粒;
ii.常温下;部分难溶物的溶度积常数如表:
(3)关于该工艺流程,下列说法正确的是___________(填字母)。
难溶物
Fe(OH)
3
Fe(OH)
2
Mn(OH)
2
Mg(OH)
2
A.把 CuO 改为 ZnO 也能达到除杂的目的
K 11038
sp
回答下列问题:
11016 21013 51012
(5)流程中 Cu+的沉淀率与加入的
NH Cl的量关系如图所示,随着加入的
4
NH Cl的增多,Cu+的沉淀率降
4
(4)“调 pH ”时可选择的试剂为_______(填字母)。
(6)如下图所示,Cu(II)配合物 A 和 B 可发生配位构型的转变,该转变可带来颜色的变化,因此可用作热
18. (14 分)三氯化铬( CrCl3 )为紫色单斜晶体,熔点为 83℃,易潮解,易升华,溶于水但不易水解,高
作用是_____________________。
③装置 C 的水槽中应盛有_______(填“冰水”或“沸水”)。
④装置 B 中还会生成光气( COCl2 ),B 中反应的化学方程式为___________________________________。
(2) CrCl3 的工业制法:先用 40%的 NaOH 将红矾钠( Na2Cr2O7 )转化为铬酸钠( Na2CrO4 ),加入过
CrCl 的离子方程式_____________________________________________________________。 为
3
(3)为进一步探究 CrCl3 的性质,某同学取试管若干支,分别加入 10 滴0.1ml / LCrCl3 溶液,并用 4
反应现象记录于表中。
已知:①
1 紫红色 蓝绿色溶液
回答下列问题:
(5)同时符合下列条件的 D 的同分异构体有___________种(不包括立体异构体),其中核磁共振氢谱的
24~25 紫红色 紫红色溶液,有较多的棕褐色沉淀
峰面积之比为 9:2:2:2 的结构简式为___________(任写一种)。
①温度对反应的影响。
①可以与氯化铁溶液发生显色反应; ②不含氮氧键; ③只有 4 种不同化学环境的氢原子。
子的橙色被
MnO 离子的紫红色掩盖,另一种可能的原因是___________________________,所以必须
-
4
将反应液加热至沸腾 4~5min 后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
②CrCl 与 KMnO 的用量对反应的影响。
3 4
对表中数据进行分析,在上述反应条件下,欲将 Cr3 氧化为 Cr2O72- ,CrCl 与 KMnO 最佳用量比为
3 4
Δ
_______________。这与由反应10Cr +6MnO +11H O Cr O +6Mn +22H 所推断得到的用量比不符,
3+ - 2- 2+ +
4 2 2 7
你推测的原因是______________________________。
}
司②实验前先往装置 A 中通入 N2 ,其目的是排尽装置中的空气,在实验过程中还需要持续通入 N2 ,其
19. (14 分)化合物 F 是合成盐酸多巴酚丁胺的中间体,其合成路线如下:
CH OH ,再加入 10%HCl 溶液,可以看到有气泡产生。写出用 CH OH将铬酸钠(
量
3 3
Na CrO )还原
2 4
2ml / LH SO 酸化,再分别加入不同滴数的 0.1ml/L
滴
2 4
KMnO 溶液,并在不同的温度下进行实验,
4
KMnO 的用量(滴
4
在不同温度下的反应现象
数)
25℃ 90-100℃
② ( R1 、 R2 、 R3 、 R4 均为烃基)
2~9 紫红色 黄绿色溶液,且随 KMnO4 滴数增加,黄色成分增多
(1)A 中 C 原子的杂化方式为___________。
10 紫红色 澄清的橙黄色溶液
(2)D 中的官能团名称为___________,B→C 的反应类型为___________。
(3)B 的结构简式为___________。
11~23 紫红色 橙黄色溶液,有棕褐色沉淀,且随 KMnO4 滴数增加,沉淀增多
(4)C+D→E 的化学方程式为________________________________。
CrCl 与
3
KMnO 在常温下反应,观察不到 Cr O2 离子的橙色,甲同学认为其中一个原因是 Cr O2 离
4 2 7 2 7
(6)参照上述流程,设计以 CH3CH2Br 为原料合成CH3CHCHCHO的流程图:______(无机试剂、
黑龙江省哈尔滨师范大学附属中学2024-2025学年高一上学期开学测试化学试卷: 这是一份黑龙江省哈尔滨师范大学附属中学2024-2025学年高一上学期开学测试化学试卷,文件包含黑龙江省哈尔滨市师大附中2024级高一上学期开学测试化学试卷pdf、黑龙江省哈尔滨市师大附中2024级高一上学期开学测试化学试卷答题卡pdf等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学: 这是一份黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学,共11页。
黑龙江省 哈尔滨师范大学附属中学2023-2024学年高三上学期第二次调研化学试题(月考): 这是一份黑龙江省 哈尔滨师范大学附属中学2023-2024学年高三上学期第二次调研化学试题(月考),共6页。












