

天津市静海区第一中学2024-2025学年高二上学期10月月考化学试题(Word版附答案)
展开命题人:王玉清 审题人:杜书梅
考生注意:
本试卷分第Ⅰ卷基础题(80分)和第Ⅱ卷提高题(17分)两部分,3分卷面分,满分共100分。
第Ⅰ卷 基础题(共80分)
一、选择题: 每小题3分,共36分。
1.我国提出争取在2030年前实现碳达峰,2060年实现碳中和,这对于改善环境,实现绿色发展至关重要。下列措施中叙述不正确的是
A. 减少生活燃煤,鼓励农村燃烧柴草做饭
B. 推动新能源汽车的开发和充电桩基础设施的安装
C. 加大资源的重复使用、发展资源的循环再生技术
D. 开发太阳能、风能、地热能等新能源,减少使用煤、石油等化石燃料
2.下列说法正确的是
A.ΔH值的大小与热化学反应方程式中计量数无关
B..S(s)+O2(g)===SO2(g) △H1; S(g)+O2(g)===SO2(g) △H2 则△H1>△H2
C.若2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1478 kJ/ml,则CH3OH(l)
的燃烧热为739 kJ/ml
D.已知H+ (aq) +OH-(aq) === H2O (l) △H = -57. 3 kJ/ml,则20.0g NaOH固体与稀盐酸完全中和,放出28.65 kJ的热量
3.S(单斜)和S(正交)是硫的两种同素异形体。已知:
① S(单斜,s)+O2(g) ===SO2(g) △H1=-297.16 kJ·ml-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·ml-1
③ S(单斜,s) ===S(正交,s) △H3
下列说法正确的是
A.单斜硫转化为正交硫的过程是物理变化
B.S(单斜,s)=== S(正交,s) △H3>0,单斜硫比正交硫稳定
C.S(单斜,s)=== S(正交,s) △H3<0,正交硫比单斜硫稳定
D.等质量的单斜硫和正交硫分别在氧气中充分燃烧,后者放热多
4.在2A(g)﹢B(g)2C(g)﹢D(g)反应中,表示该反应速率最快的是
A.v(A) =0.8ml·L-1·s-1 B.v(B)=0.3ml·L-1·s-1
C.v (C)=1.6ml·L-1·min-1 D.v(D)=0.5ml·L-1·s-1
5.T℃,在容积不变的密闭容器中进行可逆反应:SiF4(g) + 2H2O(g) SiO2(s) + 4HF(g),下列能表明该反应已达到化学平衡状态的是
① v正(SiF4) = 4v逆(HF) ② HF体积分数不再变化 ③ 容器内气体压强不再变化
④ 混合气体的密度保持不变 ⑤ 2ml O-H键断裂的同时,有2ml H-F键断裂
A. ①②③ B. ②③④ C. ②③④⑤ D. ③④⑤
6.某温度下,恒容密闭容器内发生反应:H2(g)+I2(g) 2HI(g) △H>0,该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01ml/L、0.01ml/L、0.02ml/L。一段时间后,下列情况与事实相符的是
A. 混合气体颜色变深 B. 混合气体密度变大
C. 容器内压强变小 D. 氢气的体积分数变小
7.对已经建立化学平衡的某可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述一定正确的是
A.平衡移动过程中,v正一定大于v逆 B.反应物的转化率一定增大
C.化学平衡常数一定增大 D.再次建立平衡时,生成物的浓度一定增加
8.下列事实中不能用勒夏特列原理解释的是
A.合成氨时增大压强,有利于提高氨气的产率
B.实验室保存FeSO4溶液时,加入铁粉以防止氧化
C.向新制氯水中滴入几滴NaHCO3溶液,可增强溶液的漂白能力
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
9.在一定温度下,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。改变起始时n(SO2)对反应的影响如图所示。下列说法正确的是( )
A.SO2的起始量越大,混合气体中SO3的体积分数越大
B.a、b、c三点中,a点时SO2的转化率最高
C.a、b、c三点的平衡常数:Kb>Kc>Ka
D.b、c点均为化学平衡点,a点未达到平衡且反应正向进行
10.已知:A(g)+2B(g) 3C(g) ΔH<0,向一恒容的密闭容器中充入1 ml A和3 ml B发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如右图所示。下列说法正确的是
A.容器内压强不变时,表明反应达到平衡状态
B.t2时改变的条件:升高温度
C.t2时改变的条件:向容器中充入C
D.平衡常数K:K(Ⅱ)<K(I)
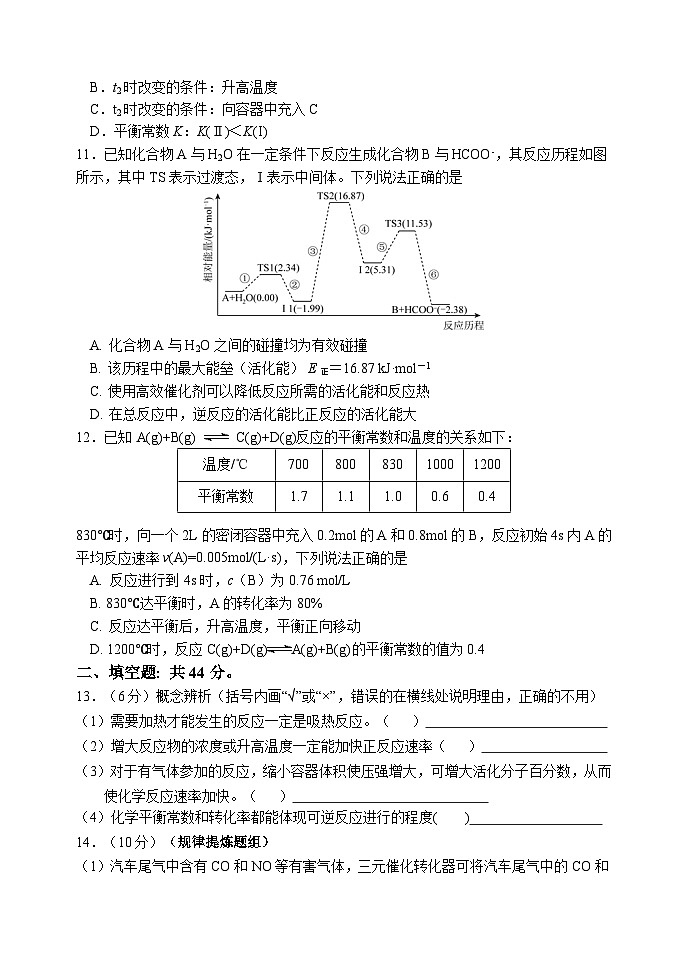
11.已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是
A. 化合物A与H2O之间的碰撞均为有效碰撞
B. 该历程中的最大能垒(活化能) E正=16.87 kJ·ml-1
C. 使用高效催化剂可以降低反应所需的活化能和反应热
D. 在总反应中,逆反应的活化能比正反应的活化能大
12.已知 A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
830℃时,向一个2L的密闭容器中充入0.2ml的A和0.8ml的B,反应初始4s内A的平均反应速率v(A)=0.005ml/(L·s),下列说法正确的是
A. 反应进行到4s时,c(B)为0.76 ml/L
B. 830℃达平衡时,A的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时,反应C(g)+D(g)A(g)+B(g)的平衡常数的值为0.4
二、填空题: 共44分。
13.(6分)概念辨析(括号内画“√”或“×”,错误的在横线处说明理由,正确的不用)
(1)需要加热才能发生的反应一定是吸热反应。( )
(2)增大反应物的浓度或升高温度一定能加快正反应速率( )
(3)对于有气体参加的反应,缩小容器体积使压强增大,可增大活化分子百分数,从而使化学反应速率加快。( )
(4)化学平衡常数和转化率都能体现可逆反应进行的程度( )
14.(10分)(规律提炼题组)
(1)汽车尾气中含有CO和NO等有害气体,三元催化转化器可将汽车尾气中的CO和NO转化为CO2和N2,每生成14gN2,反应放出373kJ热量,该反应的热化学方程式为______________________________________________________。
(2)甲醇蒸气转化为氢气的反应原理是:
①CH3OH(g)+H2O(g) === CO2(g)+3H2(g) ΔH=+49.0 kJ·ml-1
②CH3OH(g)+1/2O2(g) === CO2(g)+2H2(g) ΔH=-192.9 kJ·ml-1
则甲醇蒸气完全燃烧生成水蒸气的热化学方程式________________________________。
(3)已知:碳的燃烧热 ΔH1= x kJ∙ml−1
S(s)+2K(s)=K2S(s) ΔH2= y kJ∙ml−1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3= z kJ∙ml−1
则黑火药爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s) === K2S(s)+N2(g)+3CO2(g) ΔH=_____________ kJ∙ml−1(用含x、y、z的代数式表示)
(4)P4(白磷)和P4O6 的分子结构如图所示:
其所含化学键的键能见下表:[键能是指形成或拆开1ml化学键时所释放或吸收的能量]
则白磷与氧气反应的热化学方程式:P4(白磷,s)+3O2(g) === P4O6(s) ΔH=______ kJ/ml
【学法题】请结合本题归纳计算反应热的常用方法
。(写出两点即可)
15.(5分)(易混易错题组)
(1)物质变化通常伴随着能量变化,下列变化过程属于放热反应的是 (填序号)
①稀释浓硫酸 ②干冰升华 ③高温煅烧石灰石 ④氢氧化钡晶体与氯化铵混合 ⑤H2在Cl2中燃烧 ⑥酸碱中和反应 ⑦Al在高温条件下与Fe2O3 的反应 = 8 \* GB3 \* MERGEFORMAT ⑧NaHCO3与盐酸反应
(2)在恒容条件下,发生反应NO2(g)+CO(g) CO2(g)+NO(g) ΔH<0,改变下列条件,能使该反应的正反应速率加快且活化分子百分数增加的是_____________。(填字母)
a. 增大反应物浓度 b. 选择高效催化剂 c. 增大体系压强
d. 升高体系温度 e. 增大固体反应物的接触面积
(10分)(方法归纳题组) 现有可逆反应mA(s)+nB(g) pC(g) ΔH<0,在一定条件下的密闭容器中,充入m mlA和n mlB,达到化学平衡状态。则
(1)升高温度,反应速率变化为:正反应速率________(填“增大”、“减小”或“不变”,下同),逆反应速率________;平衡________移动(填“正向”、“逆向”或“不”)。
(2)保持温度不变,加入A,则B的转化率________。(填“增大”、“减小”或“不变”)
(3)恒温下,若将容器体积增大为原来的2倍,再达到平衡时C的浓度变为原来的60%,则可判断该反应的化学计量数应具有的关系为__________________;若保持温度和容器体积不变,再向容器中加入B,则平衡_________移动(填“正向”、“逆向”或“不”),再次达到平衡时B的转化率__________(填“增大”、“减小”或“不变”,下同);若保持温度和压强不变,加入He,重新达到平衡时B的转化率___________。
【学法题】通过对该题的解答,说明平衡移动方向和反应物转化率的关系(任写一点)
(13分)Ⅰ.用如图所示的装置测定中和反应反应热。
实验药品:100mL0.50ml/L盐酸、50mL0.55ml/LNaOH溶液、50mL0.55ml/L氨水。
已知:弱碱电离时吸热。回答下列问题。
仪器a的名称是_________________。
(2)装置中隔热层的作用是__________________________。
(3)将浓度为0.50ml/L的酸溶液和0.55ml/L的碱溶液各50mL混合(溶液密度均近似为1g/mL),生成的溶液的比热容c=4.18J/(g·℃),测得温度如下:
①两组实验结果存在差异的原因是_________________________________________。
② HCl(aq)+NH3·H2O(aq)=== NH4Cl(aq)+H2O(l)的△H=__________kJ∙ml−1(保留一位小数)
③某同学利用上述装置做甲组实验,测得反应热△H比理论值偏大,可能的原因是______
A. 实验装置保温、隔热效果差 B.做该实验时室温较高
C. 用温度计测完盐酸的温度直接测NaOH溶液温度 D.NaOH溶液一次性迅速倒入
Ⅱ.利用硫代硫酸钠与稀硫酸反应探究影响化学反应速率的因素,设计了下表系列实验:
已知:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。
实验________(填序号)可探究温度对反应速率的影响。若用实验①③探究稀硫酸浓度对该反应速率的影响,则:V=_______mL,t1________t3(填“>”“<”或“=”)。
第Ⅱ卷 提高题(共20分)
18.(8分)已知制备甲醇的有关化学反应及平衡常数如表所示:
(1)则反应△H3=_______;K2=_______(填数值)。
(2)850℃时,在密闭容器中进行反应①,开始时只加入CO2、H2,反应10后测得各组分的浓度如表:
①该时间段内反应速率υ(H2)=______________________。
②比较此时正逆反应速率的大小υ正_______ υ逆(填“>““<”或“=”)。
19.(9分)已知:H2S分解的反应为2H2S(g) 2H2(g)+S2(g) ΔH。向体积为1L的恒容密闭容器中加入n(H2S)+ n(Ar)= 0.1ml的混合气体(Ar不参与反应),测得不同温度(T1>T2)时H2S的平衡转化率随n(H2S)与n(Ar)比值的变化如图所示。
请回答下列问题:
(1)该反应的△H 0(填“>”“<”或“=”)
试比较:
①X、Y、Z三点的化学反应速率从大到小的顺序: ;
②X、Y、Z三点的化学平衡常数从大到小的顺序: 。
(3)恒温条件下,保持容器体积不变,且维持n(H2S)+n(Ar)=0.1ml,增加稀有气体Ar的充入量,H2S的平衡转化率将 (填“增大”、“减小”或“不变”)
(4)T1温度下,当,到达平衡时,容器中H2 的体积分数为 。
20.卷面分:(3分)
静海一中2024-2025第一学期高二化学(10月)
学生学业能力调研试卷答题纸
第Ⅰ卷 基础题(共80分)
一、选择题: 每小题3分,共36分.
二、填空题:
13.(6分)(1)( )
(2)( )
(3)( )
(4)( )
14.(10分)
(1)
(2)
(3) (4)
【学法题】
15.(5分)(1) (2)
16.(10分)
(1)
(2)
(3)
【学法题】
II、(1) , ____________。
(2) 。
17.(13分)
Ⅰ、(1) (2)
(3) ① 。
② kJ∙ml−1 ③
II、
18.(8分)
(1) __________________ _________________(填数值)
(2)① ②
19.(9分)
(1)_______________
(2)① ; ② 。
(3) (4)
20.卷面分:(3分)
静海一中2024-2025第一学期高二化学(10月)
参考答案
一、选择题: 每小题3分,共36分。
1.A 2.B 3.C 4.D 5.C 6.D 7.A 8.B 9.D 10.C 11.D 12.B
二、填空题:(共44分)
13. (每空1分,共6分)
(1)(×)需要加热的反应也可能是放热反应,如:铝热反应。
(2)(√)
(3)(×)增大压强可增大单位体积内活化分子的数目,但活化分子百分数不变
(4)(√) (理由合理即可给分)
14.(每空2分,共10分)
(1) △H=-746 kJ·ml-1
(2) CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-676.7 kJ·ml-1(2分)
(3)3x+y﹣z (4)6a+3d-12c 学法题:略。
15.(共5分) (1) ⑤⑥⑦ (3分) (2)bd (2分)
16.(除标注外每空1分,共10分)
(1)增大 增大 逆向 (2)不变
(3)n<p (2分) 正向 减小 增大 学法题:略。
17.(除标注外每空2分,共13分)
Ⅰ.(1)玻璃搅拌器(1分) (2)减少实验过程中的热量损失。
NH3·H2O是弱碱,电离时吸热,导致放出热量减少 -50.2 kJ·ml-1 AC;
Ⅱ. ①② (2分) 5 (1分) <(1分)
第Ⅱ卷 提高题(共20分)
18.(每空2分,共8分)
(1) -90 0.5 (2) 0.12ml∙(L∙min) −1 >
19.(除标注外每空2分,共9分)
(1) > (1分) (2) υ(Z) > υ(X) > υ(Y ) K(X) = K(Z)>K(Y )
(3)增大 (4)或22.2%
20.卷面分:(3分)
知 识 与 技 能
学习能力(学法)
内容
反应热
化学反应速率
化学平衡
易混易错
规律提炼
方法归纳
分数
33
22
42
11
10
10
温度/℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
化学键
键能 kJ/ml
反应物
起始温度t1/℃
最高温度t2/℃
甲组(HCl+NaOH)
15.0
18.3
乙组(HCl+NH3·H2O)
15.0
18.0
序号
0.1ml/LNa2S2O3溶液
0.1ml/LH2SO4溶液
蒸馏水
温度
变浑浊时间/s
①
10mL
10mL
0mL
20℃
t1
②
10mL
10mL
0mL
40℃
t2
③
10mL
5mL
VmL
20℃
t3
④
10mL
7mL
3mL
30℃
t4
化学反应
反应热
平衡常数(850℃)
①
②
③
物质
H2
CO2
CH3OH
H2O
浓度(ml/L)
0.2
0.2
0.4
0.4
学校:
姓名:
班级:
考场:
座号
江苏省启东中学2024-2025学年高二上学期第一次月考化学试题(Word版附答案): 这是一份江苏省启东中学2024-2025学年高二上学期第一次月考化学试题(Word版附答案),共12页。试卷主要包含了 某密闭容器中进行如下反应, 可逆反应,06NAeV等内容,欢迎下载使用。
湖南省长沙市实验中学2024-2025学年高二上学期第一次月考化学试题(Word版附答案): 这是一份湖南省长沙市实验中学2024-2025学年高二上学期第一次月考化学试题(Word版附答案),共20页。试卷主要包含了某科研人员提出与在羟基磷灰石,反应A→C分两步进行,已知热化学方程式,已知反应的反应机理如下等内容,欢迎下载使用。
湖南省长沙市第一中学2024-2025学年高二上学期第一次月考化学试题(Word版附答案): 这是一份湖南省长沙市第一中学2024-2025学年高二上学期第一次月考化学试题(Word版附答案),共18页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












