
福建省2024届高三下学期毕业班5月模拟化学试卷(有解析)word
展开(完卷时间 75 分钟;满分 100 分)
友情提示:请将所有答案填写到答题卡上! 请不要错位、越界答题!
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 K 39
一、选择题:本题共10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
A.“常恐秋节至,焜黄华叶衰”,树叶由绿变黄是发生了化学变化
B.“心忧炭贱愿天寒”中的炭与“嫦娥五号”卫星所用的碳纤维互为同素异形体
C.“兰陵美酒郁金香,玉碗盛来琥珀光”,“香”的原因之一是美酒含酯类物质
D.“三月打雷麦谷堆”,在雷电作用下N2最终转化成被农作物吸收的化合态氮
2.下列化学用语表达正确的是
A.的名称:乙二酸乙二酯
B.空间填充模型既可以表示甲烷分子,也可以表示四氯化碳分子
C.的价层电子对互斥(VSEPR)模型:
D.基态铍原子最外层电子的电子云轮廓图:
3.一种天然生物碱X的结构简式如图,下列关于X的说法错误的是
A.含有5种官能团
B.1mlX与1mlH2发生加成反应,得到2种不同产物
C.X在Cu催化作用下不能与氧气发生催化氧化
D.盐酸反应后的产物分子中含有5个手性原子
4.下列离子方程式书写错误的是
A.次氯酸钠溶液通入少量的CO2:ClO-+CO2+H2O=HClO+HCO3-
B.甘油与硝酸发生酯化反应:
C.向少量沉淀中加入的浓氨水,白色沉淀溶解:
D.用惰性电极电解溶液,阴极的电极反应式:
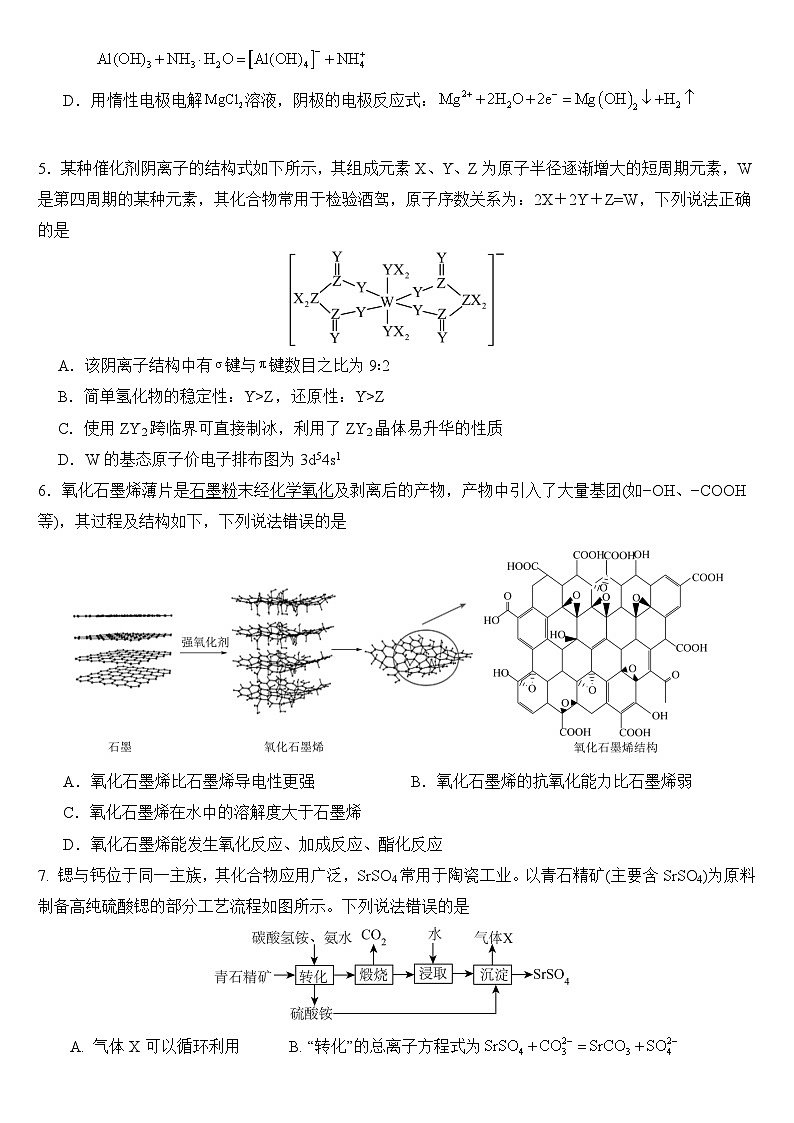
5.某种催化剂阴离子的结构式如下所示,其组成元素X、Y、Z为原子半径逐渐增大的短周期元素,W是第四周期的某种元素,其化合物常用于检验酒驾,原子序数关系为:2X+2Y+Z=W,下列说法正确的是
A.该阴离子结构中有键与键数目之比为9∶2
B.简单氢化物的稳定性:Y>Z,还原性:Y>Z
C.使用ZY2跨临界可直接制冰,利用了ZY2晶体易升华的性质
D.W的基态原子价电子排布图为3d54s1
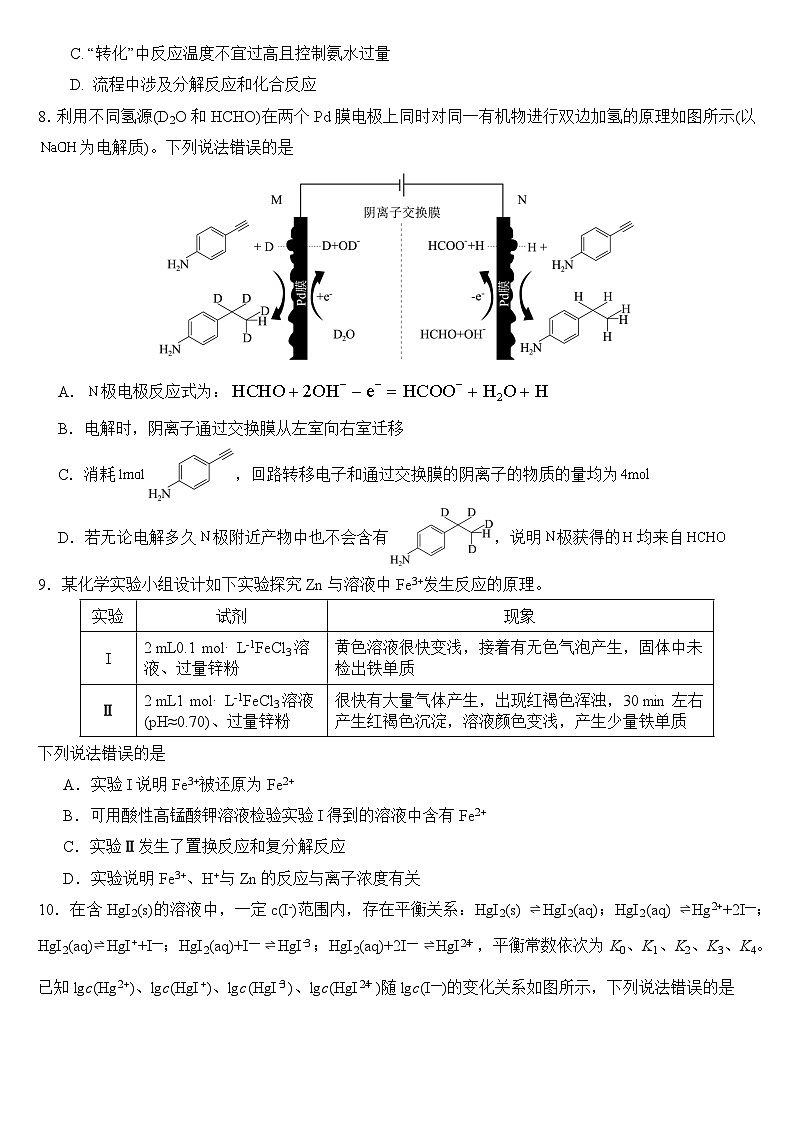
6.氧化石墨烯薄片是石墨粉末经化学氧化及剥离后的产物,产物中引入了大量基团(如−OH、−COOH等),其过程及结构如下,下列说法错误的是
A.氧化石墨烯比石墨烯导电性更强 B.氧化石墨烯的抗氧化能力比石墨烯弱
C.氧化石墨烯在水中的溶解度大于石墨烯
D.氧化石墨烯能发生氧化反应、加成反应、酯化反应
7. 锶与钙位于同一主族,其化合物应用广泛,SrSO4常用于陶瓷工业。以青石精矿(主要含SrSO4)为原料制备高纯硫酸锶的部分工艺流程如图所示。下列说法错误的是
A. 气体X可以循环利用 B. “转化”的总离子方程式为
C. “转化”中反应温度不宜过高且控制氨水过量
D. 流程中涉及分解反应和化合反应
8.利用不同氢源(D2O和HCHO)在两个Pd膜电极上同时对同一有机物进行双边加氢的原理如图所示(以为电解质)。下列说法错误的是
A.极电极反应式为:
B.电解时,阴离子通过交换膜从左室向右室迁移
C.消耗,回路转移电子和通过交换膜的阴离子的物质的量均为
D.若无论电解多久极附近产物中也不会含有,说明极获得的均来自
9.某化学实验小组设计如下实验探究Zn与溶液中Fe3+发生反应的原理。
下列说法错误的是
A.实验I说明Fe3+被还原为Fe2+
B.可用酸性高锰酸钾溶液检验实验I得到的溶液中含有Fe2+
C.实验Ⅱ发生了置换反应和复分解反应
D.实验说明Fe3+、H+与Zn的反应与离子浓度有关
10.在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) ⇌ HgI2(aq);HgI2(aq) ⇌ Hg2++2I—;HgI2(aq)⇌ HgI++I—;HgI2(aq)+I— ⇌ HgIeq \\al(-,3);HgI2(aq)+2I— ⇌ HgIeq \\al(2-,4),平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(HgIeq \\al(-,3))、lgc(HgIeq \\al(2-,4))随lgc(I—)的变化关系如图所示,下列说法错误的是
A.线L表示lgc(HgIeq \\al(2-,4))的变化情况
B.随c(I—)增大,c[HgI2(aq)]保持不变
C.a=lg eq \f(K1,K2)
D.溶液中I元素与Hg元素的物质的量之比始终为2:1
二、非选择题(本题共4小题,共60分)
11.(15分)苯氧乙酸是制备除草剂(2,4-D)的原料。某小组设计方案制备苯氧乙酸(M=152g·ml-1),制备原理:
实验步骤:
步骤1:如图1装置(部分夹持及加热装置省略),在三颈瓶中加入3.8g氯乙酸(M=94.5g·ml-1)和5mL水,开动搅拌,慢慢滴加饱和溶液(约需8mL),至溶液pH为7~8。然后加入2.5g苯酚(M=94g·ml-1),再慢慢滴加35%的NaOH溶液至反应混合液pH为12。
步骤2:将反应物在沸水浴中加热约0.5h。反应过程中pH会下降,应补加NaOH溶液,保持pH为11~12,在沸水浴上再继续加热30min,使反应完全。
步骤3:反应完毕后将三口瓶移出水浴,趁热转入锥形瓶中,在搅拌下用浓盐酸酸化至pH为2~3。
步骤4:在冰浴中冷却,析出固体,待结晶完全后,抽滤(如图2所示),粗产物用冷水洗涤2~3次,在60~65℃干燥,产量约3.0g。
(1)图1仪器A名称是 ,进水口为 (填“a”或“b”)。
(2)步骤1中不能用NaOH溶液替代Na2CO3溶液的理由是 。
(3)本实验进行了多次调节pH,最终目的是 。
(4)相对酒精灯直接加热,步骤2用沸水浴加热的优点是 。步骤3“趁热”转移的目的是 。
(5)步骤4抽滤的优点是 ;抽滤操作部分步骤如下:
①过滤完成后,先断开抽气泵和吸滤瓶之间的橡皮管,然后再关闭抽气泵。
②将准备好的液体缓慢地倒入布氏漏斗中。
③先润湿滤纸后开启抽气泵,抽气以帮助滤纸紧贴在漏斗的内壁,防止液体泄漏。
④从漏斗中取出固体时,应小心地将漏斗从抽滤瓶上移除,并将漏斗管倒置,利用手的力量将固体和滤纸一同脱落到干净的表面上。
正确的先后操作顺序是 (填序号)。
(6)本实验产率最接近 (填字母)。A.46%B.58%C.75%D.81%
12.(18分)纳米氧化锌具有颗粒微小、比表面积大、分散性好、疏松多孔等物理特性和极强的化学活性。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
已知某铜转炉烟灰化学成分百分含量分析如下表:
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃,浸出率随温度升高而降低的原因可能是 。
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为 。
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是 ,缩短沉降时间。
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5,使还原产物为MnO2,滤渣2的主要成分为 (填化学式)。
(5)“沉锌”反应的离子方程式为 。
(6)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整HCO和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8ml·L-1时,HCO的浓度为 ,沉淀物的粒径最佳。
(7)天然硫化铜俗称铜蓝,其晶胞结构如图。基态Cu2+的价电子排布式为 。晶胞中含有 个S22-,N(Cu+):N(Cu2+)= 。晶体中微粒间作用力有 (填标号)。a.氢键 b.离子键 c.共价键 d.金属键
13.(12分)回收利用合成化工制成品是实现碳中和重要途径之一、利用二氧化碳合成二甲醚(DMC)的主要反应有:
Ⅰ.
Ⅱ.
(1)和为原料制备气态CH3OCH3和水蒸气的热化学方程式是 。
(2)对于基元反应,若升高反应温度,平衡常数K (填“增大”、“减小”或“不变”); (填“>”、“<”或“=”)。已知:阿伦尼乌斯经验公式为,其中:为正、逆反应的活化能,k为正、逆反应速率常数,R和C为常数。某实验小组依据实验数据获得如下图曲线。曲线中表示正反应速率的是 (填“m”或“n”)。
(3)T℃时,向体积为2L的密闭容器中通入、,同时发生上述两个反应,装置中压强p随着时间t变化如上表:
①平衡时测得水蒸气分压,反应Ⅱ 生成的选择性为 (选择性,保留1位小数)。
②反应Ⅰ的压强平衡常数 (写出计算表达式)。
(4)“直接二甲醚()燃料电池”被称为绿色电源,其工作原理如图所示,写出A电极的电极反应式 。
14.(15分)尼拉帕尼(J)是一种安全高效抗癌药,根据该药物的两条合成路线,回答下列问题。
已知:
路线一:
(1)A的结构简式为 。
(2)C→D的反应类型是 。D→E引入Bc基团的作用为 。
(3)符合下列条件的D的同分异构体有 种。
①有一个含两个氮原子的六元环,且两个氮原子处于对位
②有一个苯环和一个甲基 ③仅有一个碳原子不参与成环
(4)H→I反应的化学方程式为 。
路线二:
(5)K中含氧官能团的名称为 。L的分子式为 。
(6)N→I反应的化学方程式为 。
化学参考答案及解析
1.本答案及评分说明供阅卷评分时使用,考生若答出其他正确答案,可参照本说明给分。
2.化学方程式(包括离子方程式、电极反应式等)中的化学式、离子符号答错,不得分;化学式、离子符号书答正确但未配平、“↑”“↓”未标、必须书答的反应条件未答(或答错)、有机反应方程式箭号写成等号等化学用语书答规范错误的,每个化学方程式累计扣1分。
3.化学专用名词书答错误不得分。
第Ⅰ卷(选择题 40分)
1.B 【详解】A.“常恐秋节至,焜黄华叶衰”,树叶由绿变黄是树叶中叶绿素分解,被叶绿素掩盖的红色素、黄色素露出而显红色、黄色,有新物质产生,发生了化学变化,故A正确;
B.碳纤维是一种新型无机非金属材料,是含碳量在90%以上的高强度高模量纤维,主要成分是碳的单质,“心忧炭贱愿天寒”中的炭,炭黑的主要成分也为碳,不能互称为同素异形体,金刚石、石墨、活性炭等由碳元素组成的不同的单质才能互称为同素异形体,故B错误;
C.酒放置时间长,少量的乙醇被氧化为乙酸,乙酸与乙醇生成乙酸乙酯,乙酸乙酯等酯类物质具有香味,所以产生香味主要是因为美酒含有酯类物质,故C正确;
D.氮气跟氧气能直接化合生成无色的一氧化氮气体;一氧化氮不溶于水,在常温下易跟空气中的氧气化合,生成红棕色的二氧化氮气体;二氧化氮易溶于水,它溶于水后生成硝酸和一氧化氮,硝酸进一步转化为可以为植物吸收的硝酸盐,增加土壤中氮肥含量,有利于作物生长,故D正确。
2.C 【详解】A.名称为乙二酸二乙酯,A错误;B.可以表示甲烷分子,但是不能表示CCl4分子,因为Cl原子的半径比C原子大,与比例模型中的原子大小不符,故B错误;
C.的中心原子价层电子对数为,其VSEPR模型为平面三角形,C正确;D.基态铍原子电子排布式为1s22s2,最外层电子在s轨道,电子云轮廓是球形的,故D错误;故选C。
3.B 【解析】A.观察结构可知含有羟基、醚键、氨基、碳碳双键、酯基,故有5种,故A正确;B.1mlX中含有两个碳碳双键可以与发生加成,但只有,可知有,共3中,故B错误;C.与羟基直接的碳原子没有H,不能发生催化氧化,故C正确;D.手性原子是指与四个不同原子或原子团相连的原子,盐酸难与碳碳双键加成,但是能让酯基水解,由此可知足量盐酸反应后的产物为,如图所示,共有5个手性原子,故D正确;故答案选B。
4.B 【详解】A、电离平衡常数H2CO3>HClO>HCO3-可知次氯酸的酸性大于碳酸氢根离子,次氯酸钠与二氧化碳反应生成的是碳酸氢根离子:ClO-+CO2+H2O=HClO+HCO3-,故B错误;B、醇和羧酸的反应为酯化反应,故该反应不是酯化反应,B项错误;
D、用惰性电极电解溶液,阴极上水电离出的H+发生还原反应生成H2,Mg2+和水电离产生的OH-反应生成沉淀,故阴极的电极反应式为,D项正确。
5.C 【分析】W是第四周期的某种元素,其化合物常用于检验酒驾,W为元素;元素X、Y、Z为原子半径逐渐增大的短周期元素,原子序数关系为:2X+2Y+Z=W,结合阴离子结构,Z成4个共价键,为第IVA族元素,Y成2个共价键,为第VIA族元素,则X、Y、Z分别为、、;【解析】A.共价单间都是键,双键一个,一个键。根据结构示意图可知,阴离子结构中有键与键数目之比为13∶2,A错误;B.同周期元素从左到右非金属性逐渐增强,非金属性:O>C,非金属性越强,简单氢化物的稳定性越强,简单氢化物稳定性:H2O>CH4,非金属性越强,还原性越弱,还原性:O<C,B错误;C.ZY2为CO2,固态的二氧化碳是干冰,利用CO2晶体易升华的物理性质,使用CO2跨临界可直接制冰,故C正确;D.Cr基态原子价电子排布图为,D错误;答案选B。
6.A 【详解】A.氧化石墨烯分子中,有一部分碳原子形成了C—C、C—O键,形成大π键的电子(自由电子)数减少,所以比石墨烯导电性弱,A错误;
B.氧化石墨烯中含有碳碳双键和羟基,易被氧化,故抗氧化能力比石墨烯弱,B项正确;
C.氧化石墨烯中含有羧基、羟基,能与水分子形成分子间氢键,故氧化石墨烯在水中的溶解度大于石墨烯,故C正确;
D.氧化石墨烯中含有碳碳双键能发生氧化反应和加成反应,含有羟基、羧基能发生酯化反应,故D正确;故选A。
7. B 【分析】相同温度时溶解度SrCO3
8.C 【解析】A.由图可知,N极HCHO和OH−失电子生成HCOO−和H,配平后电极方程式正确,A正确;
B.NaOH为电解质,N极电极反应消耗OH−,电解时,阴离子通过交换膜从左室向右室迁移,B正确;
C.M极消耗1ml,产物中增加4mlD,D来源于D2O,化合价由+1变为0,共得4ml电子,阴阳极得失电子守恒,N极也失4ml电子,由N极电极反应知,需要8mlOH-,即通过交换膜的阴离子的物质的量为8ml,C错误;
D.若无论电解多久N极附近产物中也不会含有,结合N极电极反应,说明N极获得的H均来自HCHO,D正确;
本题选C。
9.B 【详解】A.实验I黄色溶液很快变浅,固体中未检出铁单质,说明Fe3+被还原为Fe2+,黄色溶液很快变浅,选项A正确;B.FeCl3溶液中的Cl-也能被酸性高锰酸钾溶液氧化,干扰Fe2+的检验,故不能用酸性高锰酸钾溶液检验实验I得到的溶液中含有Fe2+,选项B错误;C.FeCl3溶液中加入过量锌粉,很快有大量气体产生,是氯化铁溶液水解产生的盐酸与锌粉反应产生氯化锌和氢气,反应为置换反应;出现红褐色浑浊,是氯化铁水解生成氢氧化铁,属于复分解反应;产生少量铁单质,是锌置换出铁,属于置换反应,选项C正确;D.根据上述实验可知,实验开始时Fe3+浓度较大,先与锌发生氧化还原反应生成氯化锌和氯化亚铁,当Fe3+浓度较低,H+浓度较大时,H+与锌反应生成锌盐和氢气,故实验说明Fe3+、H+与Zn的反应与离子浓度有关,选项D正确。
10.D
【解析】由题干反应方程式HgI2(aq)⥫=⥬Hg2++2I—可知,K1= eq \f(c(Hg2+)·c2(I―),c(HgI2)) ,则有c(Hg2+)= eq \f(K1·c(HgI2),c2(I―)) ,则有lgc(Hg2+)=lgK1+lgc(HgI2)-2lgc(I-),同理可得:lgc(HgI+)=lgK2+lgc(HgI2)-lgc(I-),lgc(HgIeq \\al(-,3)) =lgK3+lgc(HgI2)+ lgc(I-), lgc(HgIeq \\al(2-,4))==lgK4+lgc(HgI2)+ 2lgc(I-),且由HgI2(s)⥫=⥬HgI2(aq)可知K0=c[HgI2(aq)]为一定值,故可知图示中曲线1、2、3、4即L分别代表lgc(HgI+)、lgc(Hg2+)、lgc(HgIeq \\al(-,3))、lgc(HgIeq \\al(2-,4)),据此分析解题。
【详解】A.由分析可知,线L表示lgc(HgIeq \\al(2-,4))的变化情况,A正确;
B.已知HgI2(s)⥫=⥬HgI2(aq)的化学平衡常数K0=c[HgI2(aq)],温度不变平衡常数不变,故随c(I—)增大,c[HgI2(aq)]始终保持不变,B正确;
C.由分析可知,曲线1方程为:lgc(Hg2+)=lgK1+lgc(HgI2)-2lgc(I-),曲线2方程为: lgc(HgI+)=lgK2+lgc(HgI2)-lgc(I-)即有①b= lgK1+lgc(HgI2)-2a,②b= lgK2+lgc(HgI2)-a,联合①②可知得:a=lgK1-lgK2=lg eq \f(K1,K2) ,C正确;
D.若溶液中只含HgI2,则溶液中I元素与Hg元素的物质的量之比为2:1,由于溶液中c[HgI2(aq)]不变,而c(I-)在变化,可能是加入了其它物质,影响了溶液中I元素或Hg元素的含量,则溶液中二者的物质的量之比可能发生变化,D错误;故答案为:D。
11.(15分)
(1)球形冷凝管(1分) b(1分)
(2)减少副产物,避免碳氯键水解(2分)
(3)控制酸度,使反应完全并提高产品纯度和产率
(4)便于控制温度、受热均匀(1分) 避免产品析出,减少产品损失
(5)过滤快、固体较干燥、固液易分离等 ③②①④
(6)C
【分析】本实验制备苯氧乙酸,先让氯乙酸与碳酸钠反应生成氯乙酸钠,再让苯酚与氢氧化钠溶液反应生成苯酚钠,沸水水浴中加热0.5h,氯乙酸钠与苯酚钠反应生成苯氧乙酸钠,利用酸性强的制备酸性弱的,苯氧乙酸钠与盐酸反应生成苯氧乙酸,据此分析解答;
【详解】(1)仪器A的名称是球形冷凝管,b是进水口。
(2)加入试剂缓慢,防止局部碱性过强,避免反应不充分、碳氯键水解、减少副产物等。如果用NaOH替代,碱性过强会导致碳氯键水解生成副产物。
(3)步骤2调节pH,使反应完全,又不使碳氯键水解;步骤3调节pH使-COONa全部转化成-COOH,提高产品纯度和产率。
(4)沸水浴使三颈瓶受热面积大、受热均匀、便于控制温度等。“趁热”转移,可以避免温度降低,析出产品,导致产品损失。
(5)抽滤就是减压过滤,优点是:过滤速度快,便于固液分离,固体较干燥等。部分操作:先润湿滤纸,打开抽气泵,再转移固体和液体、抽滤、关闭抽气泵、转移固体,正确的先后操作顺序是③②①④。
(6)经计算,由于,氯乙酸稍过量,以苯酚为计算依据。理论产量:,本实验的产率为。
12.(18分)
(1)温度超过40℃,氨气逸出导致浸出速率下降
(2)ZnO+22NH4++2NH3·H2O=[Zn(NH3)4]2++3H2O
(3)水解生成Fe(OH)3胶体,吸附FeAsO4
(4)Fe(OH)3、MnO2
(5)5Zn2++10=Zn5(CO3)2(OH)6↓+2H2O+8CO2↑
(6)2ml·L-1
(7)(1分) 2(1分) 2:1 bc
【分析】首先利用氯化铵和氨水浸取铜转炉烟灰,Pb元素转化为Pb(OH)Cl沉淀除去,Zn、Fe、Cu、As等元素进入溶液,加入氯化铁,As元素转化为FeAsO4沉淀除去,加入硫酸酸化的高锰酸钾,亚铁离子全部被氧化成Fe3+,调节pH使铁离子转化为沉淀除去;此时还有铜离子会影响后续减少碳酸锌的纯度,所以试剂a应除去铜离子,为了不引入新的杂质,可以加入过量的Zn单质置换出铜,从而将其除去;之后加入碳酸氢铵将锌离子转化为碱式碳酸锌,煅烧后得到氧化锌,据此解答。
【详解】(1)由于温度超过40℃,氨气逸出导致浸出速率下降,故“浸取”温度应选择40℃左右为宜。
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO与氨水、氯化铵反应生成氯化四氨合锌和水,发生反应的离子方程式为ZnO+2+2NH3·H2O=[Zn(NH3)4]2++3H2O。
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是水解生成Fe(OH)3胶体,吸附FeAsO4,缩短沉降时间。
(4)根据分析和还原产物为二氧化锰可知,滤渣2的主要成分为Fe(OH)3、MnO2。
(5)“还原沉降”选用的“试剂a”将溶液中的铜离子还原为铜单质,但不能引入新的杂质,故“试剂a”为Zn。
(6)“沉锌”时溶液中的Zn2+与NH4HCO3作用生成Zn5(CO3)2(OH)6沉淀、CO2等,通过电荷守恒、原子守恒配平得该反应的离子方程式为5Zn2++10=Zn5(CO3)2(OH)6↓+2H2O+8CO2↑。
(7)(7)由题表可知,=2.5时,沉淀物粒径在1μm以下共40.82%+50.35%+8.37%=%,c(Zn2+)=0.8ml·L-1,所以c()=2.5×c(Zn2+)=2ml·L-1。
(8)由俯视图可知,俯视图处于顶点位置的S可能处于晶胞顶点或者棱上,结合晶胞图形可知该S处于棱上,且该S实际存在形式为,个数为;俯视图处于面点位置的S可能处于晶胞体内或者面心上,结合晶胞图形可知该S处于体内,且该S实际存在形式为,个数为2个,因此晶胞中S的总价态为2×(-2)+2×(-2)=-8,由晶胞可知Cu位于晶胞内部,则晶胞中Cu的总个数为6个,设Cu+的个数为x,Cu2+的个数为y,则x+y=6,x+2y=+8,联立二式子解得x=4,y=2,故2:1;晶体中微粒间作用力有离子键及共价键;
13.(12分)
(1)
(2)减小(1分) < (1分) n
(3)90.9% 或
(4)
【详解】(1)反应Ⅰ. ,反应Ⅱ. ,根据盖斯定律Ⅱ×1-I×2得,所以,即热化学方程式是;
(2)对于基元反应,即反应为放热反应,所以升高温度平衡逆向移动,平衡常数K减小;反应为放热反应,所以<;反应为放热反应,根据阿伦尼乌斯经验公式可知,活化能越大,变化率越大,即图中斜线斜率的绝对值更大,而放热反应中,故,所以图中n为正反应速率;
(3)①反应Ⅰ.左右两边气体化学计量数相等,反应Ⅰ的发生不会引起容器中气体物质的量或压强的变化,反应Ⅱ.左边气体化学计量数更大,所以压强的变化是因为反应Ⅱ的发生,由化学计量数可知,消耗2mlCO2或生成1mlCH3OCH3时气体减少(2+6-1-3)=4ml,2min时气体总物质的量为,减少(2+6-6.4)ml=1.6ml,则;其他条件不变,恒容充入惰性气体,反应物浓度不变,反应速率不变;
②平衡时:,则,平衡时总压为12MPa,,则,而反应Ⅱ.生成0.5mlCH3OCH3时生成1.5mlH2O、消耗1mlCO2,则反应Ⅰ.生成0.1mlH2O、消耗0.1mlCO2,根据定义,反应Ⅱ选择性;
③据以上分析列三段式、;
(4)“直接二甲醚()燃料电池”通空气的一极为正极,即 A电极为负极、B电极为正极,负极二甲醚发生氧化反应生成二氧化碳,其电极反应式为。
14.(15分) (1)
(2)还原反应 保护-NH-官能团
(3)15
(4)+ NH3 +CH3OH
(5)羟基(1分)
(6)++HBr
【分析】
A和B发生已知信息①的反应达到C,结合A、B的分子式可以推知A为、B为、C为,C和H2发生加成反应生成D,结合G的结构简式可知D为,D和(Bc)2O发生取代反应生成E为,E和F发生已知信息②的原理得到G,则F为,G和NaN3发生反应生成H,H和NH3发生取代反应生成I为,I酸化得到J,以此解答。
【详解】(2)由分析可知,C和H2发生加成反应生成D,D→E引入Bc基团后续在J中又转化为-NH-基团,则引入Bc基团的作用为保护-NH-官能团。
(3)D为,D的同分异构体满足条件:①有一个含两个氮原子的六元环,且两个氮原子处于对位;②有一个苯环和一个甲基;③仅有一个碳原子不参与成环;当苯环上有两个取代基时组合为-CH3和;-CH3和;每种组合都有邻、间、对三种位置关系,共有6种情况;当苯环上只有一个取代基时,可能的情况有;;; ;;;;;共9种情况,综上所述,满足条件的D的同分异构体共有15种。
(5)K和(Bc)2O发生取代反应生成L,L和发生已知信息④的反应原理得到M,则L为,K为,K发生分子内成环反应得到N为,N和发生取代反应生成I为,I酸化得到J, K中含氧官能团的名称为羟基,L的分子式为。
(6)N为,N和发生取代反应生成I为。实验
试剂
现象
I
2 mL0.1 ml· L-1FeCl3溶液、过量锌粉
黄色溶液很快变浅,接着有无色气泡产生,固体中未检出铁单质
Ⅱ
2 mL1 ml· L-1FeCl3溶液(pH≈0.70)、过量锌粉
很快有大量气体产生,出现红褐色浑浊,30 min左右产生红褐色沉淀,溶液颜色变浅,产生少量铁单质
Cu
Zn
Pb
Fe(Ⅱ)
As
10.30%
8.75%
19.07%
2.51%
4.68%
离子
Cu2+
Zn2+
Fe2+
Fe3+
Ksp
2.2×10-20
6.7×10-17
8.0×10-16
4.0×10-38
n(HCO)/n(Zn2+)
粒度分布质量分数/%
0.0~0.1μm
0.1~0.5μm
0.5~1.0μm
1.0~5.0μm
5.0μm以上
2
25.3
38.41
34.55
1.74
0.001
2.5
40.82
50.35
8.37
0.46
0.001
3
35.2
55.37
8.2
1.23
0.001
0
1
2
3
4
5
6
16
13.4
12.8
12.4
12.2
12
12
1
2
3
4
5
6
7
8
9
10
B
C
B
B
C
A
B
C
B
D
福建省厦门市2024届高三下学期联考模拟预测化学试卷(Word版附解析): 这是一份福建省厦门市2024届高三下学期联考模拟预测化学试卷(Word版附解析),文件包含2024届福建省厦门市高三下学期联考模拟预测化学试题原卷版docx、2024届福建省厦门市高三下学期联考模拟预测化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
福建省泉州市2024届高三下学期高中毕业班质量监测(三)化学试卷(Word版附解析): 这是一份福建省泉州市2024届高三下学期高中毕业班质量监测(三)化学试卷(Word版附解析),共11页。试卷主要包含了03,5 Sr 88,12 L CO含有质子数为0等内容,欢迎下载使用。
福建省泉州市2024届高三下学期高中毕业班质量监测(三)化学试卷: 这是一份福建省泉州市2024届高三下学期高中毕业班质量监测(三)化学试卷,共11页。试卷主要包含了03,5 Sr 88,12 L CO含有质子数为0等内容,欢迎下载使用。












