





苏教版第二单元 微粒之间的相互作用力教学课件ppt
展开
这是一份苏教版第二单元 微粒之间的相互作用力教学课件ppt,共28页。PPT课件主要包含了课前导入,化学键,离子键,电子式,共价键,HCl,H2O,NH3,CO2,共价化合物等内容,欢迎下载使用。
构成物质的基本微粒有原子、离子和分子等,这些微粒间通过一定的作用力彼此结合。例如,氯化钠、氧化镁是由阴、阳离子构成的;氯气是由许多氯分子聚集而成的,每个氯分子是由两个氯原子结合而成的;金刚石是由许多碳原子彼此结合形成的。那么,微粒间的这些相互作用具有什么特点?我们看到的物质为什么外在形态和功能有所差异?
通常我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫作化学键(chemical bnd)。离子键和共价键是两种常见的化学键。
在氯化钠和氧化镁的形成过程中,钠、镁原子失去电子,氯、氧原子得到电子,它们通过电子转移分别形成阳离子和阴离子而彼此结合。哪类元素的原子能以这种方式相结合?这种结合方式与它们的原子结构有什么关系?
活泼金属与活泼非金属化合时,由于活泼金属的原子容易失去其最外层上的电子形成阳离子,活泼非金属的原子容易获得电子形成阴离子,它们之间可以通过电子转移,分别形成阳离子和阴离子,阴、阳离子间通过静电作用形成NaCl、MgO等化合物。上述化合物中,阴、阳离子之间存在的强烈的相互作用,称为离子键。我们把由阴、阳离子构成的化合物称为离子化合物。
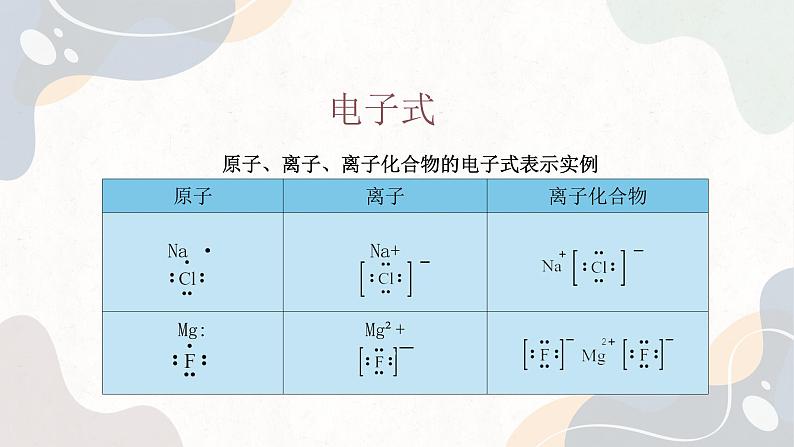
例如,钠原子与氯原子形成氯化钠的过程中,钠原子最外层的一个电子转移至氯原子的最外层,使得两者最外电子层都形成了具有8个电子的稳定结构。为了方便表示原子、离子的最外层电子的排布,我们可以在元素符号周围用“ ”或“×”来表示原子、离子的最外层电子,这种式子称为电子式。
我们知道,氯气、氯化氢都是由分子构成的物质。两个氯原子可以结合成一个氯分子,一个氯原子和一个氢原子可以结合成一个氯化氢分子。非金属元素的原子吸引电子的能力相近,原子间无法通过得失电子形成离子键。那么它们是如何结合在一起的呢?这种情况下,原子间共用最外层上的电子,形成共用电子对,以达到稳定的电子层结构,共用电子对同时受到两个原子核的吸引。像这样,原子间通过共用电子对形成的强烈的相互作用称为共价键(cvalent bnd)。原子之间全部以共价键结合的分子叫作共价分子(cvalentmlecule)。
当氯原子和氢原子结合成氯化氢分子,氧原子和氢原子结合成水分子时, 原子间是如何形成共用电子对的?
氯化氢分子的形成氯原子的结构:氯原子的原子序数为 17,其核外电子排布为 2、8、7,最外层有 7 个电子。氢原子的结构:氢原子的原子序数为 1,核外只有 1 个电子。结合过程:氯原子需要获得 1 个电子才能达到 8 电子稳定结构,氢原子需要获得 1 个电子才能达到 2 电子稳定结构。当氯原子和氢原子靠近时,氢原子的 1 个电子与氯原子的 1 个电子形成共用电子对。这样,氯原子和氢原子都达到了相对稳定的结构,从而形成氯化氢分子。在氯化氢分子中,共用电子对偏向氯原子,使氯原子带部分负电荷,氢原子带部分正电荷。
二、水分子的形成氧原子的结构:氧原子的原子序数为 8,其核外电子排布为 2、6,最外层有 6 个电子。结合过程:氧原子需要获得 2 个电子才能达到 8 电子稳定结构。两个氢原子各提供 1 个电子,分别与氧原子形成共用电子对。这样,氧原子和两个氢原子都达到了相对稳定的结构,从而形成水分子。在水分子中,共用电子对偏向氧原子,使氧原子带部分负电荷,氢原子带部分正电荷。总之,在氯化氢分子和水分子的形成过程中,原子间通过共用电子对的方式达到稳定结构,这种共价键的形成使得分子具有特定的化学性质和物理性质。
用电子式表示共价键的形成
在HCl、H2O分子中,各原子最外电子层都达到了最多能容纳的电子数,形成了稳定的电子层结构。以共价键结合的两个原子间形成的共用电子对,可能超过一对。如氮分子中两个氮原子间有三对共用电子对,可用电子式表示为 。两个氮原子结合成氮分子时,氮原子最外电子层形成了具有8个电子的稳定结构。
除了电子式外,我们还可以用结构式表示共价分子。在结构式中,原子间的一条短线表示一对共用电子对,如H—Cl、H—O—H、 等。HCl、H2、Cl2、H2O、CH4、CO2等分子中直接相邻的原子间均以共价键相结合。其中,像HCl、H2O、CH4、CO2这样的化合物属于共价化合物(cvalent cmpund)。共价分子中各原子间有一定的连接方式,分子有一定的空间结构。可以用球棍模型、空间填充模型表示共价分子的空间结构。
电子式是在元素符号周围用小黑点 “・” 或小叉 “×” 来表示原子的最外层电子的式子。一、书写要点首先要明确原子的最外层电子数。可以通过元素的原子序数来确定其核外电子排布,进而确定最外层电子数。例如,氢原子的原子序数为 1,其电子排布为 1,最外层电子数为 1。
表示最外层电子时,小黑点 “・” 或小叉 “×” 的数目等于该原子的最外层电子数。如钠原子的电子式为・Na・,最外层有 1 个电子。对于离子的电子式:阳离子:简单阳离子的电子式就是其离子符号本身,如钠离子的电子式为 Na⁺。复杂阳离子(如铵根离子),要标明最外层电子数以及所带电荷,如铵根离子的电子式为 ,用方括号括起来,并在右上角标明所带电荷。阴离子:要用方括号括起来,并在右上角标明所带电荷,如氯离子的电子式为 。
对于化合物的电子式:离子化合物:由阳离子和阴离子组成,要分别写出阳离子和阴离子的电子式,然后让阴阳离子间隔排列,注意相同离子不能合并。例如氯化钠的电子式为 共价化合物:要根据共价键的形成,将共用电子对用小黑点 “・” 或小叉 “×” 表示在两原子之间。例如氯化氢的电子式为 。
观察图中几种含碳化合物的结构式,分析各化合物分子中每个碳原子能形成几个共价键,碳原子之间是怎样连接的。
由图可知,一个碳原子可以形成四对共用电子对,两个碳原子之间可以通过一对、两对或三对共用电子对相结合,分别构成碳碳单键、碳碳双键或碳碳三键。碳原子之间可以通过共价键彼此结合形成碳链,也可以连接形成碳环。碳原子间连接方式的多样性,是有机化合物种类繁多的原因之一。
我们知道,干冰升华、硫晶体熔化、液氯汽化都要吸收能量。物质从固态转变为液态或气态,或从液态转变为气态,为什么要吸收能量?在降低温度、增加压强时,氯气、二氧化碳等气体能够从气态凝结成液态或固态。这些现象给我们什么启示?
许多事实证明,分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力(intermlecular frce),又称范德华力。分子间作用力比化学键弱得多。由分子构成的物质,分子间作用力是影响物质熔、沸点和溶解性的重要因素之一。在决定物质的物理性质方面起着重要的作用。
二、特点强度较弱:与化学键相比,分子间作用力要小得多。一般只有几个到几十个千焦每摩尔,而化学键的键能通常在几百千焦每摩尔以上。短程力:分子间作用力的作用范围很短,一般只有几个埃(1 埃 = 10⁻¹⁰ 米)。无方向性和饱和性:分子间作用力不像化学键那样有特定的方向和饱和性,它可以在分子周围的各个方向上起作用,并且一个分子可以与周围多个分子同时产生分子间作用力。
三、对物质性质的影响对物质熔沸点的影响:一般来说,分子间作用力越大,物质的熔沸点越高。例如,对于同系列的物质,相对分子质量越大,分子间作用力越强,熔沸点也越高。对物质溶解性的影响:相似相溶原理在一定程度上与分子间作用力有关。极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂,这是因为相似的分子之间具有较强的分子间作用力,更容易相互溶解。对物质硬度、密度等物理性质也有一定影响。
研究表明,在有些分子之间还存在一种特殊的分子间作用力,称为氢键(hydrgen bnd)。它比一般的分子间作用力强。如水分子间的氢键,是一个水分子中的氢原子与另一个水分子中的氧原子之间所形成的分子间作用力,氢键的存在导致水的熔、沸点较高。在冰晶体中,水分子间形成的氢键比液态水中多,导致冰的微观结构中出现较大的空隙,因此,相同温度下冰的密度比水小。
生命体内许多大分子中存在氢键。氢键对维持生物大分子的空间结构和生理活性具有重要意义。例如,生物的遗传基因本质上就是DNA(脱氧核糖核酸)分子中的碱基顺序,而DNA的双螺旋结构是由两条DNA大分子的碱基(图中的A、T、C、G)通过氢键形成配对的。DNA分子中的氢键在遗传信息的编码和复制等遗传机制中也扮演着相当重要的角色。
微粒间作用力与物质的性质
物质中微粒间作用力的类型与物质性质有着密切关系。例如,干冰中二氧化碳分子间作用力弱,吸热即升华为二氧化碳气体,二氧化碳分子中碳原子和氧原子之间以共价键结合,作用力强,所以二氧化碳分子在加热条件下不易发生分解。又如,在氯化钠晶体中,Na+与Cl-以离子键结合,作用力强,在高温熔融状态下才能形成自由移动的离子,具有导电性。
微粒间作用力模型的应用价值
为了探索物质微粒间广泛存在的相互作用力,科学家从熟悉的典型物质入手(如氯化钠、氯化氢、水等),提出了化学键模型(如离子键、共价键等)和分子间作用力模型等,从微观层面描述了这些作用力的特征,从理论上形成了各类化学键和分子间作用力的概念及一定的适用范围。这些微粒间作用力模型相对简单和理想化,有助于解释一些简单的实验事实。从微粒间作用力的理想模型出发,可以帮助我们进一步认识大量物质中存在的复杂的作用力(如介于离子键和共价键之间的特殊化学键;生物大分子含有离子键、共价键和氢键等),提出新的化学键理论,并预测其可能具有的性质。这也说明理想模型在指导科学实践过程中将不断受到实践的检验,并加以修正和完善。
相关课件
这是一份苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用授课课件ppt,共29页。PPT课件主要包含了关键能力定点破,离子键,共价键,分子间作用力等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用多媒体教学课件ppt,共53页。PPT课件主要包含了离子键,答案D,课堂小结等内容,欢迎下载使用。
这是一份苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用课文ppt课件,文件包含第二单元微粒之间的相互作用力pptx、第1课时离子键docx、第2课时共价键分子间作用力docx等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。










