
江苏省泰州市兴化市2024-2025学年高一上学期10月月考 化学试题(无答案)
展开总分:100分 考试时间:75分钟
一、单选题
1.下列属于电解质的是( )
A.硫酸钡B.CO2C.铜D.乙醇
2.化学有自己独特的语言。下列化学用语表达正确的是( )
A.水溶液中,Na2SO4的电离方程式:Na2SO42Na++S6++O42-
B.水溶液中,NaHCO3的电离方程式:NaHCO3Na++H++CO32-
C.用单线桥表示电子转移过程:
D.钠的原子结构示意图:
3.下列物质按照浊液、溶液、胶体的顺序排列,正确的是( )
A.云、稀盐酸、医用酒精B.葡萄糖溶液、氯水、雾
C.豆浆、冰水混合物、碘酒D.泥水、食盐水、有色玻璃
4.化学实验室的试剂需要善保存。下列有关试剂的保存方法,正确的是( )
A.金属钠——保存在冷水中B.新制氯水——保存在棕色瓶中
C.漂白粉——敞口放在空气中D.过氧化钠——密封保存在细口瓶中
5.符号表征体现化学的学科特质。下列离子方程式书写正确的是( )
A.过氧化钠与水反应:O22-+2H2O2OH-+O2↑
B.氯气与水反应:Cl2+H2O⇌H++Cl-+HClO
C.Cu和稀硫酸反应:Cu+2H+Cu2++H2↑
D.向硫酸铜溶液中滴加氢氧化钡溶液:Cu2++2OH-Cu(OH)2↓
6.下列各组离子在对应条件下一定能大量共存的是( )
A.遇石蕊变红的溶液:Na+、CO32-、NO3-、Ba2+
B.在强酸性溶液中:K+、Na+、SO42-、NO3-
C.遇酚酞变红的溶液:K+、NH4+、SO42-、HCO3-
D.无色溶液:Na+、Cu2+、ClO-、Cl-
7.下列说法错误的是( )
A.氢气在氯气中燃烧是工业制盐酸的方法
B.漂白粉的主要成分是Ca(ClO)2和CaCl2
C.Ca(ClO)2比HClO稳定
D.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
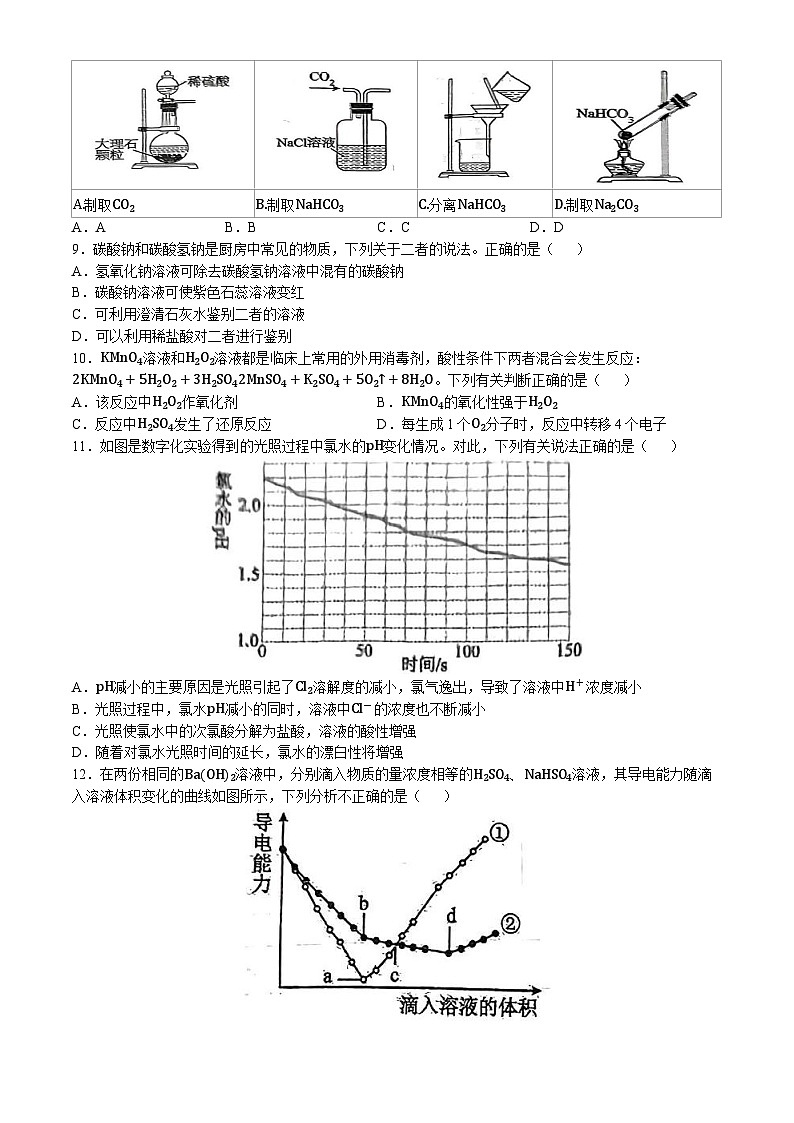
8.以NaCl为原料,可制取纯碱。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl;2NaHCO3ΔNa2CO3+CO2↑+H2O,下列有关实验室模拟侯氏制碱法的实验原理和装置正确的是( )
A.AB.BC.CD.D
9.碳酸钠和碳酸氢钠是厨房中常见的物质,下列关于二者的说法。正确的是( )
A.氢氧化钠溶液可除去碳酸氢钠溶液中混有的碳酸钠
B.碳酸钠溶液可使紫色石蕊溶液变红
C.可利用澄清石灰水鉴别二者的溶液
D.可以利用稀盐酸对二者进行鉴别
10.KMnO4溶液和H2O2溶液都是临床上常用的外用消毒剂,酸性条件下两者混合会发生反应:2KMnO4+5H2O2+3H2SO42MnSO4+K2SO4+5O2↑+8H2O。下列有关判断正确的是( )
A.该反应中H2O2作氧化剂B.KMnO4的氧化性强于H2O2
C.反应中H2SO4发生了还原反应D.每生成1个O2分子时,反应中转移4个电子
11.如图是数字化实验得到的光照过程中氯水的pH变化情况。对此,下列有关说法正确的是( )
A.pH减小的主要原因是光照引起了Cl2溶解度的减小,氯气逸出,导致了溶液中H+浓度减小
B.光照过程中,氯水pH减小的同时,溶液中Cl-的浓度也不断减小
C.光照使氯水中的次氯酸分解为盐酸,溶液的酸性增强
D.随着对氯水光照时间的延长,氯水的漂白性将增强
12.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中酸碱性不同
D.a、d两点对应的体系具有相同的溶质
13.某溶液含有Na+、K+、Mg2+、Cu2+、Cl-、CO32-、SO42-中的几种,为确定组成分别进行如下实验
①取少量原溶液,加入足量的Ba(OH)2溶液,只产生白色沉淀;
②取少量原溶液,加入足量BaCl2溶液,不产生沉淀;
③取少量原溶液,加入足量的AgNO3溶液,产生白色沉淀,再加稀硝酸,白色沉淀不溶解。
则下列说法错误的是( )
A.原溶液一定是无色溶液B.原溶液中一定含有的离子是Mg2+和Cl-
C.配制成该溶液的电解质最多有三种D.实验③可以省略不做
二、填空题
14.(14分)“生活无处不化学”,请回答下列问题。
(1)厨房中的用品①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)、④小苏打。主要成分中具有碱性的是______(填序号,下同);属于盐类的是______;写出③④相互间反应的离子方程式________。
(2)小苏打可用于烘焙糕点,在烘焙受热过程中涉及的化学方程式是________。
(3)漂白粉的有效成分为Ca(ClO)2,现对它进行多角度分析并预测其性质。
①从组成特点分析,Ca(ClO)2属于______(填“氧化物”、“酸”或“盐”)。
②Ca(ClO)2的水溶液可导电,Ca(ClO)2的电离方程式是________。
③Ca(ClO)2与下列物质反应且体现氧化性的是______。
a.空气中的CO2和H2O b.FeSO4 c.KI d.HNO3
15.(17分)消毒是疫情防控的重要措施。含氯消毒剂是高效、安全的杀菌消毒剂。
(1)84消毒液是一种家庭常用消毒剂,其主要成分NaClO,消毒时利用其____性。
(2)一种碱性NaClO溶液吸收SO2的过程如图。
①该过程的总反应的离子方程式是________。
②整个吸收SO2过程中作氧化剂的微粒有______。
(3)亚氯酸钠(NaClO2)是一种消毒能力更强的杀菌剂,消毒效果更持久。将ClO2气体通入NaOH、H2O2混合溶液,得NaClO2同时放出O2,方程式为____。ClO2的氧化性____H2O2的氧化性(填“大于”或“小于”)。
(4)二氧化氯(ClO2)的熔点-59∘C,沸点11∘C,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的ClO2-,可利用酸性FeSO4溶液将ClO2-转化为Cl-除去。
①关于二氧化氯的说法不正确的是____。
A.易液化B.实验室可用排水法收集
C.氯的化合价为+4D.消毒时利用其强还原性
②FeSO4除去ClO2-的离子方程式为____。
16.(15分)亚硝酸钠(NaNO2)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量,某化学兴趣小组设计实验探究NaNO2的性质。
(1)根据NaNO3中N的化合价是____,推测NaNO2有____(填“氧化性”、“还原性”或“氧化性和还原性”)。
(2)已知NaNO2能发生如下反应:2NaNO2+4HI2NO+I2+2NaI+2H2O,用双线桥标出该反应的电子转移方向和数目:____。
(3)实验操作如表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝).
③通过上述实验可知,NaNO2、KMnO4、I2的氧化性由强到弱的顺序为______
④写出实验3中发生反应的化学方程式:____
17.(15分)84消毒液是常用消毒剂,某化学兴趣小组在实验室制备84消毒液并探究其相关性质。
回答下列问题:
Ⅰ.实验室制备84消毒液。
(1)装置甲中盛放浓盐酸的仪器名称是______,装置甲中反应的离子方程式为______。
(2)装置乙的作用是______。
(3)装置丙中制备次氯酸钠为放热反应,该反应需要控制温度在40∘C以下,写出一种(除搅拌外)控制该反应温度的操作方法______。
Ⅱ.探究相关性质
为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。猜测2:……
(4)猜测1中反应的化学方程式为______。猜测2可能为____。
(5)为了验证猜想,某探究小组设计用如图装置进行实验,所选药品有:10%的双氧水、一定浓度的84消毒液、二氧化锰等。该小组通过实验得出猜测1正确,请依据此装置和所给的药品推测该探究小组的实验设计是______。
A.制取CO2
B.制取NaHCO3
C.分离NaHCO3
D.制取Na2CO3
实验
实验操作及现象或结果
结论
1
取5mLNaNO2溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝
NaNO2具有①____
2
取2mLKMnO4溶液(先酸化好)于试管中,滴加足量的NaNO2溶液,可观察到的实验现象为②____
NaNO2具有还原性
3
NaNO2固体与70%硫酸反应生成了NO和NO2两种气体
NaNO2具有氧化性和还原性
江苏省常州高级中学2024-2025学年高一上学期10月月考 化学试题(无答案): 这是一份江苏省常州高级中学2024-2025学年高一上学期10月月考 化学试题(无答案),共7页。试卷主要包含了5 K 39,4L,2L氮气所含的原子数目为,5g某金属氯化物中含有 0,8ml、为1,9℃,热稳定性差等内容,欢迎下载使用。
江苏省无锡市运河实验中学2024-2025学年高一上学期月考化学试题(无答案): 这是一份江苏省无锡市运河实验中学2024-2025学年高一上学期月考化学试题(无答案),共5页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
江苏省宿迁市2024-2025学年高一上学期第一次月考 化学试题(无答案): 这是一份江苏省宿迁市2024-2025学年高一上学期第一次月考 化学试题(无答案),共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












