
广东省茂名市区域2024-2025学年高三上学期10月联考化学试题Word版附答案
展开本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:高考全部内容。
5.可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 S 32 Cl 35.5 Cr 52 C 59
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.文物是人类智慧的结晶和历史进步的标志。下列广东省博物馆馆藏文物主要由金属材料制成的是( )
2.成语是我国传统文化的瑰宝。下列成语不涉及氧化还原反应的是( )
A.水滴石穿B.死灰复燃C.百炼成钢D.火上浇油
3.侯氏制碱法的原理是。关于该反应的叙述正确的是( )
A.与的键角相等B.和的晶体类型相同
C.热稳定性:D.和的VSEPR模型相同
4.性质决定用途。下列物质性质和用途不匹配的是( )
5.下列实验仪器的选用正确的是( )
6.“实践出真知”。下列对劳动实践的相关知识解读错误的是( )
7.马兜铃具有理气止痛、清热解毒、止血等功效。马兜铃酸A是从马兜铃中提取的有效成分之一,其结构简式如图所示。下列关于马兜铃酸A的叙述错误的是( )
A.有3种含氧官能团 B.与溶液能发生显色反应
C.能发生加成、取代反应D.不含手性碳原子
8.下列叙述对应的离子方程式书写正确的是( )
9.四种短周期元素在周期表中的相对位置如图所示。已知:Z的原子序数等于Y的2倍。下列叙述错误的是( )
A.第一电离能:B.最简单氢化物的沸点:
C.电负性:D.和的漂白原理相同
10.设为阿伏加德罗常数的值。下列叙述正确的是( )
A.含配位键数为B.的硫酸溶液含氢离子数为
C.10.4gCr含未成对电子数为D.11.2L(标准状况)HF含电子数为
11.下列对应的实验方法正确且能达到实验目的的是( )
12.陈述Ⅰ和Ⅱ均正确但不具有因果关系的是( )
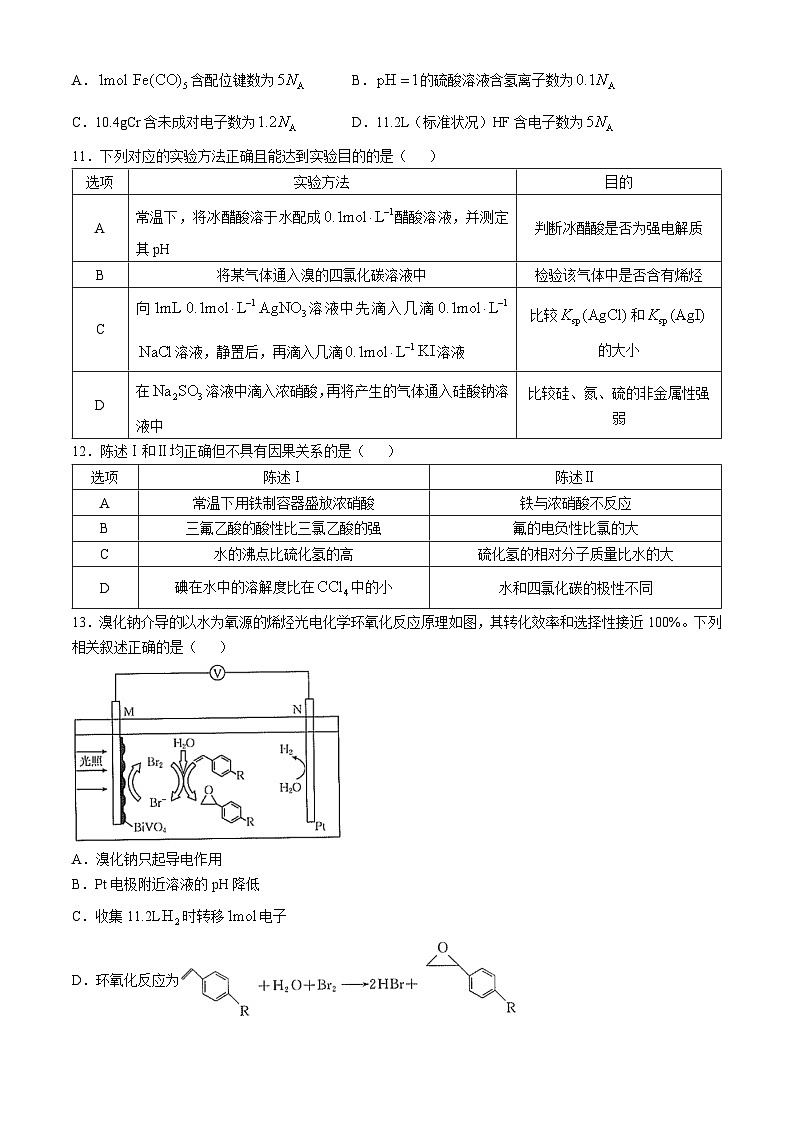
13.溴化钠介导的以水为氧源的烯烃光电化学环氧化反应原理如图,其转化效率和选择性接近100%。下列相关叙述正确的是( )
A.溴化钠只起导电作用
B.Pt电极附近溶液的pH降低
C.收集11.2L时转移电子
D.环氧化反应为
14.铬酸铅()俗称铬黄,难溶于水,常用作颜料。以铅丹()为原料制备铬黄的微流程如下:
已知:Pb与C同主族,原子序数为82。下列叙述错误的是( )
A.基态铅原子的价电子轨道表示式为
B.浓盐酸在反应②中起还原剂和酸的作用
C.过滤分离出铬黄后的滤液中只含两种阴离子
D.气体P依次通过饱和食盐水、浓硫酸可提纯出
15.醛和酮是生产精细化学品和特种化学品不可缺少的中间体或前驱体。醇在金属表面转化为醛或酮的反应历程如图(M表示金属,R为烃基)。下列说法错误的是( )
A.反应过程中生成了金属氢化物B.M降低了醇转化为醛或酮的活化能
C.分子的极性:D.反应过程中有极性键的断裂和形成
16.缓冲溶液指的是由弱酸及其盐或弱碱及其盐组成的混合溶液,能在一定程度上减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH相对稳定,其中当酸和盐浓度相等时缓冲能力最强。常温下,由(简写为HA)及其钠盐组成缓冲溶液,溶液中,调节溶液的pH,测得含碳粒子浓度与pH的关系如图所示。下列叙述错误的是( )
A.代表与pH的关系
B.常温下,M点时混合液缓冲能力最强
C.常温下,、的HA溶液中水的电离程度之比为1:100
D.浓度均为的HA和溶液等体积混合,混合液pH为3.83
二、非选择题:本题共4小题,共56分。
17.(14分)泻盐()被广泛用于临床,如导泻、利胆等。以菱镁矿渣(主要成分是,含少量、、、、、等)为原料制备泻盐的流程如图所示。
已知:常温下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于)时的pH如下表:
回答下列问题:
(1)“酸浸”前常将菱镁矿渣磨成矿粉,其目的是________;滤渣的主要成分为________(填化学式)。
(2)写出加入时发生反应的离子方程式:________。
(3)“调pH”的范围为________~________。
(4)已知、两种物质的溶解度与温度的关系如图1所示。
“操作1”采用蒸发浓缩、________(填操作名称,采用如图2装置操作,夹持装置已略去)。
(5)的热失重曲线如图3所示。
写出b→c过程发生反应的化学方程式:________。
(6)晶体的晶胞结构如图4,其密度为,设1号原子的坐标为,3号原子的坐标为,为阿伏加德罗常数的值。
①2号原子坐标为________。
②和之间的最短距离为________pm。
③之间距离最近且等距离的4个和6个围成的空间结构分别为________、________。
18.(14分)氮化锂()常用作固体电解质、催化剂等。某实验小组设计实验制备氮化锂并探究某些物质性质,实验装置如图所示。
已知部分信息如下:
①几种含铬化合物的颜色如表所示:
②加热生成、、。
③极易潮解。
回答下列问题:
(1)D装置的作用是________。
(2)实验时,先点燃A处酒精灯,后点燃C处酒精灯,这样操作的目的是________。
(3)当A装置中橘黄色粉末全部变为绿色粉末时熄灭A处酒精灯,写出A装置中发生反应的化学方程式:________。
(4)实验完毕后,取A装置中绿色粉末X分装于三支试管中,进行如下实验:
①根据上述实验推知,化学性质与下列物质最相似的是________(填标号)。
a.b.c.d.
②已知:黑色固体Y常用于实验室制备和。写出实验Ⅲ中发生反应的离子方程式:________,由此推知,实验Ⅲ条件下氧化性:________(填“>”“<”或“=”)。
(5)为了测定实验后B装置中固体()组成,进行如下实验:
取2.38gB装置中固体溶于去离子水,配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶中,滴入几滴溶液作指示剂,用溶液滴定至终点,进行三次平行实验,测得消耗溶液的平均体积为20.00mL。
①已知见光易分解,为了减小实验误差,本实验宜选择________(填标号)。
a.酸式滴定管b.碱式滴定管c.棕色酸式滴定管
②________。
19.(14分)过二硫酸()的分子结构如图所示,它是一种强酸,工业上常用作强氧化剂。回答下列问题:
(1)过二硫酸具有强氧化性的原因是________。
(2)工业上,用过二硫酸氧化水可制备双氧水,其总反应()分两步进行:
①;
②________(补充化学方程式)。
(3)工业上,用还可检验废水中的。向废水中滴加溶液,若溶液变为紫红色,则表明超标。写出该反应的离子方程式:________。此反应很慢,添加作催化剂可加快其反应速率,添加的物质宜选择下列物质中的________(填标号)。
A.B.C.D.
(4)能氧化KI,发生反应:,速率方程为(k为速率常数,m、n为反应级数)。实验测得浓度与速率关系如表所示。
①下列措施能使该反应平衡正向移动的是________(填标号)。
a.加水稀释平衡后的混合溶液
b.加入合适的催化剂
c.增大的浓度
②反应级数是________(填标号)。
A.,B.,C.,D.,
(5)某温度下,在烧杯中加入溶液和溶液,发生反应:。测得离子浓度(忽略溶液混合时体积的变化)与时间关系如图所示。
①曲线d代表________(填离子符号)浓度与时间关系。
②0~5min内平均反应速率________。该温度下,该反应的平衡常数K为________。
20.(14分)以甲苯为原料制备羧酸的流程如下:
请回答下列问题:
(1)X的名称为________。Ⅳ中所含官能团的名称为________。
(2)Ⅰ的二氯代物有________种,其中,在核磁共振氢谱上有3组峰的结构简式有________(任写一种)。
(3)根据化合物的结构特征,分析预测其可能具有的化学性质,完成下表。
(4)关于上述Ⅵ→Ⅶ的转化,下列说法正确的有________(填标号)。
A.有键的断裂与形成
B.有手性碳原子形成
C.C原子杂化方式发生改变
(5)在一定条件下,利用原子利用率为100%的反应制备,则反应物分别为________、________(填名称)。
(6)以和为原料合成,基于你设计的合成路线回答下列问题。
①第一步反应的化学方程式为________。
②第二步反应的有机产物的结构简式为________。
茂名区域高三10月份联考
化学参考答案
1.B 2.A 3.D 4.C 5.B 6.C 7.B 8.A 9.D 10.C 11.A 12.C 13.D 14.C 15.C 16.D
17.(1)增大接触面积,使反应快速而充分(1分);、(每个1分,共2分)
(2)(2分)
(3)4.7(1分);8.9(1分)
(4)趁热过滤(1分)
(5)(2分)
(6)①(1分)
②(1分)
③正四面体(1分);正八面体(1分)
18.(1)吸收空气中的,防止水进入C装置(2分)
(2)排尽装置内空气,防止Li与反应(2分)
(3)(2分)
(4)①b(1分)
②(2分);>(2分)
(5)①c(1分)
②6(2分)
19.(1)含有过氧键(1分)
(2)(2分)
(3)(2分);D(1分)
(4)①c(2分)
②C(1分)
(5)①(1分)
②(2分);25(2分)
20.(1)环氧乙烷(1分);羟基(1分)
(2)10(2分);或或(1分)
(3)①的乙醇溶液,加热(有错得0分,1分);(1分)
②(1分);氧化反应(1分)
(4)AC(1分)
(5)乙烯(1分);氧气(与前一空不分先后,1分)
(6)①(或其他合理答案,1分)
②(1分)
文物
选项
A.战国陶匏壶
B.宋金项饰
C.北宋“林景阳舍”木雕罗汉像
D.明永乐白釉暗花大盘
选项
用途
性质
A
液氨常用作制冷剂
液氨汽化时吸收大量热量
B
维生素C用作食品抗氧化剂
维生素C具有还原性
C
用于制造电讯器材
是黑色固体
D
制造米酒时添加酒曲
酒曲起催化作用
A.分离乙醇和水
B.灼烧氢氧化铝
C.吸收气体
D.制取氨气
选项
劳动实践
知识解读
A
用紫外线给碗筷消毒
紫外线可使蛋白质变性
B
用食盐水优选种子
利用了浮力原理
C
用碳酸钠溶液洗去油脂
油脂属于有机酸
D
用天然气灶烧开水
天然气燃烧释放能量
选项
叙述
离子方程式
A
以铜为阳极电解稀硫酸
B
溶于稀硝酸
C
以曾青涂铁,铁赤色如铜
D
在氨水中滴加少量溶液
选项
实验方法
目的
A
常温下,将冰醋酸溶于水配成醋酸溶液,并测定其pH
判断冰醋酸是否为强电解质
B
将某气体通入溴的四氯化碳溶液中
检验该气体中是否含有烯烃
C
向溶液中先滴入几滴溶液,静置后,再滴入几滴溶液
比较和的大小
D
在溶液中滴入浓硝酸,再将产生的气体通入硅酸钠溶液中
比较硅、氮、硫的非金属性强弱
选项
陈述Ⅰ
陈述Ⅱ
A
常温下用铁制容器盛放浓硝酸
铁与浓硝酸不反应
B
三氟乙酸的酸性比三氯乙酸的强
氟的电负性比氯的大
C
水的沸点比硫化氢的高
硫化氢的相对分子质量比水的大
D
碘在水中的溶解度比在中的小
水和四氯化碳的极性不同
阳离子
开始沉淀时的pH
1.6
3.2
7.6
8.9
完全沉淀时的pH
3.1
4.7
9.6
10.9
物质
颜色
绿色
绿色
棕红色
橘黄色
橙红色
序号
操作
现象
Ⅰ
向X中加入稀硫酸,振荡
溶液变为棕红色
Ⅱ
向X中加入溶液,振荡
溶液变为绿色
Ⅲ
向X中加入溶液,煮沸
绿色粉末溶解,产生黑色沉淀Y,溶液变为橙红色
实验
1
0.038
0.060
2
0.076
0.060
3
0.076
0.030
序号
反应试剂、条件
反应形成的新结构
反应类型
①
________
________
消去反应
②
,Cu/△
________
________
广东省茂名市区域2024-2025学年高三上学期10月份联考 化学试题: 这是一份广东省茂名市区域2024-2025学年高三上学期10月份联考 化学试题,共12页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,“实践出真知”,设为阿伏加德罗常数的值等内容,欢迎下载使用。
广东省茂名市区域2024-2025学年高三上学期10月份联考 化学试题: 这是一份广东省茂名市区域2024-2025学年高三上学期10月份联考 化学试题,文件包含高三化pdf、B000544525_5化学72C答案pdf等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。
广东省茂名市区域2024-2025学年高三上学期10月份联考 化学试题: 这是一份广东省茂名市区域2024-2025学年高三上学期10月份联考 化学试题,文件包含高三化pdf、B000544525_5化学72C答案pdf等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。












