






初中化学人教版(2024)九年级下册(2024)课题3 溶质的质量分数教课课件ppt
展开1.掌握一种溶液组成的表示方法——溶质的质量 分数,并能进行溶质质量分数的简单计算。
2.正确理解溶解度与溶质质量分数的关系。
1.溶质质量分数计算公式:
2.溶质质量分数与溶液浓度的关系 溶质的质量分数是溶液浓度的 表示,溶质的质量分数越大,表示溶液 。
3. 溶液的稀释、浓缩、混合的计算 (1)溶液在稀释前后, 保持不变。 (2)溶液的浓缩是指将溶液蒸发水分,使其浓 度变大。溶液在浓缩前后, 保持不变。 (3)将两种溶液混合时,混合前两种溶液中溶 质的质量之和等于 质量。
为什么会出现这样的奇景?
知识点1 溶质质量分数
取一个烧杯,加入250mL水后放入一只鸡蛋。
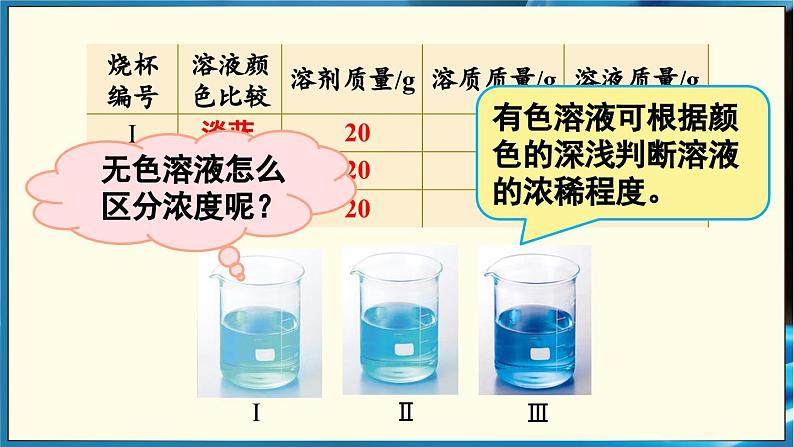
在室温下,向三个小烧杯中各加入20mL水,然后分别加入0.1g、0.5g、2g无水硫酸铜,用玻璃棒搅拌,使硫酸铜全部溶解,比较三种硫酸铜溶液的颜色(如图)。在这三种溶液中,哪种溶液最浓?哪种溶液最稀?你判断的根据是什么?
无色溶液怎么区分浓度呢?
有色溶液可根据颜色的深浅判断溶液的浓稀程度。
思考:对于有色溶液来说,根据颜色的深浅,能区分溶液是浓还是稀。但这种方法比较粗略,不能准确的表明一定量的溶液里究竟含有多少溶质。如何准确地表明一定量溶液中含有的溶质的量?
对“10%的食盐溶液”含义的解释错误的是( )A.100g水中溶解了10g食盐B.100g食盐溶液溶解有10g食盐C.将10g食盐溶解于90g水中所得的溶液D.将食盐与水按1:9的质量比配成的溶液
【实验9-8】在室温下,根据下表给定的质量配制氯化钠溶液,观察固体能否全部溶解,并计算溶液中溶质的质量分数。
知识点2 溶质质量分数的计算
【结论】对于不饱和溶液,溶质的质量分数与溶质质量和溶剂质量的相对大小有关。溶质质量相对越多,溶质的质量分数越大。
已知20 ℃时,氯化钠的溶解度是36 g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
溶质质量分数与溶解度的联系和区别
【例题1】在农业生产中,可利用质量分数为16%的氯化钠溶液选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
知识点2 溶质质量分数的有关计算
溶质质量=溶液质量×溶质的质量分数
溶质质量=溶液质量-溶剂质量
解:溶质质量=溶液质量×溶质的质量分数 =150kg×16%=24kg 溶剂质量=溶液质量-溶剂质量 =150kg-24kg=126kg答:需要24kg氯化钠和126kg水。
这是已知溶液的质量和溶质的质量分数求溶质和溶剂的质量。
下列几种硝酸钾溶液中溶质的质量分数最大的是( )
A.150g水溶解30g硝酸钾;B.15g硝酸钾溶解在85g水中;C.85g硝酸钾溶液中含有15g硝酸钾;D.一定量的硝酸钾溶于80g水中制成100g硝酸钾溶液。
在实验室中用固体配制一定溶质质量分数的溶液,步骤如下: 1.计算所需固体和水的质量; 2.用天平称量固体、量筒量取水; 3.将固体和水混合,并用玻璃棒搅拌,使 固体全部溶解; 4.把配制好的溶液装入试剂瓶,贴上标签, 放入试剂柜。
知识点3 溶液的稀释、浓缩、混合的计算
若要将氯化钠溶液稀释或浓缩,那么如何将溶质的质量分数减小或增大呢?
增加溶质的质量,可使溶质的质量分数增大。
增大溶剂的质量,可使溶质的质量分数减小。
蒸发溶剂可使溶质的质量分数增大。
【例题2】化学实验室有质量分数为98%的浓硫酸,现需要用较稀的硫酸进行实验。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
【分析】溶液稀释前后,溶质的质量不变。
解:设稀释后溶液的质量为x。50g×98%=x×20% x= =245g需要水的质量=245g-50g=195g答:需要水的质量是195g。
解:设需要水的质量为x。则有:50g×98%=(50g+x)×20%解得:x=195g答:需要水的质量是195g。
将50g质量分数为20%的硝酸钾溶液加水稀释到200g,稀释后所得溶液中溶质的质量分数是多少?需加水的质量是多少?
稀释前后溶质的质量不变
解:设稀释后所得溶液中溶质的质量分数为x。 则50g×20%=200g×x,
解得x=5%。 需加水的质量为200g-50g=150g
(1)结晶水合物溶于水,其溶质是不含水的化合物,如CuSO4·5H2O溶解于水,溶质是CuSO4。(2)有些化合物溶于水,与水发生反应,如CaO溶于水:CaO+H2O=Ca(OH)2,其溶质是Ca(OH)2而不是CaO。(3)溶质只能是已经溶解的那一部分,如20℃时, NaCl的溶解度为36g,40gNaCl投入到100g水中,最多只能溶解36gNaCl。
1. 20℃时,氯化钡的溶解度是35.8g,该温度下,将15g氯化钡和20g氯化钡分别加入50g水中,充分溶解后,所得溶液的溶质质量分数分别为( )A.23.1%、26.4% B.23.1%、28.6%C.30%、35.8% D.30%、40%
2. 公共场所可用0.5%的过氧乙酸(化学式为C2H4O3)溶液来消毒。请计算:(1)过氧乙酸中碳、氢、氧三种元素的原子个数比为________。(2)现要配制溶质质量分数为0.5%的过氧乙酸溶液2000g,需要过氧乙酸的质量是______g,需要水的质量是_______g。
3. 把100g质量分数为98%的浓硫酸稀释成10%的稀 硫酸,需要水的质量是多少?
解:100g×98%=[100g+m(水)]×10%, 解得:m(水)=880g。
4.配制500 mL质量分数为10%的氢氧化钠溶液 (密度为1.1 g/cm3),需要氢氧化钠和水的质 量各是多少?
解:m(NaOH)=500mL×1.1g/cm3×10%=55g;m(水)=500mL×1.1g/cm3-55g=495g。
5. 化学实验室现有98%的浓硫酸,但在实验室中常需要用较稀的硫酸,要把100 g上述浓硫酸稀释成质量分数为5%~14%的硫酸。请计算:(1)稀释后的溶液中溶质的质量为多少?(写出计算过程)(2)需要水的质量为多少?(写出计算过程)
解:(1)100g 98%的浓硫酸中溶质的质量为100g×98%=98g,溶液稀释前后溶质的质量不变,故稀释后的溶液中溶质的质量为98g。(2)若稀释成质量分数为5%的稀硫酸,设要加水的质量为x。(100g+x)×5%=98g 解得 x=1860g 若稀释成质量分数为14%的稀硫酸,设要加水的质量为y。(100g+y)×14%=98g 解得y=600g故需要水的质量为600~1860g。
6. 现有8%的硝酸钾溶液50g,使其溶质的质量分数增大到20%:(1)需要蒸发多少克水?(2)需要加入多少克硝酸钾?(3)需要加入多少克40%的硝酸钾溶液?
化学九年级下册(2024)第九单元 溶液课题3 溶质的质量分数教课ppt课件: 这是一份化学九年级下册(2024)<a href="/hx/tb_c4056734_t3/?tag_id=26" target="_blank">第九单元 溶液课题3 溶质的质量分数教课ppt课件</a>,文件包含第2课时溶质质量分数与化学方程式的综合计算pptx、溶液计算―与化学方程式的相关计算mp4等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
人教版九年级下册课题3 溶液的浓度教案配套课件ppt: 这是一份人教版九年级下册<a href="/hx/tb_c76882_t3/?tag_id=26" target="_blank">课题3 溶液的浓度教案配套课件ppt</a>,共12页。PPT课件主要包含了学习目标,重难点,引入新课,教学过程,讲授新课,玻璃棒等内容,欢迎下载使用。
初中化学人教版九年级下册课题3 溶液的浓度说课ppt课件: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c76882_t3/?tag_id=26" target="_blank">课题3 溶液的浓度说课ppt课件</a>,共32页。PPT课件主要包含了学习目标,课程回顾,稀释方法1加溶剂,增浓方法1加溶质,导入新课,y1g,x60g,解得z49g,MgSO4,05%等内容,欢迎下载使用。













