




人教版(2024)九年级下册(2024)课题2 常见的酸和碱课文课件ppt
展开1.认识几种常见酸的主要性质和用途。
2.了解酸的通性及酸具有相似化学性质的原因。
3.认识酸的腐蚀性及使用时的注意事项。
4.了解并记住金属活动性顺序,并能用它来判断某金属与酸能否发生置换反应。
5.掌握酸与金属氧化物的反应。
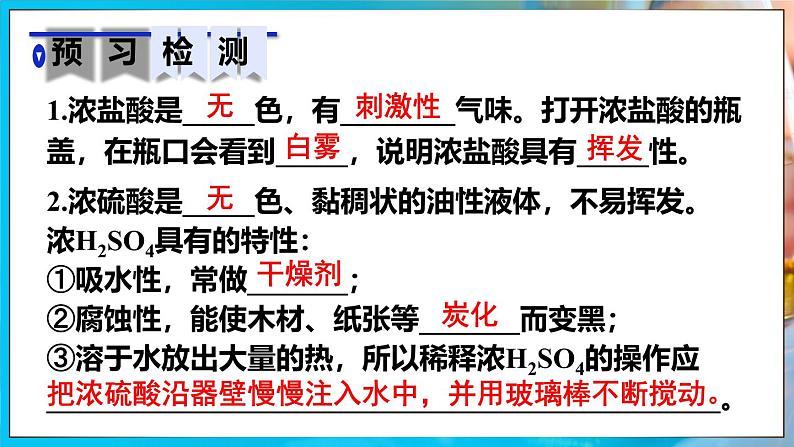
1.浓盐酸是_____色,有________气味。打开浓盐酸的瓶盖,在瓶口会看到_____,说明浓盐酸具有_____性。
2.浓硫酸是_____色、黏稠状的油性液体,不易挥发。浓H2SO4具有的特性:①吸水性,常做_______;②腐蚀性,能使木材、纸张等_______而变黑;③溶于水放出大量的热,所以稀释浓H2SO4的操作应 _______________________________________________。
把浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅动。
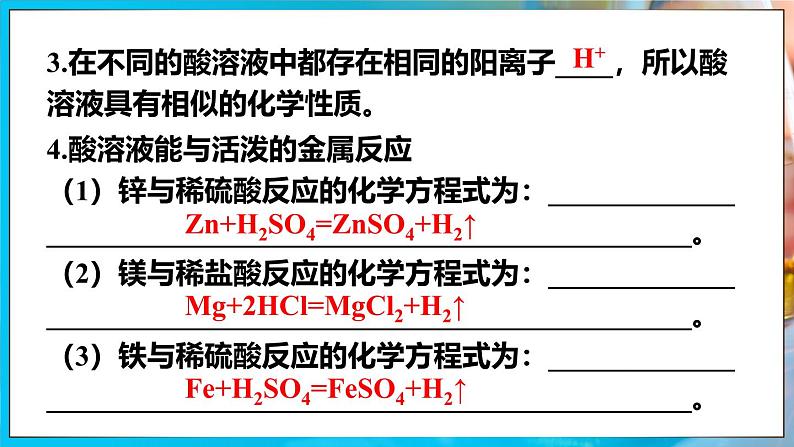
3.在不同的酸溶液中都存在相同的阳离子____,所以酸溶液具有相似的化学性质。
4.酸溶液能与活泼的金属反应(1)锌与稀硫酸反应的化学方程式为:__________________________________________________________。(2)镁与稀盐酸反应的化学方程式为:__________________________________________________________。(3)铁与稀硫酸反应的化学方程式为:__________________________________________________________。
Zn+H2SO4=ZnSO4+H2↑
Mg+2HCl=MgCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
5.酸溶液能与某些金属氧化物反应(1)稀硫酸除铁锈的化学方程式为:_______________ _______________________________________。(2)稀盐酸除铁锈的化学方程式为:______________________________________________________。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
“酸”最早指“有酸味的酒”。在酿酒的时候,有时把比较珍贵的酒放在窖中保存,酒在微生物的作用下会产生酸味。
知识点1 几种常见的酸
在实验室,我们经常用到的酸是盐酸和硫酸。
读法:“×酸”写法:“H×”
它们有哪些性质和用途呢?
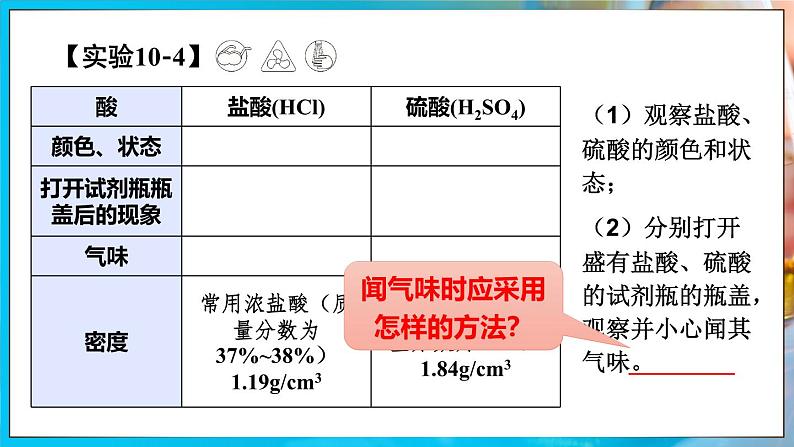
(1)观察盐酸、硫酸的颜色和状态;
(2)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察并小心闻其气味。
闻气味时应采用怎样的方法?
注意:酸有腐蚀性!不要将酸沾到皮肤或衣服上!实验时戴好护目镜。
将纸、小木棍、布放在玻璃片上,完成下列实验。
浓硫酸有强烈的腐蚀性。它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。
使有机物中的氢、氧原子以2∶1的比例脱出(脱水性)
如图所示,将浓硫酸沿烧杯内壁缓慢地注入盛有水的烧杯,用玻璃棒不断搅拌,用温度计测量温度变化。
注意:在稀释浓硫酸时,一定要将浓硫酸沿容器内壁慢慢注入水中,并不断搅拌。切不可将水倒入浓硫酸中。实验时戴好护目镜。
酸入水,不后悔;水入酸,惹祸端!
由于水的密度较小,水会浮在浓硫酸上面,浓硫酸溶解时放出的热能使水立刻沸腾,使硫酸液滴向四周飞溅,非常危险!
如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上质量分数为3%﹣5%的NaHCO3溶液。
人体胃液中含有盐酸,可帮助消化。
浓硫酸有吸水性,在实验室中常用它作干燥剂。
可用来干燥O2、H2、CO2等气体,但不能干燥氨气(NH3),因为NH3能与浓硫酸反应。
【讨论】如果不小心将浓硫酸和浓盐酸露置于空气中很长时间,你能从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?
通过讨论可知:实验室浓硫酸、浓盐酸必须密封保存。
在实验室和化工生产中常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。
生活中常见的许多物质中也含有酸。
柠檬、柑橘等水果中含有柠檬酸
汽车用铅酸蓄电池中含有硫酸
知识点2 酸的化学性质
(1)结合课题1的内容,预测稀盐酸、稀硫酸能使石蕊溶液和酚酞溶液分别呈现什么颜色。
(2)稀盐酸和稀硫酸是否具有相似的化学性质?
(1)如图所示,在白色点滴板上进行实验,观察并记录实验现象。
石蕊溶液遇酸变成红色,酚酞溶液遇酸不变色。
(2)回忆第八单元所学的几种金属分别与稀盐酸和稀硫酸的反应,写出化学方程式。
【分析】以上反应的生成物有什么共同之处?
上述反应都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸+活泼金属 → 盐+氢气(H2)
(3)在分别盛有稀盐酸和稀硫酸的试管中各放入生锈的铁钉,过一会儿取出铁钉,用水洗净,铁钉表面和溶液颜色有什么变化?
【分析】①以上反应的生成物有什么共同之处?
反应的生成物之一都是水,另一生成物是金属离子与酸根离子构成的化合物(盐)。
酸+金属氧化物 → 盐+水
②利用上面的反应可以清除铁制品表面的锈,除锈时能否将铁制品长时间浸在酸中?为什么?
不能长时间浸在酸中,因为酸会与铁继续反应,造成铁制品的腐蚀。
根据以上实验与分析,结合前面学过的知识,归纳稀盐酸、稀硫酸等酸有哪些相似的化学性质。
不能使无色酚酞溶液变色
稀盐酸、稀硫酸等酸为什么会有相似的化学性质呢?
如图所示,分别试验稀盐酸、稀硫酸、蒸馏水和乙醇的导电性(可以将小灯泡换成发光二极管)。
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
酸在水中都能解离出H+和酸根离子,即在不同酸的溶液中都含有H+,所以酸有一些相似的性质。
HCl在水中解离出离子示意图
1.下列关于盐酸和硫酸的说法正确的是( )。A.打开浓盐酸和浓硫酸的试剂瓶瓶塞,瓶口都会出现白雾 B.将浓盐酸和浓硫酸敞口放置,溶质质量分数都会减小 C.浓硫酸具有吸水性,因此能使纸张、布料等炭化变黑 D.人体胃液中含有硫酸,可帮助消化
2.如图表示化学反应中溶液的颜色变化,其中X表示稀盐酸或稀硫酸,则下列叙述错误的是( )。A. a可用于检验溶液X的酸碱性 B. b可能是氧化物 C. c可能是黑色固体 D. d可能是单质
3.将稀盐酸滴入如图所示盛有不同物质的试管中,请回答下列问题。
(1)溶液变成红色的是______(填字母,下同)。(2)溶液变为浅绿色的是______,该溶液中一定含有的阳 离子是______。
(3)溶液变为蓝色的是______,该试管中发生反应的化学 方程式为____________________________________。(4)产生气泡的是______。(5)没有发生化学反应的是______,理由是______________________________________________________________。
顺序中,铜排在氢的后面,不能置换出稀盐酸中的氢
初中化学人教版(2024)九年级下册(2024)课题2 常见的酸和碱说课ppt课件: 这是一份初中化学人教版(2024)九年级下册(2024)<a href="/hx/tb_c4056742_t3/?tag_id=26" target="_blank">课题2 常见的酸和碱说课ppt课件</a>,文件包含第3课时中和反应pptx、媒体1mp4、媒体2mp4、异形的致命血液中和反应mp4、氢氧化钠溶液与稀盐酸反应无酚酞mp4、氢氧化钠溶液与稀盐酸反应有酚酞mp4等6份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
人教版(2024)九年级下册(2024)课题2 常见的酸和碱授课课件ppt: 这是一份人教版(2024)九年级下册(2024)<a href="/hx/tb_c4056742_t3/?tag_id=26" target="_blank">课题2 常见的酸和碱授课课件ppt</a>,文件包含第2课时常见的碱pptx、探究氢氧化钙的物理性质实验mp4、探究氢氧化钠的物理性质实验mp4、碱与指示剂反应mp4等4份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
2021学年课题1 常见的酸和碱精品ppt课件: 这是一份2021学年课题1 常见的酸和碱精品ppt课件,文件包含人教九下第10单元课题1常见的酸和碱第三课时pptx、氢氧化钙的性质mp4、氢氧化钠对指示剂的作用asf、氢氧化钠的性质mp4、物质的导电性mp4、石灰水对指示剂的作用asf、碱与某些非金属氧化物反应mp4等7份课件配套教学资源,其中PPT共28页, 欢迎下载使用。













