


北京市第一零一中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析)
展开
这是一份北京市第一零一中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析),文件包含北京市第一○一中学2024-2025学年高三上学期10月月考化学试题Word版含解析docx、北京市第一○一中学2024-2025学年高三上学期10月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。
本试卷共10页,100分。考试时长90分钟。考生务必将答案答在答题纸卡上,在试卷上作答无效。考试结束后,交答题卡。
可能用到的相对原子质量:P31 S32
第一部分
本部分共14道题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是
A. 三种物质中均有碳碳原子间的键B. 三种物质中的碳原子都是杂化
C. 三种物质的晶体类型相同D. 三种物质均能导电
【答案】A
【解析】
【详解】A.原子间优先形成键,三种物质中均存在键,A项正确;
B.金刚石中所有碳原子均采用杂化,石墨中所有碳原子均采用杂化,石墨炔中苯环上的碳原子采用杂化,碳碳三键上的碳原子采用杂化,B项错误;
C.金刚石为共价晶体,石墨炔为分子晶体,石墨为混合晶体,C项错误;
D.金刚石中没有自由移动电子,不能导电,D项错误;
故选A。
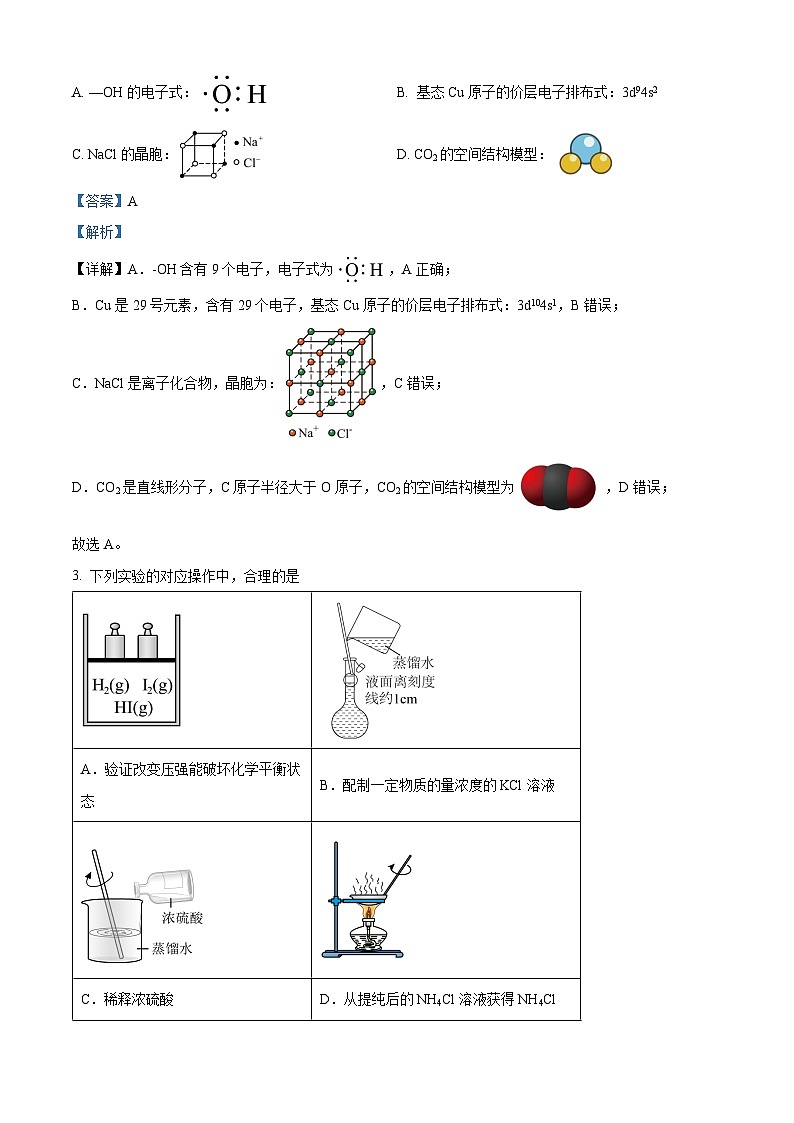
2. 下列化学用语或图示表达正确的是
A. —OH的电子式:B. 基态Cu原子的价层电子排布式:3d94s2
C. NaCl的晶胞:D. CO2的空间结构模型:
【答案】A
【解析】
【详解】A.-OH含有9个电子,电子式为,A正确;
B.Cu是29号元素,含有29个电子,基态Cu原子的价层电子排布式:3d104s1,B错误;
C.NaCl是离子化合物,晶胞为:,C错误;
D.CO2是直线形分子,C原子半径大于O原子,CO2的空间结构模型为,D错误;
故选A。
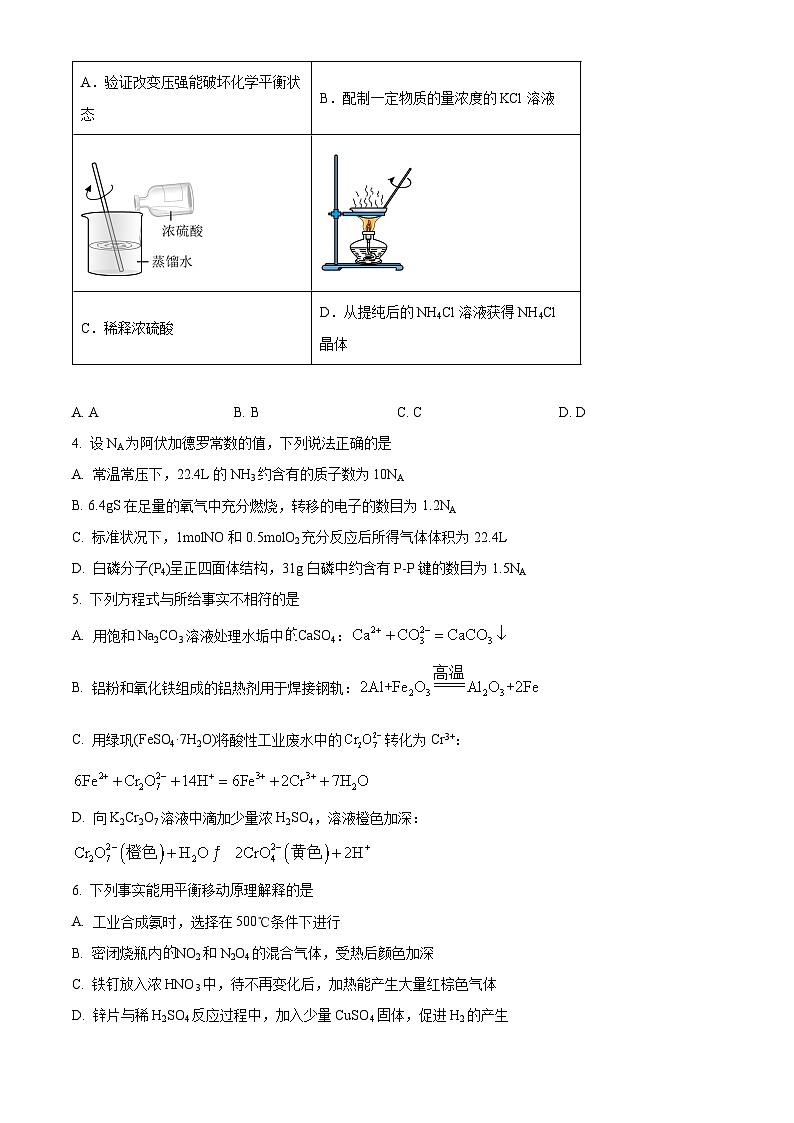
3. 下列实验的对应操作中,合理的是
A. AB. BC. CD. D
【答案】C
【解析】
【详解】A.,该反应为等体积反应,压强不能改变化学平衡状态,A错误;
B.配制一定物质的量浓度的KCl溶液,加蒸馏水至液面离刻度线1cm~2cm处时应改用胶头滴管滴加,B错误;
C.浓硫酸的密度比水的密度大,浓硫酸溶于水放热,故稀释浓硫酸时应将浓硫酸沿烧杯内壁缓慢倒入盛水的烧杯中,并用玻璃棒不断搅拌,C正确;
D.氯化铵受热易分解,不能通过蒸发结晶获得NH4Cl晶体,应采用蒸发浓缩、冷却结晶的方法,D错误;
故选C。
4. 设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,22.4L的NH3约含有的质子数为10NA
B. 6.4gS在足量的氧气中充分燃烧,转移的电子的数目为1.2NA
C. 标准状况下,1mlNO和0.5mlO2充分反应后所得气体体积为22.4L
D. 白磷分子(P4)呈正四面体结构,31g白磷中约含有P-P键的数目为1.5NA
【答案】D
【解析】
【详解】A.常温常压下,气体摩尔体积大于22.4L/ml,22.4L的NH3物质的量小于1ml,含有质子数小于10NA,A错误;
B.S在足量的氧气中充分燃烧生成二氧化硫,S从0价升高到+4价,失去4个电子,6.4S的物质的量为0.2ml,故转移电子数为0.8NA,B错误;
C.NO与O2反应的方程式为,1mlNO和0.5mlO2充分反应得到1ml,但会发生反应,故所得气体小于1ml,标准状况下,气体体积小于22.4L,C错误;
D.白磷分子(P4)呈正四面体结构,一个P4含有6个P-P键,31g白磷的物质的量为,故含有P-P键的数目为1.5NA,D正确;
故选D。
5. 下列方程式与所给事实不相符的是
A. 用饱和Na2CO3溶液处理水垢中的CaSO4:
B. 铝粉和氧化铁组成的铝热剂用于焊接钢轨:
C. 用绿巩(FeSO4·7H2O)将酸性工业废水中的转化为Cr3+:
D. 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:
【答案】A
【解析】
【详解】A.用碳酸钠溶液处理锅炉水垢中的硫酸钙,实现硫酸钙转化为易溶于酸的碳酸钙,离子方程式为:,A符合题意;
B.铝粉和氧化铁组成的铝热剂,高温反应生成液态铁和氧化铝,,用于焊接钢轨,B不合题意;
D.可以将氧化成,本身还原生成Cr3+,离子方程式,C不合题意;
向K2Cr2O7溶液中滴加少量浓H2SO4,,平衡逆向移动,溶液橙色加深:,D不合题意;
答案选A。
6. 下列事实能用平衡移动原理解释的是
A. 工业合成氨时,选择在500℃条件下进行
B. 密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C. 铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D. 锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
【答案】B
【解析】
【详解】A.合成氨反应为放热反应,升高温度平衡逆向移动,不利于生成氨气,选择在500℃条件下进行是为了反应速率和催化剂活性,A错误;
B.NO2转化为N2O4 的反应是放热反应,升温平衡逆向移动, NO2浓度增大,混合气体颜色加深,B正确;
C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C错误;
D.加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D错误;
故选B。
7. 硒代半胱氨酸(含C、H、N、O、34Se五种元素)是一种氨基酸,其分子空间结构如图。下列说法不正确的是
A. 图中最大的球代表Se
B. H2Se的沸点小于H2O
C. 硒代半胱氨酸难溶于水,易溶于苯
D. 硒代半胱氨酸分子中含一个手性碳原子
【答案】C
【解析】
【详解】A.硒代半胱氨酸中硒原子的电子层数最多,原子半径最大,则图中最大的球代表硒原子,A正确;
B.H2O中含有分子间氢键,故H2Se的沸点小于H2O,B正确;
C.由分子空间结构可知,硒代半胱氨酸分子中含有亲水基氨基和羧基,所以硒代半胱氨酸易溶于水,C错误;
D.由分子空间结构可知,硒代半胱氨酸分子中与氨基和羧基相连碳原子是连有4个不同原子或原子团的手性碳原子,D正确;
故选C。
8. 氘代氨()可用于反应机理研究。下列两种方法均可得到:①与的水解反应;②与反应。下列说法不正确的是
A. 和可用质谱法区分
B. 和均为极性分子
C. 方法①的化学方程式是
D. 方法②得到的产品纯度比方法①的高
【答案】D
【解析】
【详解】A.和的相对分子质量不同,可以用质谱法区分,A正确;
B.和的H原子不同,但空间构型均为三角锥形,是极性分子,B正确;
C.Mg3N2与D2O发生水解生成Mg(OD)2和ND3,反应方法①的化学方程式书写正确,C正确;
D.方法②是通过中D原子代替中H原子的方式得到,代换的个数不同,产物会不同,纯度低,D错误;
故选D。
9. 下列依据相关数据作出的推断中,不正确的是
A. 依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向
B. 依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大
C. 依据F、Cl、Br、I的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
D. 根据C=C的键能小于C—C的键能的2倍,推测C=C中键的强度比π键的大
【答案】B
【解析】
【详解】A.依据相同温度下可逆反应Q与K大小的比较可知:Q=K,反应达到平衡状态;QK,反应逆向进行,则可推断反应进行的方向,A正确;
B.依据第二周期主族元素电负性依次增大,不能推断它们的第一电离能依次增大,如第一电离能:Be>B,N>O,B错误;
C.F、Cl、Br、I的氢化物分子中氢卤键的键能越大,氢化物的热稳定性越强,则依据F、Cl、Br、I的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱,C正确;
D.C=C中有1个键和1个π键,C—C中只有一个σ键,根据C=C的键能小于C—C的键能的2倍,可推测C=C中键的强度比π键的大,D正确;
故选B。
10. 一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是
A. a、c分别是HCl、
B. d既可以是MgO,也可以Mg(OH)Cl
C. 等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
D. 已知为副产物,则通入水蒸气可减少的产生
【答案】D
【解析】
【分析】Mg(OH)Cl可以分解为MgO和HCl,因此b为Mg(OH)Cl,c为HCl,d为MgO,MgO与NH4Cl反应生成Mg(OH)Cl和NH3,即a为NH3。
【详解】A.由分析得,a为NH3、c为HCl,故A错误;
B.d为MgO,故B错误;
C.反应①和反应②相加即为氯化铵直接分解的反应,由盖斯定律可知,等压条件下,反应①、反应②的反应热之和等于氯化铵直接分解的反应热,故C错误;
D.可以水解生成Mg(OH)Cl,因此通入水蒸气可减少的产生,故D正确;
故选D。
11. 过渡金属氧化物离子(以MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下图所示。
下列说法不正确的是
A. 反应速率:步骤ⅠK,ⅰ中平衡正向移动
C. ②中加水,溶液变红,说明平衡逆向移动,的浓度增大
D. ③中加入,溶液变红,推测与形成了配合物
【答案】D
【解析】
【详解】A.由实验1,降温平衡逆向移动,逆向为放热方向,正向为吸热反应,A错误;
B.①中滴加浓盐酸,增大了,导致QAl
c.热稳定性:Na2CO3>NaHCO3 d.碱性:NaOH>Mg(OH)2
(3)比较Br和I的非金属性,从原子结构角度解释原因_______,用一个离子方程式证明_______。
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。
①R位于_______区,单质与水反应的离子方程式为_______。
②1mIY单质的晶体中含有共价键的数目为_______。写出Y的氧化物的一种用途_______。
③X的氢化物的空间结构是_______,用电子式表示其形成过程_______。
【答案】(1)第四周期第Ⅷ族
(2)bd (3) ①. 非金属性:Br>I.Br和I位于同一主族,最外层电子数相同,电子层数BrI ②.
(4) ① s ②. ③. 2NA(或1.204×1024) ④. 光导纤维(制玻璃等) ⑤. 三角锥形 ⑥.
【解析】
【小问1详解】
Fe为56号元素,为第四周期第Ⅷ族元素;
故答案为:第四周期第Ⅷ族;
【小问2详解】
a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,H2SO3中的S为+4价,不属于最高价含氧酸,则无法吕勇元素周期律判断酸性,故a错误;
b.同主族元素从上到下金属性依次增强,从左到右金属性减弱,则金属性Ca>Mg>Al,故b正确;
c.酸式碳酸盐易分解,碳酸盐难分解,则热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,故c错误;
d.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,故d正确;
故答案为:bd;
【小问3详解】
非金属性:Br>I,Br和I位于同一主族,最外层电子数相同,电子层数BrI;根据氧化性强的物质置换氧化性弱的物质原理,Br2+2I−=I2+2Br−;
故答案为:非金属性:Br>I,Br和I位于同一主族,最外层电子数相同,电子层数BrI;Br2+2I−=I2+2Br−;
【小问4详解】
R、X、Y、Z为同一短周期元素,根据图知,Y能形成4个共价键、Z能形成1个共价键,则Y位于第IVA族、Z位于第VIIA族,且Z核外最外层电子数是Y核外电子数的一半,Z最外层7个电子,则Y原子核外有14个电子,故Y为Si元素,Z为Cl元素;该阴离子中Cl元素为-1价、Si元素为+4价,根据化合价的代数和为-1价可知,X为-3价,则X为P元素;根据阳离子所带电荷知,R为Na元素,据此解答,通过以上分析知:R、X、Y、Z分别为Na、P、Si、Cl元素;
①由分析知:R为Na,位于第三周期第ⅠA,属于s区,钠与水反应生成氢氧化钠和氢气;
故答案为:s;;
②Y单质晶体为硅单质,则1mlSi,共价键数目为2NA(或1.204×1024);硅形成的氧化物,SiO2可以用作光导纤维(制玻璃等);
故答案为:2NA(或1.204×1024);光导纤维(制玻璃等);
③X为P元素,其氢化物的分子式为PH3,是共价化合物,价层电子对数为,为三角锥形,则其电子式为 ;
故答案为:三角锥形;。
16. 向CCl2溶液中滴加过量的氨水得到含有[C(NH3)6]Cl2的溶液。
(1)基态C2+的核外电子有_______种空间运动状态。
(2)基态Cl-占据的最高能级的电子云轮廓图的形状是_______。
(3)O、N、H的电负性由大到小的顺序是_______。
(4)下列状态的氮中,电离最外层一个电子所需能量最小的是_______(填序号)。
a. b. c.
(5)[C(NH3)6]Cl2的晶胞结构示意图如下。
①在下图虚线框内画出[C(NH3)6]2+中一个NH3的结构式_______。
②比较H—N—H键角NH3_______[C(NH3)6]2+(填“>”“N>H (4)c
(5) ①. ②. < ③. 氮原于均为sp3杂化,NH3分子中的N原子有孤电子对,[C(NH3)6]2+中的N原子无孤电子对,孤电子对有较大斥力 ④.
【解析】
【小问1详解】
C 是27号元素,其基态原子的价电子排布式为3d74s2,则基态C2+的核外电子排布式为,核外电子有14种空间运动状态;
【小问2详解】
氯离子基态核外电子排布式为1s22s22p63s23p6,其最高能级为3p,电子云轮廓图的形状是哑铃形;
【小问3详解】
同周期主族元素从左到右,元素的电负性逐渐增大,则电负性:O>N,三种元素中H的电负性最小,于是有电负性:O>N>H;
【小问4详解】
2s22p2属于基态的N+,由于基态N的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高;2s22p3属于基态N原子,其失去一个电子变为基态N+,其失去一个电子所需能量低于基态N+;2s22p23s1属于激发态N原子,其失去一个电子所需能量低于基态N原子;综上所述,电离最外层一个电子所需能量最小的是2s22p23s1,故选c。
【小问5详解】
①中心N原子孤电子对数=,有3个键,则中心N原子价层电子对数=3+1=4,采取sp3杂化,空间构型为三角锥形,且N原子形成了1个配位键,则答案为:;
②由①分析知,由于NH3中心N原子有一对孤电子对,排斥力较大,则H-N-H键角小于109°28′,约为107°,[C(NH3)6]2+形成配位键,氨分子中不再有孤电子对,H—N—H键角变大,故答案为<;
③该晶胞中,[C(NH3)6]2+位于顶点和面心的个数为,位于晶胞内部Cl-个数为8,故晶胞的密度为 g/cm3。
17. 烟气脱硝技术是环境科学研究的热点。实验室模拟将烟气中的深度氧化为,并进一步将转化获得含氮产品,流程示意图如下。
深度氧化器中发生的反应:
i.
ii.
iii.
(1)被深度氧化,补全热化学方程式:
___________
(2)一定条件下,不同温度时,的浓度随时间的变化如图所示。
①___________(填“>”或“
相关试卷
这是一份北京市第一六一中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析),文件包含北京市第一六一中学2024-2025学年高三上学期10月月考化学试卷Word版含解析docx、北京市第一六一中学2024-2025学年高三上学期10月月考化学试卷Word版无答案docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
这是一份北京市第三十五中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析),文件包含北京第三十五中学2024-2025学年高三10月月考化学Word版含解析docx、北京第三十五中学2024-2025学年高三10月月考化学Word版无答案docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
这是一份北京市第九中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析),文件包含北京市第九中学2024-2025学年高三上学期10月月考化学试题Word版含解析docx、北京市第九中学2024-2025学年高三上学期10月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。








