




北京市理工大学附属中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析)
展开可能用到的相对原子质量:H1 C12 O16 Na23 Cl35.5 Cu64
一、选择题(每小题只有一个选项符合题意,每小题3分,共42分)
1. 2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。量子点是指尺寸在纳米量级(通常2~20nm)的半导体晶体,其中铜铟硫(CuInS2)量子点被广泛用于光电探测、发光二极管以及光电化学电池领域。下列说法不正确的是
A. 制备过程中得到的CuInS2量子点溶液能够产生丁达尔效应
B. 可利用X射线衍射技术解析量子点的晶体结构
C. 已知In的原子序数为49,可推知In位于元素周期表第四周期
D. 基态Cu+的价层电子排布式为3d10
2. 下列化学用语或图示表达不正确的是
A. 的电子式
B. 乙醇的分子填充模型:
C. 电子云图为
D. 的空间结构模型为
3. 下列有关性质的比较,能用元素周期律解释的是
A. 熔点:SiO2>CO2B. 酸性:H2SO3>H2CO3
C. 碱性:NaOH>LiOHD. 热稳定性:Na2CO3>NaHCO3
4. 下列变化中,气体反应物既被氧化又被还原的是
A. 金属钠露置在空气中迅速变暗
B. 露置在空气中的过氧化钠固体变白
C. 充满二氧化氮的试管倒扣在水槽中,试管内液面上升
D. 将氨气与氯化氢混合,产生大量白烟
5. 在淀粉碘化钾溶液中加入少量次氯酸钠溶液,振荡后溶液变蓝,再加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断错误的是
A. 氧化性:ClO->SO42->I2
B. 漂粉精溶液可使淀粉碘化钾试纸变蓝
C. ClO-与I-碱性条件下可以发生氧化还原反应
D. 向新制氯水中加入足量亚硫酸钠溶液,氯水褪色
6. 一定温度下,在2 L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是
A. a点时,υ(A) =υ(B)
B. 反应开始到5min,B的物质的量增加了0.2 ml
C. 反应的化学方程式为:3A2B+C
D. 反应开始到5min,υ(C) =0.04 ml/(L·min)
7. 为阿伏加德罗常数的值。下列说法正确的是
A. 溶液含有的个数为
B. 重水中所含质子数为
C. 乙烯和丙烯的混合气体中含有的碳原子数为
D. 溶液中,、数目之和为
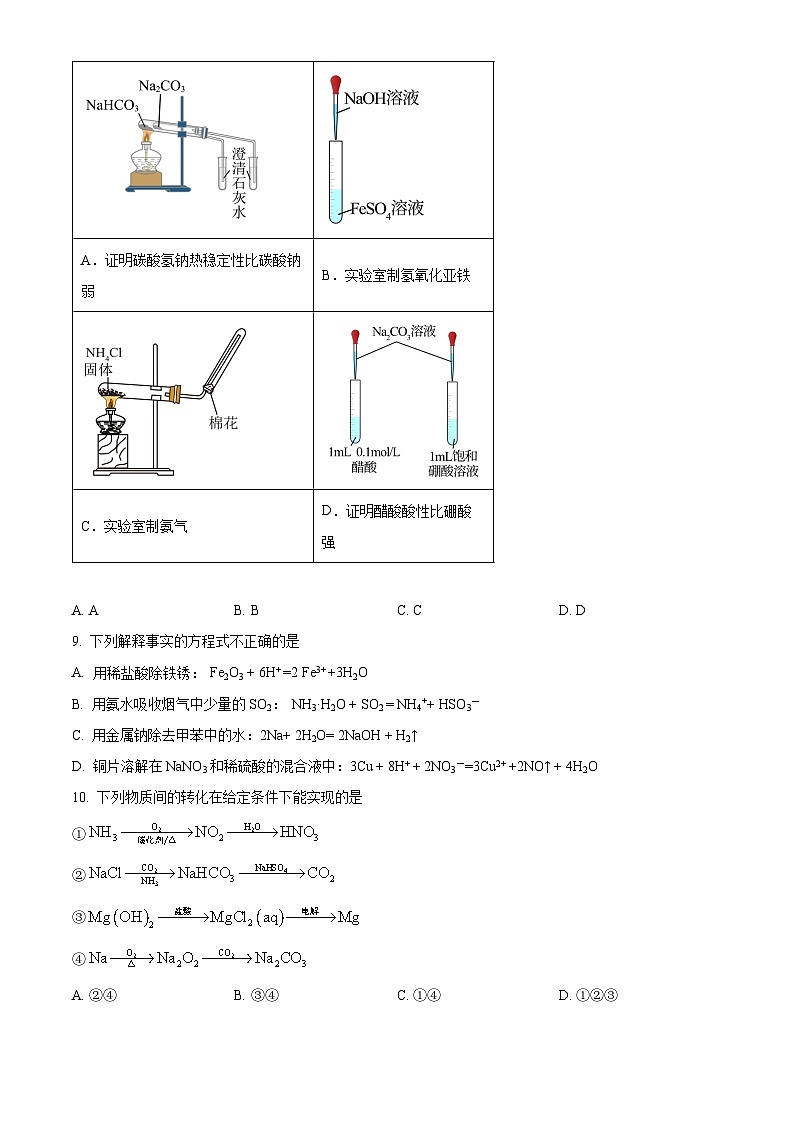
8. 下列实验方案能达到实验目的的是(部分夹持装置已略去)
A. AB. BC. CD. D
9. 下列解释事实的方程式不正确的是
A. 用稀盐酸除铁锈: Fe2O3 + 6H+ =2 Fe3+ +3H2O
B. 用氨水吸收烟气中少量的SO2: NH3·H2O + SO2 = NH4++ HSO3-
C. 用金属钠除去甲苯中的水:2Na+ 2H2O= 2NaOH + H2↑
D. 铜片溶解在NaNO3和稀硫酸的混合液中:3Cu + 8H+ + 2NO3-=3Cu2+ +2NO↑ + 4H2O
10. 下列物质间的转化在给定条件下能实现的是
①
②
③
④
A. ②④B. ③④C. ①④D. ①②③
11. 将CCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[C(H2O)6]2++4Cl-[CCl4]2-+6H2O△H。用该溶液做实验,溶液的颜色变化如图:
已知:[C(H2O)6]2+粉红色、[CCl4]2-蓝色、[ZnCl4]2-无色,下列结论和解释正确的是
A. [C(H2O)6]2+和[CCl4]2-的C2+配位数之比为2︰3
B. 由实验①可知平衡逆向移动
C. 由实验②可推知△H<0
D. 由实验③可知配离子的稳定性:[ZnCl4]2-<[CCl4]2-
12. 向碘水中加入KI溶液,发生反应:,充分反应达平衡后,测得微粒浓度如下:
下列说法不正确的是
A. 向所得溶液中加入,振荡静置,水层降低
B. 向所得溶液中加入等体积水,
C. 该温度下,反应的
D. 配制碘水时,加入少量KI,可促进的溶解
13. 用下图装置探究Cl2的漂白原理,其中红纸①是干燥的,红纸②~④分别用下表中的试剂润湿。向中心Ca(ClO2)2粉末上滴加几滴盐酸,产生大量黄绿色气体,红纸变化如下:
已知酸性:H2CO3>HClO>,下列对于该实验的分析不正确的是
A. 对比①②的现象,说明红纸褪色涉及的反应是Cl2+H2O⇌HCl+HClO
B. 对比②③的现象,说明能使红纸褪色的微粒是HClO
C. 对比②④的现象,说明能使红纸褪色的微粒一定不是H+
D. 对比②③④的现象,说明c(HClO)越大,漂白效果越好
14. 某实验小组用如下实验测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法不正确的是:
A. 溶液b为蓝色是因为发生了反应:H2O2+2I-+2H+=I2+2H2O
B. 该实验可证明蓝色恢复与空气无关
C. 溶液反复由无色变蓝的原因可能是H2O2氧化I-的反应速率比Na2S2O3还原I2的反应速率快
D. 上述实验不能准确测定待测液中的碘含量,应补充实验步骤:滴定前向溶液b中加少量MnO2,反应至不再产生气泡,过滤,对滤液进行滴定
二、填空题(共58分)
15. 自然界中的局部氮循环如下图。
(1)上图含氮物质的各步转化中,属于氮的固定的是______( 填数字序号)。
(2) NH3是氮循环中的重要物质,工业合成氨反应的化学方程式为_____________。
(3)某化工厂出现泄漏,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH发生波动,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是_____ ( 填字母序号)。
a过量氨进入循环水后,水中NO和NO 含量会升高
b.过量氨进入循环水后,不会导致水体富营养化
c.循环水pH的波动中,pH的上升与氨水的碱性有关
d.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的c(NO)可判断循环水的水质是否恶化,c(NO)检测利用的是酸性条件下I- 被NO 氧化为I2的反应,该反应的历程如下:
I. NO+2H+= NO++H2O
II ……
III.2ONI= I2+2NO
II的离子方程式为___________。
(4)含NO 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14NO+ 5FeS2+___H+ 7N2↑+10SO+___________
16. 我国科学家制备了一种ZnPc/C60太阳能电池,其结构示意图如下。
(1)铝元素属于_____________区(填“s”“d”“”或“p”)。
(2)C60分子中60个碳原子都是等价的,均以近似_____________杂化的方式形成3个不共平面的σ键,余下的1个p轨道电子互相重叠形成闭壳层电子结构,π电子云分布在C60分子笼的内外层表面上。循环伏安测试表明:C60在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
(3)①ZnPc中Zn2+的价层电子排布式是_____________。
②ZnPc中存在配位键的原因是_____________。
(4)某溶剂中,ZnPc可以和C60形成分子间电荷转移复合物,反应方程式可表示为:ZnPc+C60ZnPc-C60,不同温度下生成电荷转移复合物的平衡常数如下表。
反应:ZnPc+C60ZnPc-C60△H_____________0(填“>”或“<”),ZnPc-C60中ZnPc是电子_____________(填“给体”或“受体”)。
(5)LiF晶体结构属于氯化钠型,其晶胞结构如图所示。
①LiF的熔点和沸点比NaCl的高,请解释原因_____________。
②LiF晶体的密度约为2.6g/cm3,LiF晶胞的体积约为_____________cm3(计算结果保留一位有效数字)。
17. 将富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。
(1)一种富集烟气中的方法示意图如下:
写出“解吸”过程产生的化学方程式:_______。
(2)性质稳定,使其活化是实现转化的重要前提。
①使用过渡金属作催化剂,提供空轨道接受_______(填“C”或“O”)原子的孤电子对,破坏的结构使其活化。
②采用电化学、光化学等手段,使_______(填“提供”或“接受”)电子转化为
(3)与在催化剂作用下可转化为,体系中发生的主要反应如下:
i.
ii.
研究表明,CO与也能生成,写出该反应的热化学方程式:_______。
(4)在催化剂作用下,将1ml、3ml投入反应器,反应温度对平衡转化率、选择性的影响如下。
已知:
①随温度升高逐渐增大、随温度升高逐渐减小的原因是_______。
②在240℃达到平衡时,体系_______(填“吸收”或“放出”)的热量为_______kJ(除了反应ⅰ和ⅱ不考虑其他反应)。
18. 工业上,处理低品位黄铜矿[二硫化亚铁铜含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾和胆矾。相关流程如下图。
已知:①生物堆浸使用的氧化亚铁硫杆菌(T。f细菌)在pH 1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)生物堆浸前,需先将矿石进行研磨,目的是___________。
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
第二阶段反应为继续被氧化转变成,反应的离子方程式为___________。
(3)结合已知推断:生物堆浸过程中,应控制溶液的pH在___________范围内。
(4)过程Ⅰ中,加入固体还原堆浸液中的,得到溶液X。为判断堆浸液中是否被还原完全,可取少量溶液X,向其中加入___________试剂(填试剂的化学式),观察溶液颜色变化。
(5)过程Ⅱ中,用和稀硫酸处理后,CuS完全溶解,用离子方程式表示的作用是___________。
(6)绿矾的纯度可通过滴定法测定。取m g绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为c ml/L的溶液滴定。至恰好完全反应时,消耗溶液的体积为V mL。绿矾晶体质量分数的计算式为___________。(已知:摩尔质量为278g/ml)
(7)用晶体配制溶液,放置一天后发现产生黄色固体。实验测定溶液放置过程中溶液的pH和黄色固体的量的变化,结果如下:
分析黄色固体中除、还可能含有___________离子。
19. 某小组用实验1验证FeCl3与Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
资料:
i. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42-、Cu2+与Cl-。
ii. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________________。
(2)下列由实验1得到的推论中,合理的是_______________(填字母序号)。
a. Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
由实验2可知,实验1中白色沉淀的成分是____。
(4)该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:
①步骤I的实验操作是_____________________。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是______。
③步骤II中加入KSCN溶液后出现红色的可能原因是________________。
④解释步骤III中实验现象产生的可能原因:_______________________。A.证明碳酸氢钠热稳定性比碳酸钠弱
B.实验室制氢氧化亚铁
C.实验室制氨气
D.证明醋酸酸性比硼酸强
微粒
浓度
红纸编号
试剂
红纸变化
①
-
不褪色
②
蒸馏水
逐渐褪色
③
饱和食盐水
几乎不褪色
④
NaHCO3溶液调至中性(pH=7)
快速褪色
温度
生成ZnPc-C60的K
24℃
1.2329
44℃
0.9674
64℃
0.4923
开始沉淀时的pH
1.5
4.2
6.3
完全沉淀时的pH
2.8
6.7
8.3
1小时
6小时
24小时
溶液pH
2.39
2.35
1.40
黄色固体的量
几乎没有
少量
大量
步骤
实验操作
实验现象
I
溶液变为蓝色,澄清透明,底部只有少量红色固体剩余
II
取I中上层清液于试管中,滴加1滴 01ml/L KSCN溶液
立刻出现红色,同时有白色沉淀生成
III
振荡II中试管,静置
白色沉淀变多,红色逐渐褪去
北京市清华大学附属中学2024-2025学年高三上学期9月检测化学试卷(Word版附解析): 这是一份北京市清华大学附属中学2024-2025学年高三上学期9月检测化学试卷(Word版附解析),文件包含北京清华大学附属中学2024-2025学年高三上学期化学9月检测试题Word版含解析docx、北京清华大学附属中学2024-2025学年高三上学期化学9月检测试题Word版无答案docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
北京市广渠门中学2024-2025学年高三上学期9月月考化学试卷(Word版附解析): 这是一份北京市广渠门中学2024-2025学年高三上学期9月月考化学试卷(Word版附解析),文件包含北京市广渠门中学2024-2025学年高三上学期9月月考化学试题Word版含解析docx、北京市广渠门中学2024-2025学年高三上学期9月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
北京市第九中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析): 这是一份北京市第九中学2024-2025学年高三上学期10月月考化学试卷(Word版附解析),文件包含北京市第九中学2024-2025学年高三上学期10月月考化学试题Word版含解析docx、北京市第九中学2024-2025学年高三上学期10月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。












