

四川省达州市万源中学2024-2025学年高二上学期期中考试 化学试题
展开(时间:75分钟 总分:100分 )
可能用到的相对原子质量:O-16 Na-23 Fe-56 Cu-64 Zn-65
一、选择题(本题包括14题,每题3分,共42分,每题只有一个正确选项)
1.科技发展离不开化学。下列说法不正确的是( )
A.“一带一路”,丝绸制品主要成分为纤维素
B.“乘风破浪”,航母上的钛合金铆钉属于金属材料
C.“直上云霄”,客机所用燃油属于烃类物质
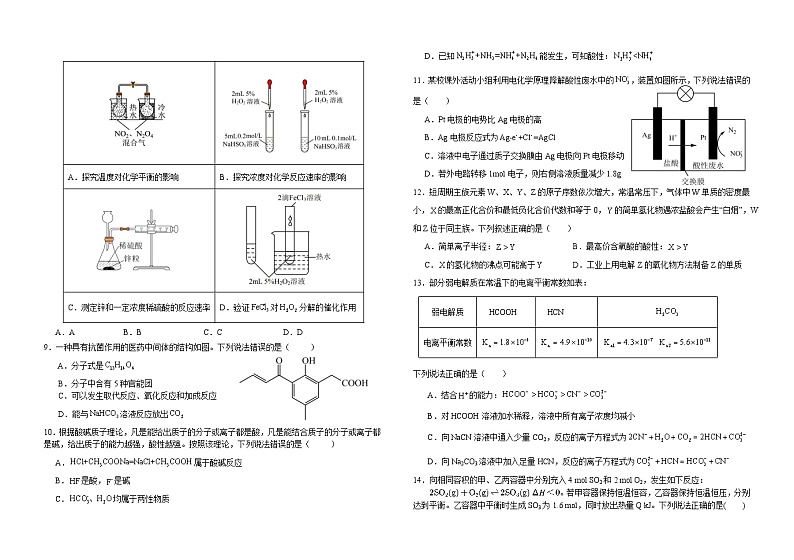
D.“筑梦天宫”,火箭助推剂液氧与臭氧互为同素异形体
2.下列化学用语正确的是( )
A.氯化氢的形成过程:
B.Cl-的结构示意图:
C.质子数为6,中子数为8的核素:
D.硝酸铵中氮元素的化合价为:+1
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,7.8gNa2O2中含有0.2NA个Na+
B.0.5ml/L的MgCl2溶液中含有NA个Cl-
C.常温常压下,NA个CO2分子占有的体积为22.4L
D.常温常压下,O2和O3的混合物共64g,所含氧原子数目为2NA
4.下列事实能用勒夏特列原理解释的是( )
A.合成氨工业中需采用高温条件
B.实验室中常用排饱和食盐水的方法收集氯气
C.向H2O2溶液中加入MnO2,单位时间内产生O2的量增多
D.对平衡体系 2NO2(g)⇌N2O4(g),缩小容器的体积,混合气体的颜色突然加深
5.下列说法或表示方法正确的是( )
A.吸热反应一定需要加热才能发生
B.氢气与氧气反应生成等量的液态水和水蒸气,后者放出的热量多
C.硫完全燃烧放热,其燃烧热的热化学方程式为:
D.在稀溶液中:,,若将含的稀硫酸与含的稀溶液混合,放出的热量等于
6. 下列各组离子在指定溶液中能大量共存的是( )
A. 无色溶液中 Na+ 、Al3+、MnO4-、SO32-
B. 通入足量CO₂的溶液中:H+、Cl-、NH4+、Na+
C. 滴加KSCN溶液后显血红色的溶液中:OH-、K+、NH4+、CO32-
D.c(H+)=的溶液中:NH4+ 、S2-、I-、NO3-
7.某反应由A→B、B→C两步构成,反应过程中的能量变化曲线如图所示。下列叙述正确的是( )
A.两步反应均为吸热反应B.A→B的反应一定要加热
C.A、B、C中C最稳定D.A→C反应的△H=E1-E2
8.用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是( )
A.AB.BC.CD.D
9.一种具有抗菌作用的医药中间体的结构如图。下列说法错误的是( )
A.分子式是
B.分子中含有5种官能团
C.可以发生取代反应、氧化反应和加成反应
D.能与溶液反应放出
10.根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱,给出质子的能力越强,酸性越强。按照该理论,下列说法错误的是( )
A.属于酸碱反应
B.是酸,是碱
C.均属于两性物质
D.已知能发生,可知酸性:
11.某校课外活动小组利用电化学原理降解酸性废水中的,装置如图所示,下列说法错误的是( )
A.Pt电极的电势比Ag电极的高
B.Ag电极反应式为
C.溶液中电子通过质子交换膜由Ag电极向Pt电极移动
D.若外电路转移1ml电子,则右侧溶液质量减少1.8g
12.短周期主族元素W、X、Y、Z的原子序数依次增大,常温常压下,气体中单质的密度最小,的最高正化合价和最低负化合价代数和等于0,的简单氢化物遇浓盐酸会产生“白烟”,W和Z位于同主族。下列叙述正确的是( )
A.简单离子半径:B.最高价含氧酸的酸性:
C.的氢化物的沸点可能高于D.工业上用电解Z的氧化物方法制备Z的单质
13.部分弱电解质在常温下的电离平衡常数如表:
下列说法正确的是( )
A.结合的能力:
B.对HCOOH溶液加水稀释,溶液中所有离子浓度均减小
C.向NaCN溶液中通入少量CO2,反应的离子方程式为
D.向Na2CO3溶液中加入足量HCN,反应的离子方程式为
14.向相同容积的甲、乙两容器中分别充入4 ml SO2和2 ml O2,发生如下反应:
。若甲容器保持恒温恒容,乙容器保持恒温恒压,分别达到平衡。乙容器中平衡时生成SO3为1.6 ml,同时放出热量Q kJ。下列说法正确的是( )
乙容器若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO2)大于2.4 ml
B.平衡时,O2的质量:甲<乙
C.平衡时,反应放出的热量:甲>乙
D.平衡时,向甲容器中再通入一定量的SO3气体,重新达到平衡时,SO2的百分含量升高
二、非选择题(本题包括4小题,共58分)
15.(15 分)完成下列问题
(1)下列反应中属于吸热反应的有 。
①燃烧木炭取暖
②煅烧石灰石制生石灰
③氯化铵晶体和Ba(OH)2·8H2O混合搅拌
④食物因氧化而腐败
①氨热分解法制氢气的相关化学键的键能数据
在一定温度下利用催化剂将NH3分解为N2和H2。计算反应 2NH3(g) ⇌ N2(g) + 3H2(g)的ΔH = kJ ⋅ ml−1。
②已知合成氨反应的ΔS=-200 J·K-1·ml-1,结合氨分解反应的ΔH,分析合成氨反应在 25℃ (填 “能”或“不能”)自发。
③合成氨反应的化学平衡常数表达式 K = 。
某温度下,将N2和H2按一定比例充入 1L 恒容容器中,平衡后测得数据如下表:
若平衡后,再向平衡体系中加入N2、H2和NH3各 1.00ml,此时反应向 方向(填“正反应”或“逆反应”)进行,结合计算说明理由: 。
①下图为氢氧燃料电池的构造示意图,由此判断 X 极为电池的 (填“正”或“负”)极,OH-向 (填“正”或“负”)极作定向移动,Y 极的电极反应式为 。
放电
充电
②铅蓄电池是常见的化学电源之一,其充电、放电的总反应式为2PbSO4+2H2O ⇌ Pb+PbO2+2H2SO4
铅蓄电池放电时正极反应方程式为 。
16.(14分)天然气的主要成分是CH4,是一种重要的燃料和化工原料,工业上可用天然气为原料制取一氧化碳和氢气。
(1)已知:①CH4(g)+O2(g)⇌CO(g)+2H2O(g) K1 ∆H1=-519 kJ∙ml-1。
②H2(g)+O2(g)⇌H2O(g) K2 ∆H2=-242 kJ∙ml-1
反应③CH4(g)+H2O(g)⇌CO(g)+3H2(g)的∆H3=_______kJ∙ml-1,平衡常数K3=_______(用K1、K2表示)。
(2)一定温度下,将2 ml CH4(g)与2 ml H2O(g)置于2 L密闭容器中发生反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
①下列可判断反应达到平衡状态的是________(填字母)。
A.混合气体的平均相对分子质量不变 B.混合气体的密度保持不变
C.CH4和H2O的物质的量之比保持不变 D.v正(H2O)=3v逆(H2)
②若该反应初始混合气中的n(H2O)/n(CH4)恒定时,温度、压强对平衡混合气中CH4含量的影响如右图所示:
图中两条曲线表示的压强的关系是:P1_____P2(填“>”“=”
或“<”)。图中A、B、C三点平衡常数KA、KB、KC的大小
关系是__________________。
③某学习小组的同学模拟其原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。
分析表中数据,判断5 min时反应是否处于平衡状态____________(填“是”或“否”),前5 min反应的平均反应速率_____________。
17.(14分)2024年巴黎奥运会我国获得24枚铜牌,铜牌的主要成分为铜和少量的锌。已知从一种废甲醇催化剂(主要成分为等)中回收铜和锌的一部分工艺流程如图所示。
回答下列问题:
(1)下列关于焙烧1的说法不正确的是_________。
A.焙烧时通入适当过量空气
B.将废催化剂粉碎后焙烧
C.焙烧时产生气体直接排放到空气中
(2)控制“浸取温度为之间,浸取后锌元素主要以存在。
①浸取的化学方程式为___________ _______。
②控制温度需采取合适的加热方式是__________________。
温度需在之间的原因是________ __________。
(3)“抽滤”是减压过滤,下列关于抽滤”优点的说法,正确的是_________。
A.过滤速度快 B.过滤后所得固体较干燥 C.固体和液体分离不完全
(4)用乙醇代替水洗涤胆矾的优点为__________________。
(5)已知该废甲醇催化剂中的质量分数为,该废甲醇催化剂经上述转化最终得到ZnO 3.6×103g则锌的提取率为_________。
(元素提取率)。
18.(15 分)某实验小组拟在实验室模拟工业合成氨,并进行氨的催化氧化。
Ⅰ.实验室模拟合成氨的流程如下:
已知:实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)图甲中实验室制取氢气的装置是: (填 a、b 或者 c)。
写出用饱和亚硝酸钠溶液与饱和氯化铵溶液制取 N2 的化学方程式:
。
(2)氮气和氢气通过乙装置,乙装置的作用除了将气体混合外,还有 、 的作用。
(3)氨合成器出来经冷却的气体连续通入丙装置的水中,吸收氨气不会发生倒吸,原因是:
。
(4)用丙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入丙装置的锥形瓶内,铂丝表面发生主要反应的化学方程式为______________________,能使铂丝保持红热的原因是____________________,锥形瓶中还可观察到的现象是: 。
(5)反应结束后锥形瓶中的溶液含有的离子有 H+、OH-、 、 。
A.探究温度对化学平衡的影响
B.探究浓度对化学反应速率的影响
C.测定锌和一定浓度稀硫酸的反应速率
D.验证对分解的催化作用
弱电解质
HCOOH
HCN
电离平衡常数
化学键
N ≡ N
H − H
N − H
键能 / ( kJ⋅ml−1)
946
436.0
390.8
N2
H2
NH3
平衡时各物质的物质的量/ ml
1.00
3.00
1.00
时间/min
CH4(ml)
H2O(ml)
CO(ml)
H2(ml)
0
0.40
1.00
0
0
5
a
0.80
0.20
0.60
7
0.20
b
0.20
d
四川省达州市万源中学2023-2024学年高二下学期期中考试化学试卷(Word版附答案): 这是一份四川省达州市万源中学2023-2024学年高二下学期期中考试化学试卷(Word版附答案),文件包含化学试题docx、化学答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
四川省达州市万源中学2023-2024学年高一下学期4月期中考试化学试题(含答案): 这是一份四川省达州市万源中学2023-2024学年高一下学期4月期中考试化学试题(含答案),文件包含试题docx、化学答案docx等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
四川省达州市万源中学2023-2024学年高二上学期10月月考化学试题含答案: 这是一份四川省达州市万源中学2023-2024学年高二上学期10月月考化学试题含答案,共21页。试卷主要包含了 下列说法正确的是,23kJ•ml﹣1等内容,欢迎下载使用。












