

专题07 沉淀溶解平衡(考点清单)(讲+练)-2024-2025学年高二化学上学期期中考点大串讲(人教版2019选择性必修1)
展开这是一份专题07 沉淀溶解平衡(考点清单)(讲+练)-2024-2025学年高二化学上学期期中考点大串讲(人教版2019选择性必修1),共12页。试卷主要包含了物质在水中的溶解度,沉淀溶解平衡,沉淀的转化,关于溶解平衡,已知,石灰乳中存在下列平衡,黑色的水溶性很差等内容,欢迎下载使用。
▉考点01 沉淀溶解平衡的概念、建立
1.物质在水中的溶解度
20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
2.沉淀溶解平衡
(1)概念
在一定温度下,当沉淀和溶解的速率相等时,形成饱和溶液,达到平衡状态,把这种平衡称为沉淀溶解平衡。
(2)建立
(3)沉淀溶解平衡方程式
Mg(OH)2(s)Mg2++(aq)+2OH-(aq)
沉淀、溶解之间这种动态平衡也决定了Mg2+与OH-的反应不能完全进行到底。一般情况下,当溶液中剩余离子的浓度小于1×10-5ml·L-1时,化学上通常认为生成沉淀的反应进行完全了。
▉考点02 沉淀溶解平衡的影响因素
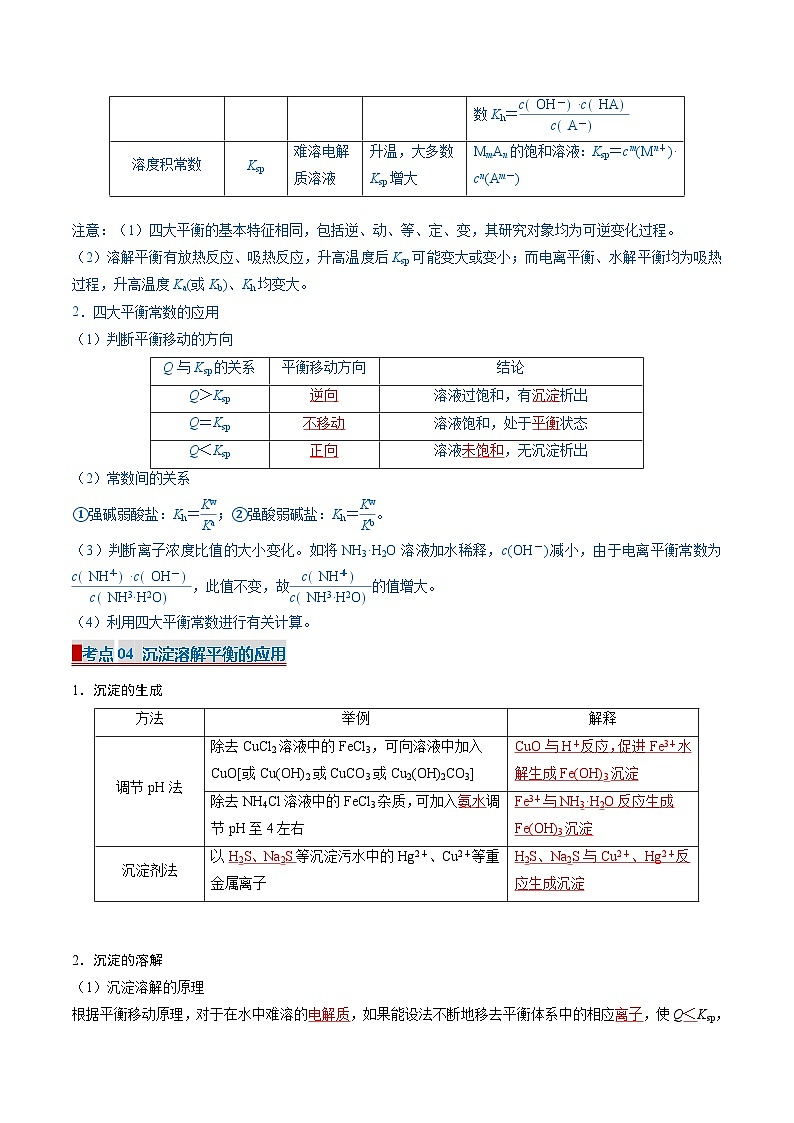
▉考点03 溶度积常数
【归纳总结】水溶液中四大平衡常数的比较与应用
1.四大平衡常数的比较
注意:(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后Ksp可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度Ka(或Kb)、Kh均变大。
2.四大平衡常数的应用
(1)判断平衡移动的方向
(2)常数间的关系
①强碱弱酸盐:Kh=eq \f(Kw,Ka);②强酸弱碱盐:Kh=eq \f(Kw,Kb)。
(3)判断离子浓度比值的大小变化。如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为eq \f(cNH\\al(+,4)·cOH-,cNH3·H2O),此值不变,故eq \f(cNH\\al(+,4),cNH3·H2O)的值增大。
(4)利用四大平衡常数进行有关计算。
▉考点04 沉淀溶解平衡的应用
1.沉淀的生成
2.沉淀的溶解
(1)沉淀溶解的原理
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使Q<Ksp,平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
(2)沉淀溶解的方法
3.沉淀的转化
【技巧点拨】
1.沉淀先后顺序的判断
向溶液中加入沉淀剂,当有多种沉淀生成时,哪种沉淀的溶解度最小(当各种沉淀的Ksp表达式相同时,Ksp越小,沉淀的溶解度越小),则最先生成该沉淀。
(1)向含等浓度Cl-、Br-、I-的混合液中加入AgNO3溶液,最先生成的沉淀是AgI。
(2)向含等浓度COeq \\al(2-,3)、OH-、S2-的混合液中加入CuSO4溶液,最先生成的沉淀是CuS。
(3)向Mg(HCO3)2溶液中加入适量NaOH溶液,生成的沉淀是Mg(OH)2而不是MgCO3,原因是Mg(OH)2的溶解度比MgCO3的小。
2.Ksp的大小比较
▉考点05 沉淀溶解平衡曲线
1.典型示例
2.点的变化
1.(23-24高二上·四川自贡·期末)下列说法中,正确的是
A.难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动
B.难溶电解质都是弱电解质
C.室温下,在水中的溶解度大于在饱和溶液中的溶解度
D.在白色沉淀上滴加溶液,沉淀变黑,说明比更难溶于水
【答案】C
【解析】A.难溶电解质是固体,其浓度可视为常数,增加难溶电解质的量对平衡无影响,A错误;
B.难溶电解质在熔融状态下可以完全电离,不一定都是弱电解质,如AgCl难溶于水,但为强电解质,B错误;
C.相同温度下,氯化银在溶液中存在沉淀溶解平衡,氯化钠溶液中氯离子抑制氯化银溶解,AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度,C正确;
D.在白色ZnS沉淀上滴加 CuSO4 溶液,沉淀变黑,说明CuS比ZnS更难溶于水,D错误;
故选C。
2.在FeS悬浊液中,存在平衡FeS(s) ⇌Fe2+(aq)+S2-(aq)。欲使FeS固体质量减少,Fe2+浓度不变,可向悬浊液中加入的试剂是
A.CuSO4溶液B.盐酸C.蒸馏水D.Na2S
【答案】C
【解析】A.加入CuSO4溶液与S2-反应生成CuS,对于平衡FeS(s) ⇌Fe2+(aq)+S2-(aq),生成物浓度减小,平衡正向移动,FeS固体质量减少,Fe2+浓度增大,A不选;
B.加入盐酸H+与S2-反应生成H2S气体,导致S2-浓度减小,平衡正向移动,FeS固体质量减少,Fe2+浓度增大,B不选;
C.加入蒸馏水稀释,平衡正向移动,FeS固体质量减少,由于还是饱和溶液,则Fe2+浓度不变,C选;
D.加入Na2S增大S2-浓度,生成物浓度增大,平衡逆向移动,FeS固体质量增加,Fe2+浓度减小,D不选;
故选:C。
3.将BaCO3形成的悬浊液均分成四份,若分别加入①50 mL0.2 ml·L-1Na2CO3溶液;②100 mL水;③50 mL 0.01 ml·L-1 氯化钡溶液;④100 mL 0.001 ml·L-1盐酸后,BaCO3 仍有剩余,则各分散系中BaCO3固体的质量由大到小的顺序为
A.①③②④B.③④①②C.④③①②D.②①④③
【答案】A
【分析】BaCO3的溶解性很小,其悬浊液中存在沉淀溶解平衡:BaCO3(s)Ba2+(aq) +(aq),当加入或Ba2+时会使沉淀溶解平衡逆向移动,析出沉淀;当加入与离子反应的物质或加入水时会使沉淀溶解平衡正向移动,以此来解答。
【解析】①加入50 mL0.2 ml·L-1Na2CO3溶液时,由于的浓度增大,则沉淀溶解平衡逆向移动,析出沉淀,溶液中固体较多;
②BaCO3加入100 mL水中,充分溶解至溶液饱和,存在BaCO3(s)Ba2+(aq) +(aq), 则溶解的沉淀较少,溶液中剩余的固体较多;
③加入50 mL 0.01 ml·L-1 氯化钡溶液,溶液中Ba2+的浓度增大,所以BaCO3(s)Ba2+(aq) +(aq)的平衡逆向移动,析出沉淀,溶液中固体较多,但由于钡离子浓度比①中碳酸根离子浓度小,所以析出的固体比①少;
④加入100 mL0.01 ml/L盐酸中, 碳酸钡与盐酸反应,沉淀逐渐溶解,所以溶液中固体的量较少。
综上所述可知:各分散系中BaCO3固体的质量由大到小的顺序为①③②④,故合理选项是A。
4.关于溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),下列说法中正确的是
A.加入固体Mg(OH)2,可以增大溶液中镁离子的浓度
B.溶度积常数表示式:Ksp=c(Mg2+)·c2 (OH—)
C.加入NaOH浓溶液,可以增加Mg(OH)2的溶解量
D.升高温度,不会影响溶解平衡
【答案】B
【解析】A.氢氧化镁饱和溶液中加入氢氧化镁固体,溶解平衡不移动,溶液中镁离子的浓度不变,故A错误;
B.由溶度积的概念可知,氢氧化镁的溶度积表达式为Ksp=c(Mg2+)·c2 (OH—),故B正确;
C.加入氢氧化钠浓溶液,溶液中氢氧根离子浓度增大,溶解平衡左移,氢氧化镁的溶解量减小,故C错误;
D.升高温度,氢氧化镁的溶解度增大,平衡右移,故D错误;
故选B。
5.已知:25℃时,CaCO3的,现将浓度为的Na2CO3溶液与某浓度CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A.
B.
C.
D.
【答案】B
【解析】Na2CO3溶液的浓度为,与某浓度CaCl2溶液等体积混合后溶液中,根据可知,若要产生沉淀,混合后溶液中,故将溶液等体积混合前,原CaCl2溶液的最小浓度为,答案选B。
6.在一定温度下,氯化银在水中存在如下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl—(aq),若把AgCl分别放入①100mL0.1ml/LNaNO3溶液中;②100mL0.1ml/LNaCl溶液中;③100mL0.1ml/LAlCl3溶液中;④100mL0.1ml/LMgCl2溶液中,搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
A.①>②>④>③B.②>①>④>③
C.④>③>②>①D.①>④>③>②
【答案】A
【解析】氯化银在水中存在沉淀溶解平衡,相同的温度下,溶液中的氯离子浓度越大,氯化银的溶解度越小,银离子浓度越小,由题意可知,溶液中氯离子浓度由大到小顺序为③>④>②>①,则溶液中银离子浓度由大到小顺序为①>②>④>③,故选A。
7.石灰乳中存在下列平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq);加入下列溶液,可使固体明显减少的是
A.Na2CO3溶液B.KCl溶液
C.NaOH溶液D.CaCl2溶液
【答案】B
【解析】A.加入Na2CO3溶液,碳酸根离子与钙离子反应,平衡Ca(OH)2(s)Ca2+(aq)+2OH-(aq)正向移动,Ca(OH)2(s)减小,但生成碳酸钙,碳酸钙的摩尔质量大于氢氧化钙的摩尔质量,固体量不会减少,A不符题意;
B.加入KCl溶液,溶液总体积增大,相当于加水稀释,平衡Ca(OH)2(s)Ca2+(aq)+2OH-(aq)正向移动,Ca(OH)2(s)减小,固体明显减少,B符合题意;
C.加入NaOH溶液,氢氧根离子浓度增大,平衡Ca(OH)2(s)Ca2+(aq)+2OH-(aq)逆向移动,Ca(OH)2(s)增多,C不符题意;
D.加入CaCl2,c(Ca2+)增大,平衡逆向移动,Ca(OH)2增多,固体增多,D不符题意;
选B。
8.(2024·安徽淮北·一模)黑色的水溶性很差。已知:平衡常数,。下列有关说法错误的是
A.降低可以增大的溶解量
B.可将气体通入水溶液中制备
C.的电离平衡常数的乘积
D.用除废水中,平衡常数
【答案】C
【解析】A.已知:HgS+2H+⇌Hg2++H2S,降低pH,氢离子浓度增大,平衡正向移动,HgS的溶解量增大,故A正确;
B.HgS的溶解平衡为,可将气体通入水溶液中,浓度增大,平衡逆向移动,可制备,故B正确;
C.的电离平衡常数的乘积,故C错误;
D.用除废水中,平衡常数K=,故D正确;
故选C。
9.常温下,Ksp(ZnS)=1. 6×10-24 ,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法不正确的是
A.向FeS悬浊液中通入少量HCl,Ksp(FeS)不变
B.向物质的量浓度相等的FeCl2和ZnCl2混合液中滴加Na2S溶液,先产生白色沉淀
C.在ZnS的饱和溶液中,加入FeCl2溶液,可能产生FeS沉淀
D.常温下,反应FeS(s)+ Zn2+ (aq)⇌ZnS(s)+Fe2+ (aq)的平衡常数K=4.0×10-6
【答案】D
【解析】A.Ksp(FeS)只与温度有关,温度不变,Ksp(FeS)不变,A正确;
B.Ksp(ZnS)<Ksp(FeS),根据Ksp小的先沉淀可知,先产生ZnS白色沉淀,B正确;
C.在ZnS的饱和溶液中,加入FeCl2溶液,由于FeCl2浓度未知,则Qc(FeS)可能大于Ksp(FeS),故可能产生FeS沉淀,C正确;
D.反应FeS(s)+Zn2+(aq)ZnS(s)+Fe2+(aq)的平衡常数K=,D错误;
故答案选D。
10.已知25℃时,的平衡常数,,下列叙述中正确的是
A.25℃时,RSO4的Ksp的为
B.将浓度均为的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C.向c()=c()的混合液中滴加RCl2溶液,首先析出RSO4沉淀
D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
【答案】A
【解析】A.反应的平衡常数K====1.75×104,Ksp(RSO4)=1.75×104×Ksp(RCO3)= 1.75×104×2.80×10-9=4.90×10-5,A正确;
B.溶液混合后体积变为原来的2倍,因此c(R2+)=3×10-5ml/L,c()=3×10-5ml/L,离子积常数Qc= c(R2+) c()=9×10-10<Ksp(RCO3),溶液未饱和,不会产生RCO3沉淀,B错误;
C.RSO4、RCO3属于同种类型的沉淀,Ksp(RSO4)>Ksp(RCO3),因此向c()=c()的溶液中滴加RCl2溶液,Ksp小的RCO3首先沉淀,C错误;
D.Ksp只与温度有关,因此只要温度不变,Ksp就不变,D错误;
故选A。
11.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4ml•L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为
A.2.8×10-2ml•L-1B.1.4×10-5ml•L-1C.2.8×10-5ml•L-1D.5.6×10-5ml•L-1
【答案】D
【解析】溶液的浓度为,与某浓度CaCl2溶液等体积混合后溶液中,时,会产生沉淀,即×c混(Ca2+)>2.8×10-9,解得,故原CaCl2溶液的最小浓度应大于;
故选D。
12.不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点时,在T1、T2两个温度下均没有固体析出
D.图中c点对应的是T1时硫酸钡的过饱和溶液
【答案】D
【解析】A.硫酸钡在水中溶解时吸收热量,升高温度,BaSO4的溶度积常数增大。根据图象可知温度:T2>T1,A错误;
B.硫酸钡在溶液中存在着溶解平衡,a点在平衡曲线上,加入BaCl2固体,会增大c(Ba2+),沉淀溶解平衡逆向移动,导致溶液中c()降低,所以不能使溶液由a点变到c点,B错误;
C.在T1时c点表示Qc>Ksp,溶液为过饱和溶液,有沉淀析出;在T2时c点表示Qc<Ksp,溶液不饱和,没有沉淀析出,C错误;
D.根据图象可知:在T1时c点表示Qc>Ksp,所以此时的溶液为过饱和溶液,D正确;
故合理选项是D。
13.硫化镉是一种难溶于水的黄色颜料,在水溶液中存在如下溶解平衡:,其沉淀溶解平衡曲线如图所示。下列说法错误的是
A.图中温度
B.图中各点对应的甲的关系为:
C.向m点的溶液中加入少量固体,溶液组成由m沿线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿线向p方向移动
【答案】B
【解析】A.根据题干信息CdS(s)Cd2+(aq)+S2-(aq)可知CdS在水中溶解过程是一个吸热过程,升高温度平衡正向移动,故Ksp=c(Cd2+)•c(S2-)增大,从图中可知T1<T2,A正确;
B.图象中m、n、p点均为在温度T1下所测离子浓度,故Ksp(m)=Ksp(n)=Ksp(p),B错误;
C.m点达到沉淀溶解平衡,加入少量Na2S固体,平衡逆向移动,c(S2-)增大,c(Cd2+)减小,溶液组成由m沿mpn线向p方向移动,C正确;
D.平衡CdS(s)⇌Cd2++S2-正向吸热,温度降低时,q点对应饱和溶液溶解度下降,说明溶液中c(S2-)和c(Cd2+)同时减小,q点的饱和溶液的组成由q沿qp线向p方向移动,D正确;
故答案为:B。
14.金属钒主要用于冶炼特种钢, 被誉为 “合金的维生素”。工业上常用富钒炉渣 (主要含FeO·V2O3, 还有少量P2O5等杂质) 制取钒的流程如下图。
回答下列问题:
25 ℃时,Ksp(NH4VO3)=4×10-2,电离常数Kb(NH3·H2O)=1.8×10-5。“沉钒” 后VOeq \\al(-,3)的浓度为eq \f(1,45) ml·L-1,则滤液的pH为__________。除OH-与VOeq \\al(-,3)外,滤液中还可能存在的阴离子是______。
【答案】4.5 Cl-和H2POeq \\al(-,4)、POeq \\al(3-,4)或HPOeq \\al(2-,4)
【解析】Ksp(NH4VO3)=4×10-2=c(NHeq \\al(+,4))·c(VOeq \\al(-,3)),c(NHeq \\al(+,4))=eq \f(4×10-2,\f(1,45)) ml·L-1=1.8 ml·L-1,
NHeq \\al(+,4)+H2O NH3·H2O+ H+
开始/ml·L-1 1.8 0 0
变化/ml·L-1 x x x
平衡/ml·L-1 1.8-x x x
Kh=eq \f(Kw,Kb)=eq \f(10-14,1.8×10-5)=eq \f(x2,1.8-x),解得x=c(H+)≈10-4.5 ml·L-1,则滤液的pH为4.5;除OH-与VOeq \\al(-,3)外,P2O5溶于水生成磷酸,磷酸电离出H2POeq \\al(-,4)、POeq \\al(3-,4)或HPOeq \\al(2-,4) ,滤液中还可能存在的阴离子是Cl-和H2POeq \\al(-,4)、POeq \\al(3-,4)或HPOeq \\al(2-,4)。
考点01 沉淀溶解平衡的概念建立
考点02 沉淀溶解平衡的影响因素
考点03 溶度积常数
考点04 沉淀溶解平衡的应用
考点05 沉淀溶解平衡曲线
考点06
内因
难溶电解质本身的性质,即难溶电解质的溶解能力
外因
温度
升温,大多数溶解平衡向溶解方向移动,但Ca(OH)2升温向生成沉淀方向移动
浓度
加水稀释,平衡溶解方向移动
相同离子
加入与难溶电解质含有相同离子的物质,平衡向生成沉淀的方向移动
反应离子
加入能消耗难溶电解质中所含离子的物质,平衡向溶解方向移动
概念
难溶电解质的沉淀溶解平衡常数称为溶度积常数,简称溶度积,符号为Ksp
意义
Ksp的大小反映难溶电解质在水中的溶解能力
表达式
AmBn(s)mAn+(aq)+nBm-(aq),Ksp=cm(An+)·cn(Bm-)。
如:Mg(OH)2(s)Mg2++(aq)+2OH-(aq) Ksp=c(Mg2+)·c2(OH-)
影响因素
(1)内因:物质本身的性质。
(2)外因:仅与温度有关,与浓度、压强、催化剂等无关。
应用
定量判断给定条件下有无沉淀生成。
Q:离子积对于AmBn(s)mAn+(aq)+nBm-(aq)任意时刻Q=cm(An+)·cn(Bm-)。
①Q>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
②Q=Ksp,溶液饱和,沉淀与溶解处于衡状态。
③Q<Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
常数
符号
适用体系
影响因素
表达式
水的离子积常数
Kw
任意水溶液
温度升高,Kw增大
Kw=c(OH-)·c(H+)
电离常数
酸Ka
弱酸溶液
升温,K增大
HAH++A-,电离常数Ka=eq \f(cH+·cA-,cHA)
碱Kb
弱碱溶液
BOHB++OH-,电离常数Kb=eq \f(cB+·cOH-,cBOH)
盐的水解常数
Kh
盐溶液
升温,Kh增大
A-+H2OOH-+HA,水解常数Kh=eq \f(cOH-·cHA,cA-)
溶度积常数
Ksp
难溶电解质溶液
升温,大多数Ksp增大
MmAn的饱和溶液:Ksp=cm(Mn+)·
cn(Am-)
Q与Ksp的关系
平衡移动方向
结论
Q>Ksp
逆向
溶液过饱和,有沉淀析出
Q=Ksp
不移动
溶液饱和,处于平衡状态
Q<Ksp
正向
溶液未饱和,无沉淀析出
方法
举例
解释
调节pH法
除去CuCl2溶液中的FeCl3,可向溶液中加入CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3]
CuO与H+反应,促进Fe3+水解生成Fe(OH)3沉淀
除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右
Fe3+与NH3·H2O反应生成Fe(OH)3沉淀
沉淀剂法
以H2S、Na2S等沉淀污水中的Hg2+、Cu2+等重金属离子
H2S、Na2S与Cu2+、Hg2+反应生成沉淀
酸溶解法
用强酸溶解的难溶电解质有CaCO3、FeS、Al(OH)3、Ca(OH)2等。
如CaCO3难溶于水,却易溶于盐酸,原因是:CaCO3在水中存在沉淀溶解平衡为CaCO3(s)Ca2+(aq)+COeq \\al(2-,3)(aq),当加入盐酸后发生反应:COeq \\al(2-,3)+2H+=H2O+CO2↑,c(COeq \\al(2-,3))降低,溶液中COeq \\al(2-,3)与Ca2+的离子积Q(CaCO3)<Ksp(CaCO3),沉淀溶解平衡向溶解方向移动。
盐溶液溶解法
Mg(OH)2难溶于水,能溶于盐酸、NH4Cl溶液中。溶于NH4Cl溶液反应的离子方程式为Mg(OH)2+2NHeq \\al(+,4)=Mg2++2NH3·H2O。
实质
沉淀的转化是指由一种难溶物转化为另一种难溶物的过程,其实质是沉淀溶解平衡的移动
条件
两种沉淀的溶解度不同,溶解度小的沉淀可以转化为溶解度更小的沉淀,两者溶解度相差越大转化越容易。
应用
锅炉除水垢
(含有CaSO4)
CaSO4(s)eq \(―――――→,\s\up7(Na2CO3溶液))CaCO3(s)eq \(―――――→,\s\up7(加酸 如盐酸))Ca2+(aq),反应为CaSO4+Na2CO3=CaCO3+Na2SO4,CaCO3+2HCl=CaCl2+H2O+CO2↑
自然界
中矿物的转化
原生铜的硫化物eq \(――――→,\s\up7(氧化、淋滤))CuSO4溶液eq \(――――――――――――――→,\s\up7(渗透、遇闪锌矿ZnS和方铅矿PbS))铜蓝(CuS),反应为CuSO4+ZnS=CuS+ZnSO4,CuSO4+PbS=CuS+PbSO4
工业废水处理
FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq)
a→c
曲线上变化,增大c(SOeq \\al(2-,4))
b→c
加入1×10-5 ml·L-1 Na2SO4溶液(加水不行)
d→c
加入BaCl2固体(忽略溶液的体积变化)
c→a
曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液
相关试卷
这是一份专题05 卤代烃 醇 酚(考点清单)(讲+练)-2023-2024学年高二化学下学期期中考点大串讲(人教版2019),共29页。试卷主要包含了卤代烃,卤代烃中卤素原子的检验,制取卤代烃的方法,卤代烃的用途与危害等内容,欢迎下载使用。
这是一份专题04 烃(考点清单)(讲+练)-2023-2024学年高二化学下学期期中考点大串讲(人教版2019)(原卷版),共37页。试卷主要包含了甲烷的结构及性质,烷烃的结构和性质,环烷烃,烷烃的命名,烯烃的命名,烯烃的立体异构等内容,欢迎下载使用。
这是一份专题04 烃(考点清单)(讲+练)-2023-2024学年高二化学下学期期中考点大串讲(人教版2019),共42页。试卷主要包含了甲烷的结构及性质,烷烃的结构和性质,环烷烃,烷烃的命名,烯烃的命名,烯烃的立体异构等内容,欢迎下载使用。












