

第26讲 金属的腐蚀与防护(原卷版)-2024年新高二化学暑假讲义+习题(人教版2019选择性必修1)
展开
这是一份第26讲 金属的腐蚀与防护(原卷版)-2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),共11页。试卷主要包含了科学探究与创新意识,科学态度与社会责任,实验探究, 5等内容,欢迎下载使用。
1.科学探究与创新意识:通过实验科学探究金属腐蚀的本质及其原因,认识金属腐蚀的主要类型,能正确书写析氢腐蚀和吸氧腐蚀的电极反应式。
2.科学态度与社会责任:认识金属腐蚀产生的危害和影响,树立防止金属腐蚀的意识,熟知金属腐蚀常用的防护方法。
一、金属的腐蚀
1.金属的腐蚀
(1)概念:金属或合金与周围的 发生 反应而引起损耗的现象。其实质是金属原子 电子变为阳离子,金属发生 反应。
(2)根据与金属接触的 不同,金属腐蚀可分为两类:
①化学腐蚀:金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应而引起的腐蚀。腐蚀的速率随温度升高而 。
②电化学腐蚀:当 的金属与 溶液接触时会发生 反应, 的金属发生氧化反应而被腐蚀。
【特别提醒】金属腐蚀过程中,电化学腐蚀和化学腐蚀同时发生,但绝大多数属于电化学腐蚀,且比化学腐蚀的速率大得多。
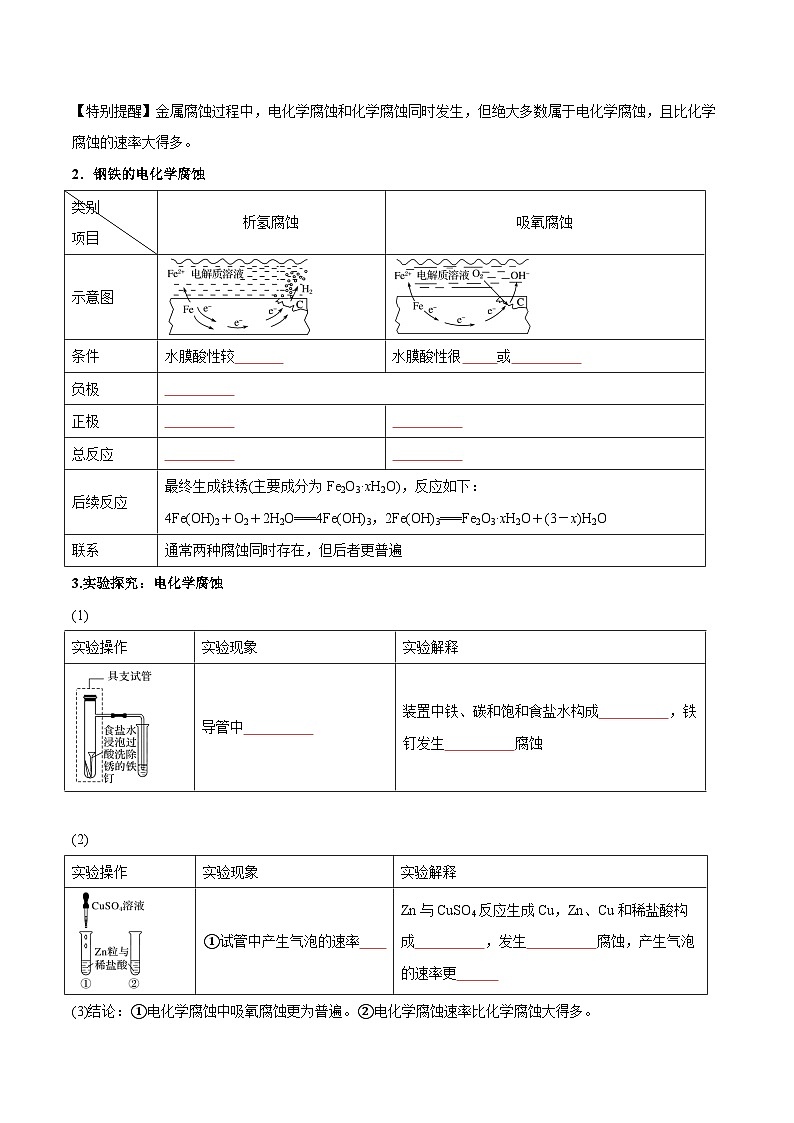
2.钢铁的电化学腐蚀
3.实验探究:电化学腐蚀
(1)
(2)
(3)结论:①电化学腐蚀中吸氧腐蚀更为普遍。②电化学腐蚀速率比化学腐蚀大得多。
二、金属的防护
金属的防护主要从金属、与金属接触的物质及两者反应的条件等方面来考虑。
1.改变金属材料的组成
在金属中添加其他金属或非金属可以制成性能优异的 。如普通钢中加入镍、铬等制成不锈钢产品,钛合金不仅具有优异的抗腐蚀性,还具有良好的生物相容性。
2.在金属表面覆盖保护层
在金属表面覆盖致密的保护层,将金属制品与周围物质隔开是一种普遍采用的防护方法。如,在钢铁制品的表面喷涂油漆、涂矿物性油脂、覆盖搪瓷、塑料等;电镀锌、锡、铬、镍等;利用化学方法、离子注入法、表面渗镀等方式在金属表面形成稳定的钝化膜。
3.电化学保护法
金属在发生电化学腐蚀时,总是作为原电池 (阳极)的金属被腐蚀,作为 (阴极)的金属不被腐蚀,如果能使被保护的金属成为阴极,则该金属就不易被腐蚀。
(1)牺牲阳极法
原理:原电池原理,被保护的金属作 ,活泼性更强的金属作 。
应用:锅炉内壁、船舶外壳、钢铁闸门安装镁合金或锌块。
[实验探究一]
如图装置反应一段时间后,往Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,观察实验现象。
已知Fe2+与[Fe(CN)6]3-反应生成带有特征蓝色的KFe[Fe(CN)6]沉淀。
[实验探究二:]
在两个培养皿中分别放入含有NaCl的琼脂,并注入5~6滴酚酞溶液和K3[Fe(CN)6]溶液混合均匀,取两个2~3 cm的铁钉,用砂纸擦光,将裹有锌皮的铁钉放入a,缠有铜丝的铁钉放入b。
(2)外加电流法
原理:电解池原理,被保护的金属作为阴极,与电源的 相连。
应用:钢铁闸门,高压线铁架,地下管道连接直流电源的 。
三、金属腐蚀快慢的判断方法
1.在同一电解质溶液中,金属腐蚀由快到慢的顺序为 。
2.同一种金属在不同介质中腐蚀由快到慢的顺序为 。
3.对同一种电解质溶液来说,电解质溶液浓度 ,金属腐蚀越快。
4.金属活动性差别 ,活泼性强的金属腐蚀越快。
考点01 金属的腐蚀
【例1】下列现象与电化学腐蚀无关的是
A.铜锌合金(黄铜)不易被腐蚀
B.银质物品久置表面变黑
C.附有银制配件的铁制品其接触处易生锈
D.生铁比纯铁更容易生锈
【变式1-1】下列关于钢铁腐蚀的叙述不正确的是
A.钢铁在潮湿的空气中易腐蚀
B.钢铁腐蚀的主要原因是化学腐蚀
C.腐蚀使钢铁色泽、外形等发生变化
D.一般情况下,温度对钢铁的化学腐蚀影响较明显
【变式1-2】下列叙述与电化学腐蚀有关的是( )
A.炒过菜的铁锅不及时清洗易生锈
B.在空气中金属镁、铝都具有较好的抗腐蚀性
C.红热的铁丝与水接触时,表面形成了蓝黑色的物质
D.把铁片加入氯化铜的溶液中,在铁表面上附着一层红色的铜
考点02 金属腐蚀的防护方法
【例2】据最近报道,中国生产的首艘国产航母已经下水。为保护航母、延长服役寿命可采用两种电化学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确的是
A.方法1叫外加电流的保护法
B.方法2叫牺牲阳极的保护法
C.方法1中金属块可能是锌、锡和铜
D.方法2中舰体连接电源的负极
【变式2-1】生活和生产中人们采用多种方法防止金属腐蚀,其中保护轮船外壳的常用方法是
A.涂保护层B.改变金属结构
C.牺牲阳极的阴极保护法D.外加电流的阴极保护法
【变式2-2】下列有关金属腐蚀与防护的说法正确的是
A.钢铁发生电化学腐蚀时,负极反应为Fe-3e-=Fe3+
B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁制品中铁的腐蚀速率更快
C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法
D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬
考点03 金属腐蚀快慢的比较
【例3】下列试管所盛的溶液中的铁腐蚀速度说法正确的是
A.①比②慢B.③比④快C.⑤比⑥快D.①比③慢
【变式3-1】如图各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是
A.③②④①B.④②①③C.②①③④D.④②③①
【变式3-2】下列四种金属制品的镀层损坏后,金属腐蚀速率最快的是
A.镀铝塑扣B.食品罐头盒(镀锡)
C.白铁水桶(镀锌)D.镀银铜质奖章
1.相同材质的铁在图中的四种情况下腐蚀最快的是
A.B.
C.D.
2.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。下列说法正确的是
A.铁闸主要发生的是吸氢腐蚀
B.将铁闸与石墨相连可保护铁闸
C.铁腐蚀时的电极反应式:Fe-3e−=Fe3+
D.图中生成铁锈最多的是乙区域
3.金属腐蚀造成的损失非常严重,金属腐蚀可分为化学腐蚀和电化学腐蚀。下列现象不能用电化学腐蚀来解释的是
A.铜板上的铁铆钉在阴雨天易生锈
B.马口铁(镀锡的铁)破损后很快生锈
C.铜器皿在高温环境中迅速变黑
D.电工作业中若将铜、铝导线直接相连易出现接触不良现象
4.下列有关金属腐蚀的说法中正确的是( )
A.铝具有强抗腐蚀能力,是因为其不易与氧气发生反应
B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
5.生活中常见的金属防腐的方法很多。下列措施不能起到防腐的是
A.健身器材刷油漆
B.衣架和电线的外面包上一层塑料层
C.在轮船船身上装上一定数量的铜块
D.地下钢铁管道连接镁块
6.关于钢铁腐蚀与防护的说法不正确的是( )
A.钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+
B.钢铁发生吸氧腐蚀时,正极反应式为O2+2H2O+4e-===4OH-
C.地下钢管连接镁块是采用牺牲阳极保护法
D.用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极
7.如图所示装置中都盛有0.1ml·L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是
A.③①④②B.①②④③C.②③④①D.②①④③
8.下列关于金属的腐蚀及防腐说法错误的是
A.马口铁(镀锡铁)镀层破损铁的腐蚀速率加快
B.为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极
C.可以采用改变金属组成或结构的方法防止金属腐蚀
D.为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块
9.下图是研究铁钉腐蚀的装置图,下列说法不正确的是
A.铁钉在两处的腐蚀速率:a < b
B.a、b两处铁钉中碳均正极
C.a、b两处铁钉中的铁均失电子被氧化
D.a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O
10.下列说法正确的是
A.钢铁在潮湿的空气生锈是因为发生了析氢腐蚀
B.铅蓄电池放电时正极质量较少
C.化学电源能将化学能完全转化为电能
D.工业上用图装置电解熔融氧化铝制铝时,阳极碳块常因被生成的氧气氧化而需定期更换
11.一定条件下,碳钢腐蚀与溶液pH的关系如下:
下列说法不正确的是
A.在pH<4的溶液中,碳钢主要发生析氢腐蚀
B.在pH>6的溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14的溶液中,碳钢腐蚀的反应为O2+4OH-+4e-===2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢
12.深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示,下列与此原理有关说法正确的是
A.输送暖气的管道更容易发生此类腐蚀
B.正极反应:+9H++8e-=HS-+4H2O
C.这种情况下,Fe腐蚀的最终产物为Fe2O3∙xH2O
D.管道上刷富锌油漆可以延缓管道的腐蚀
13.下列装置图及有关说法正确的是( )
A.装置①中K闭合片刻后溶液中增大
B.装置①中K闭合片刻后可观察到滤纸a点变红色
C.装置②中铁腐蚀的速率由大到小的顺序是只闭合只闭合只闭合都断开
D.装置③中当铁制品上析出铜时,电源负极输出的电子为
14.一定条件下,碳钢腐蚀与溶液pH的关系如表所示,下列说法错误的是( )
A.在pH6的溶液中,碳钢主要发生吸氧腐蚀
C.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢
D.在强碱性溶液中,碳钢腐蚀的正极电极反应式为O2+4H++4e-=2H2O
15.利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的不变,b处溶液的减小
D.a、b两处具有相同的电极反应式:
类别
项目
析氢腐蚀
吸氧腐蚀
示意图
条件
水膜酸性较
水膜酸性很 或
负极
正极
总反应
后续反应
最终生成铁锈(主要成分为Fe2O3·xH2O),反应如下:
4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
联系
通常两种腐蚀同时存在,但后者更普遍
实验操作
实验现象
实验解释
导管中
装置中铁、碳和饱和食盐水构成 ,铁钉发生 腐蚀
实验操作
实验现象
实验解释
①试管中产生气泡的速率
Zn与CuSO4反应生成Cu,Zn、Cu和稀盐酸构成 ,发生 腐蚀,产生气泡的速率更
实验装置
电流表
阳极(负极区)
阴极(正极区)
现象
指针偏转
Zn溶解
有 产生, 蓝色沉淀生成
有关反应
—
结论
溶液中不含Fe2+,铁作正极未被腐蚀
实验装置
现象
铁钉周围
铁钉周围生成 ,铜丝周围
结论
铁作为负极时易被腐蚀,作为正极时未被腐蚀
pH
2
4
6
6. 5
8
13. 5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
pH
2
4
6
8
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO
相关试卷
这是一份第20讲 电解质溶液中微粒间的关系 (原卷版)-2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),共12页。试卷主要包含了9×10-9ml·L-1等内容,欢迎下载使用。
这是一份第24讲 电解原理(原卷版)-2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),共14页。试卷主要包含了宏观辨识与微观探析,证据推理与模型认知,电解池中的守恒规律,6L等内容,欢迎下载使用。
这是一份第25讲 电解原理的应用 (原卷版)-2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),共13页。试卷主要包含了变化观念与平衡思想,证据推理与模型认知等内容,欢迎下载使用。









