

专题03 化学反应速率(考题猜想)(4大题型)(原卷版)-2024-2025学年高二化学上学期期中考点大串讲(苏教版2019选择性必修1)
展开
这是一份专题03 化学反应速率(考题猜想)(4大题型)(原卷版)-2024-2025学年高二化学上学期期中考点大串讲(苏教版2019选择性必修1),共6页。
▉题型1 化学反应速率的概念及表示方法
【例1】下列说法不正确的是
A.化学反应速率是用来表示一段时间内化学反应快慢的物理量
B.化学反应速率通常用反应物或生成物物质的量浓度随时间的变化表示
C.对于同一时间、同一个反应,化学反应速率用不同物质表示时数值不同
D.用不同物质表示化学反应速率时,其数值之比等于方程式中计量数之比
【变式1-1】某反应物的浓度是1.0ml/L,经过20s后,它的浓度变成了0.2ml/L,在这20s内它的化学反应速率为
A.0.01ml/(L·s)B.0.04ml/(L·s)C.0.08ml/(L·s)D.0.05ml/(L·s)
【变式1-2】一定温度下,向2L恒容密闭容器中充入0.4mlNH3和0.5mlO2发生反应。2min后,NO的浓度为0.06ml/L。下列说法正确的是
A.末,用表示的反应速率为
B.末,的浓度为
C.内,生成的水的物质的量为
D.内,反应物的转化率为
【变式1-3】在一定温度下,向容积为2L的密闭容器中充入等物质的量的A、B两种混合气体,其反应方程式为。经过5min后,测得D的浓度为0.5ml·L-1,且,5min内C的平均反应速率为0.1ml·L-1·min-1.下列说法错误的是
A.此时
B.反应开始前
C.
D.x的值为3
【变式1-4】已知反应(X、Y、Z、W均为气体)在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A.B.
C.D.
【变式1-5】油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,回收处理并加以利用涉及反应:4H2S(g)+2SO2(g)=3S2(g)+4H2O(g)。下列反应速率的关系式错误的是
A.v(H2S)=2v(SO2)B.v(H2S)=v(H2O)
C.v(SO2)=v(S2)D.v(SO2)=v(H2O)
▉题型2 化学反应速率的测定
【例2】利用如图所示装置探究浓度对反应速率的影响,实验药品:不同浓度的硫酸溶液,体积均为40mL,锌粒大小形状相同且足量。下列说法错误的是
A.该反应的
B.将稀硫酸换为浓硫酸,氢气的产生速率加快
C.根据相同时间产生氢气的体积可比较反应速率快慢
D.0~30s内,的硫酸比的硫酸与锌反应产生的氢气多
【变式2-1】向两个锥形瓶中各加入0.05g镁条,塞紧橡胶塞,然后用注射器分别注入2mL2ml/L盐酸、2mL2ml/L醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。下列说法正确的是
A.b曲线代表盐酸与镁条反应时容器内压强随时间的变化曲线
B.若改为2mLc(H+)均为 2ml/L的盐酸和醋酸,则最终产生的氢气体积相等
C.两个反应的反应速率除了与酸的强弱有关外,还与反应过程中产生的热量有关
D.1ml/LNaOH溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更大
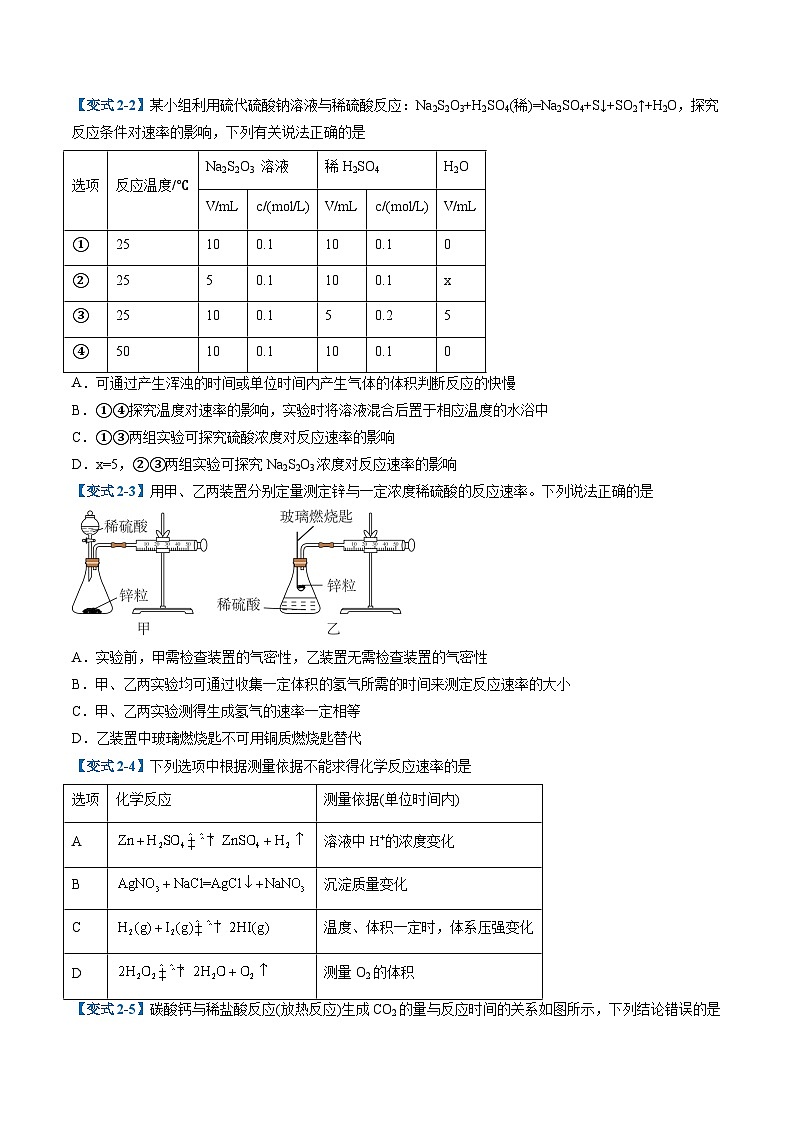
【变式2-2】某小组利用硫代硫酸钠溶液与稀硫酸反应:Na2S2O3+H2SO4(稀)=Na2SO4+S↓+SO2↑+H2O,探究反应条件对速率的影响,下列有关说法正确的是
A.可通过产生浑浊的时间或单位时间内产生气体的体积判断反应的快慢
B.①④探究温度对速率的影响,实验时将溶液混合后置于相应温度的水浴中
C.①③两组实验可探究硫酸浓度对反应速率的影响
D.x=5,②③两组实验可探究Na2S2O3浓度对反应速率的影响
【变式2-3】用甲、乙两装置分别定量测定锌与一定浓度稀硫酸的反应速率。下列说法正确的是
A.实验前,甲需检查装置的气密性,乙装置无需检查装置的气密性
B.甲、乙两实验均可通过收集一定体积的氢气所需的时间来测定反应速率的大小
C.甲、乙两实验测得生成氢气的速率一定相等
D.乙装置中玻璃燃烧匙不可用铜质燃烧匙替代
【变式2-4】下列选项中根据测量依据不能求得化学反应速率的是
【变式2-5】碳酸钙与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论错误的是
A.反应2-4 min内平均反应速率最大
B.反应4-6min的速率最大
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)=0.1 ml·min-1
▉题型3 影响化学反应速率的因素
【例3】适量铁粉与的稀盐酸反应,以下方法不能加快此反应速率的是
A.适当升高温度B.滴入几滴硫酸铜溶液
C.加入少量醋酸钠固体D.加几滴浓硫酸
【变式3-1】下列有关化学反应速率的实验探究方案设计合理的是
【变式3-2】采取下列措施不能加快化学反应速率的是
A.K与水反应时,增加水的用量
B.Zn与稀硫酸反应制备氢气时,适当增大硫酸浓度
C.H2与I2(g)反应生成碘化氢时,压缩体积增大压强
D.CaCO3与盐酸反应制取CO2时,将块状大理石改为粉末状大理石
【变式3-3】工业制氢原理:。改变下列条件能提高产生氢气的速率且提高活化分子百分率的是
①将炭块改为炭粉 ②增大水蒸气浓度 ③适当升高温度 ④加入高效催化剂
A.①②B.①③C.③④D.②④
【变式3-4】可逆反应:的v-t图像如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。现有下列叙述:
①a1=a2;②a1
相关试卷
这是一份专题02 化学能与电能的转化(考题猜想)(6大题型)(原卷版)-2024-2025学年高二化学上学期期中考点大串讲(苏教版2019选择性必修1),共10页。
这是一份专题01 化学反应的热效应(考题猜想)(5大题型)(原卷版)-2024-2025学年高二化学上学期期中考点大串讲(苏教版2019选择性必修1),共7页。
这是一份专题02 化学反应速率(考题猜想)(7大题型)-2024-2025学年高二化学上学期期中考点大串讲(人教版2019选择性必修1),共15页。








