


吉林省吉林市2024-2025学年高二上学期期中考试化学试卷(Word版附答案)
展开
这是一份吉林省吉林市2024-2025学年高二上学期期中考试化学试卷(Word版附答案),文件包含高二期中上化学3doc、化学高二期中调研测试答案及评分标准pdf等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
说明:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,贴好条形码。
2.答选择题时,选出每小题答案后,用2b铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。答非选择题时,用0.5毫米的黑色签字笔将答案写在答题卡上。字体工整,笔迹清楚。
3.请按题号顺序在答题卡相应区域作答,超出区域所写答案无效;在试卷上、草纸上答题无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: Cl 35.5 Fe 56
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 下列溶液呈中性的是
A. NH4ClB. Na2SO4C. CH3COONaD. NaHSO4
2. 下列过程中,化学反应速率的增大对人类有益的是
A. 金属的腐蚀B. 食物的腐败
C. 塑料的老化D. 氨的合成
3. 水凝结成冰的过程中,其焓变和熵变正确的是
A. ∆H>0 , ∆S0 , ∆S>0 D. ∆HHCO3-
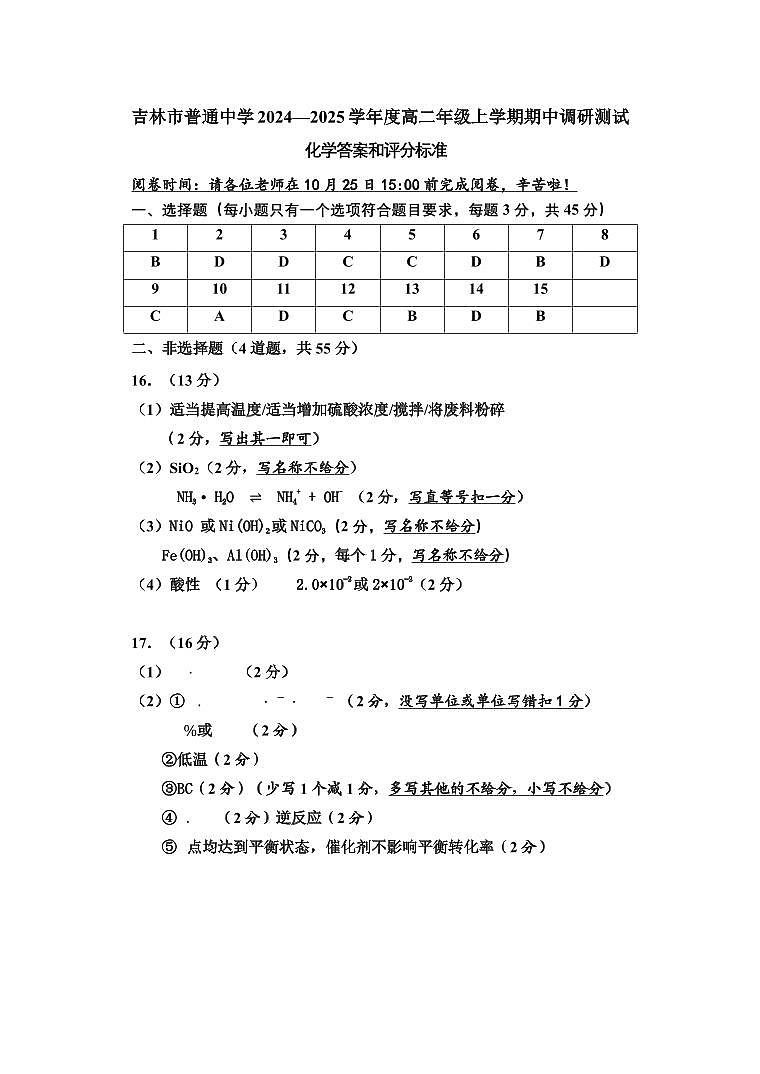
B. HCOOH 能与Na2CO3 反应制得CO2
C. 等体积、等浓度的HCN溶液与氨水混合,充分反应后溶液呈碱性
D. 0.1ml·L-1的NH4HCO3溶液中存在关系:c(HCO3-)> c(NH4+)> c(H+)> c(OH-)
15. 常温下,向10.0mL浓度均为0.1ml·L-1的AlCl3和FeCl3混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0、4.3。下列叙述错误的是
已知:①Ksp[Al(OH)3]>Ksp[Fe(OH)3];Ksp[Cr(OH)3]=6.3×10-31
②Al3+(aq)+4OH-(aq) [Al(OH)4]-(aq),298K时,K=1.1×1033。
③当溶液中某离子浓度小于1.0×10-5ml·L-1,可认为该离子沉淀完全。
A. 曲线Ⅰ代表Fe3+
B. 若该混合溶液中还含有0.1ml·L-1的CrCl3,则Al3+沉淀完全时,Cr3+也沉淀完全
C. 在Al(OH)3和Fe(OH)3共沉淀的体系中= 103.9
D. Al(OH)3(s)+OH-(aq)[Al(OH)4]-(aq)的平衡常数K为1.1×10-1.1
非选择题(本题共4道题,共55分)
16.(13分)某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
②25 ℃时,NH3 ·H2O的电离常数Kb=1.8×10-5,HF的电离常数
Ka=6.3×10-4,Ksp(MgF2)=7.4×10-11。
(1)“酸浸”时,为提高浸出速率,可采取的措施有________________(写一条即可)。
(2)废渣1的主要成分是________(填化学式)。
NH3 ·H2O的电离方程式为_______________________。
(3)调节溶液的pH时若不引入新杂质,加入的适合物质是________(填一种物质的化学式),调至pH=5,得到废渣2的主要成分是______________________(填化学式)。
(4)25 ℃时,NH4F溶液呈________(填“酸性”“碱性”或“中性”)。
(5)已知沉淀前溶液中c(Mg2+)=1.85×10-5 ml·L-1,当除镁率达到99%时,溶液中c(F-)= ml·L-1。
17.(16分)将CO2作为资源进行再利用是重要的研究课题。工业上用CO2生产燃料甲醇的化学方程式:CO2(g)+3H2(g) CH3OH(g)+H2O(g) 。回答下列问题:
(1)由CO2制备甲醇过程涉及反应如下:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应Ⅱ: CO2(g) + H2(g) CO(g) +H2O (g) ΔH2
反应Ⅲ: CO(g)+2H2(g) CH3OH(g) ΔH3
已知反应Ⅰ、Ⅱ、Ⅲ的化学平衡常数分别为K1、K2、K3,则K1= (用K2、K3表示)。
(2)一定条件下,在1L恒容密闭容器中充入1mlCO2和3mlH2,在一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1。
①测得CO2和CH3OH的浓度随时间变化如图1所示,从反应开始到平衡,用H2浓度变化表示化学反应速率为______,CO2的转化率为_______%。
②该反应能量变化如图2所示,则反应在_____条件能自发进行(填“低温”或“高温”)。
③下列措施能使增大的是________。(填标号)
A. 温度升高B. 将H2O(g)从体系中分离出去
C. 再充入1mlCO2和3mlH2D. 充入He(g)使体系总压强增大
④该反应在该温度下的化学平衡常数为__________(ml/L)-2。若温度不变在此容器中开始充入0.3mlH2、0.9mlCO2、0.6mlCH3OH和0.6mlH2O,则反应向___________方向进行(填“正反应”或“逆反应”)。
⑤该反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后,CO2的转化率随反应温度的变化如图3所示,其中d点在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是_______。
18.(14分)氯化铁是一种常用的试剂。
(1)配制一定物质的量浓度的FeCl3溶液时,取一定量FeCl3·6H2O溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是______________________________。
(2)蒸干FeCl3溶液并灼烧所得固体,最终得到的物质是___________(填化学式)。
(3)测定无水FeCl3样品的纯度(杂质不参与反应)。
方案1:配合滴定法。
文献资料:溶液中Fe3+与EDTA以物质的量之比1:1形成稳定的配合物,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在pH=1.5~2.5时与Fe3+形成红色配合物,可用作滴定Fe3+的指示剂。
实验操作:称取wgFeCl3样品溶于盐酸中,稀释成250mL溶液,取25.00mL配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至pH=2左右,用c0 ml·L-1EDTA溶液滴定至终点,消耗EDTA溶液V mL。
① 部分滴定操作如下,正确的先后排序为______________(填字母)。
A.用待装液润洗滴定管 B.检查滴定管是否漏水
C.加入反应液并排气 D.终点时读数
② 达到滴定终点的标志是_________________________________________。
该无水FeCl3样品的纯度为___________%(用含c0、V、w的代数式表示)。
方案2:氧化还原滴定法。
实验操作:称取一定量FeCl3样品溶于稀盐酸,滴加几滴甲基橙作指示剂,滴加SnCl2溶液还原Fe3+生成Fe2+,过量的Sn2+ 使甲基橙变色。用c ml·L-1K2Cr2O7溶液继续滴定Fe2+至终点,消耗滴定液x mL(该条件下,滴定剂不氧化氯离子、甲基橙和甲基橙的还原产物)。
③ 应选择___________式滴定管盛放K2Cr2O7溶液(填“酸”或“碱”)
④ 若其他操作均正确,滴定过程中起始时仰视读数,终点时俯视读数,则测得结果___________(填“偏高”“偏低”或“无影响”)。
19.(12分)研究弱电解质的电离及盐类的水解,有着重要的实际意义。请回答以下问题。
(1)草木灰(主要成分K2CO3)与铵态氮肥不能混用,其原因________________________。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
A. 相同温度下,浓度均为1ml·L-1的盐酸和醋酸的导电性对比:盐酸明显大于醋酸
B. 1ml·L-1CH3COONa溶液能使紫色石蕊试液变蓝
C. 25℃时,1ml·L-1CH3COOH溶液的pH约为2
D. 10mL1ml·L-1的CH3COOH溶液恰好与10mL1ml·L-1NaOH溶液完全反应
(3)常温下0.1ml·L-1 的CH3COOH溶液加水稀释100倍过程中,下列表达式的数据一定变小的是_______(填标号)。
A. c(H+) B.
C. c(H+)· c(OH-) D.
(4)将物质的量浓度相等的NaOH溶液和HF溶液等体积混合后,所得溶液中有关离子的浓度由大到小的关系是_______________________。[以c(Na+)为例表示离子浓度]
(5)向20mL0.1ml/L NH4HSO4溶液中滴加0.1ml/L NaOH溶液,说法正确的是______。(填标号)
A. 加入NaOH溶液后,溶液中一定有:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-)
B. 当滴入20mL NaOH溶液时:2c(SO42-)=c(NH4+)+c(NH3·H2O)
C. 当滴入30mLNaOH溶液时(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-)
c/( ml·L-1)
(6)25℃时,用1.00ml·L-1的NaOH溶液滴定100mL某二元弱酸H2A,滴定过程中溶液的pH及H2A、HA-及A2-的物质的量浓度变化如图所示,则0.01ml·L-1的Na2A溶液第一步水解平衡常数Kh1的数值为_____________。
命题、校对:高二化学命题组弱电解质
HCOOH
HCN
H2CO3
NH3·H2O
电离平衡常数
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
Kb=1.8×10-5
相关试卷
这是一份吉林省吉林市普通高中2024-2025学年高二上学期期中考试 化学试题,共9页。试卷主要包含了5 Fe 56,下列说法中正确的是等内容,欢迎下载使用。
这是一份吉林省吉林市第二中学2024-2025学年高二上学期化学学科期中考试,共4页。
这是一份吉林省四校联考2024-2025学年高二上学期9月月考化学试卷(Word版附答案),共14页。试卷主要包含了本卷主要考查内容等内容,欢迎下载使用。









