

黑龙江省哈尔滨市双城区兆麟中学2024-2025学年高三上学期期中考试化学试题
展开
这是一份黑龙江省哈尔滨市双城区兆麟中学2024-2025学年高三上学期期中考试化学试题,文件包含黑龙江省哈尔滨市双城区兆麟中学2024-2025学年高三上学期期中考试化学试题docx、16docx等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
可能用到的相对原子质量:C 12 O 16 Cu 64 C 59 Fe 56 Cl 35.5
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与艺术、历史息息相关,下列关于黑、吉、辽、内蒙古四地博物院(馆)藏品的说法错误的是
A. 黑龙江省:“金代铜坐龙”其材质为黄铜,属于合金
B. 吉林省:“错金银丙午神钩”其材质中的金丝、银片,都属于单质
C. 辽宁省:“虢国夫人游春图”绘画基材为绢,属于合成高分子
D. 内蒙古自治区:“元代钧窑鼎式香炉”其内胎由黏土烧结而成,属于硅酸盐材料
2. 下列化学用语或图示表达正确的是
A. 中子数为8的碳原子:B. CO2的空间填充模型:
C. 2pz电子云轮廓图:D. MgCl2的电子式:
3. 下列各组离子中,在给定的环境中一定能大量共存的是
A. 能使甲基橙变红的溶液:S2-、、、Na+
B. 常温下,由水电离的c(H+)=10-12的溶液中:Be2+、、K+、Cl-
C. 在水溶液中:、、Ba2+、F-
D. 在漂白液中:OH-、Rb+、、
4. 完成下列实验所选择的玻璃仪器正确且全面的是
A. AB. BC. CD. D
5. 钠的化合物存在广泛,下列说法错误的是
A. 溶解度(室温,g/100 g水):
B. 热稳定性:
C. 水解平衡常数(同温):>
D. 化学键中的离子键百分数:
6. 实验室中可通过香草胺与8-甲基壬酸为原料合成二氢辣椒素,下列有关说法正确的是
A. 香草胺中含有两种官能团
B 二氢辣椒素结构中具有一个手性碳原子
C. 1 ml二氢辣椒素与过量NaOH溶液作用,最多可消耗3 ml NaOH
D. 产物提纯后,可通过红外光谱检测酰胺基的存在,初步确定此合成是否成功
7. 硫酸钴主要用于电镀、碱性电池、生产含钴颜料和其他钴产品,可利用与葡萄糖制备,反应的化学方程式为(未配平)。设为阿伏加德罗常数的值,下列说法错误的是
A. 氧化性: B. 氧化剂与还原剂的物质的量之比为
C. 生成(标准状况)时,转移电子数为 D. 葡萄糖中含有键的数目为
8. 肼(N2H4)是一种应用广泛的化工原料,其结构相当于氨分子中的一个氢原子被氨基取代,因此肼与氨在性质上有一定的相似性。下列有关说法中正确的是
A. 肼分子中存在s-p σ键和p-p σ键
B. 肼能够较好地溶于水或乙醇等溶剂
C. 肼存在顺式和反式两种同分异构体:和
D. 肼能与过量硫酸反应形成酸式盐N2H5HSO4
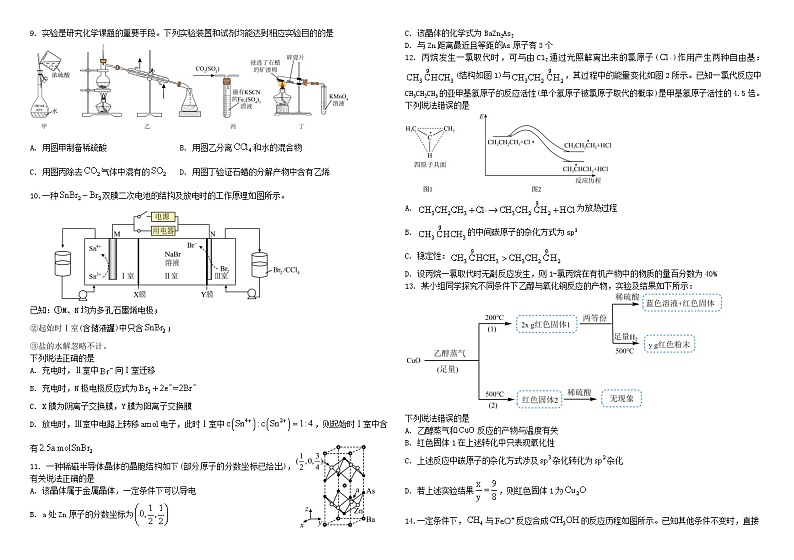
9. 实验是研究化学课题的重要手段。下列实验装置和试剂均能达到相应实验目的的是
A. 用图甲制备稀硫酸 B. 用图乙分离和水的混合物
C. 用图丙除去气体中混有的 D. 用图丁验证石蜡的分解产物中含有乙烯
10.一种双膜二次电池的结构及放电时的工作原理如图所示。
已知:①M、N均为多孔石墨烯电极;
②起始时Ⅰ室(含储液罐)中只含;
③盐的水解忽略不计。
下列说法正确的是
A. 充电时,Ⅱ室中向Ⅰ室迁移
B. 充电时,N极电极反应式为
C. X膜为阴离子交换膜,Y膜为阳离子交换膜
D. 放电时,Ⅲ室中电路上转移电子,此时Ⅰ室中,则起始时Ⅰ室中含有
11. 一种稀磁半导体晶体的晶胞结构如下(部分原子的分数坐标已给出),有关说法正确的是
A. 该晶体属于金属晶体,一定条件下可以导电
B. a处Zn原子的分数坐标为
C. 该晶体的化学式为BaZn2As2
D. 与Zn距离最近且等距As原子有3个
12. 丙烷发生一氯取代时,可与由Cl2通过光照解离出来的氯原子()作用产生两种自由基:(结构如图1)与,其过程中的能量变化如图2所示。已知一氯代反应中CH3CH2CH3的亚甲基氢原子的反应活性(单个氢原子被氯原子取代的概率)是甲基氢原子活性的4.5倍。下列说法错误的是
A. 为放热过程
B. 的中间碳原子的杂化方式为sp3
C. 稳定性:
D. 设丙烷一氯取代时无副反应发生,则1-氯丙烷在有机产物中的物质的量百分数为40%
13. 某小组同学探究不同条件下乙醇与氧化铜反应的产物,实验及结果如下所示:
下列说法错误的是
A. 乙醇蒸气和反应的产物与温度有关
B. 红色固体1在上述转化中只表现氧化性
C. 上述反应中碳原子的杂化方式涉及杂化转化为杂化
D. 若上述实验结果,则红色固体1为
14.一定条件下,与反应合成的反应历程如图所示。已知其他条件不变时,直接参与化学键变化的元素被质量数更大的同位素替换时,反应速率会变慢。说明:过渡态中“_______”表示化学键未完全断裂或形成。下列说法正确的是
A. 是该反应的催化剂
B. 过渡态Ⅰ稳定性强于过渡态Ⅱ
C. 该反应中既有极性键的断裂又有极性键的生成
D. 与发生上述反应,氘代甲醇的产量
15. 下列反应的离子方程式不正确的是
A.将等物质的量浓度的和溶液以体积比混合:
B.苯酚钠溶液中通入少量:
C.溶液中滴加过量的浓氨水:
D.向酸性重铬酸钾溶液中加少量乙醇溶液:
二、非选择题:本题共4小题,共55分。
16. 某炼锌废渣含有锌、铅、铜、铁、钴的价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
已知:常温下,回答下列问题:
(1)基态Pb原子的价电子排布式为_______。
(2)“酸浸”步骤中,可提高含钴废渣浸出率的措施有______________(写出一种)。
(3)“浸出渣”的主要成分为______________(填化学式)。
(4)在“铜渣”中检测不到,“除铜液”中浓度为,则此时溶液的_______ml/L[已知常温下,饱和水溶液中:;,。
(5)在“氧化”步骤中能将氧化为,写出该反应的离子方程式______________。
(6)C的一种氧化物的晶胞如图所示,该晶体中亚钴离子的配位数是_______;已知亚钴离子的半径为anm,氧离子的半径为bnm,亚钴离子和氧离子在晶体中是紧密接触的,则该晶体的密度为______________
17.氯化铁是一种净水剂和化工产品。某小组设计实验制备并测定产品纯度。
实验(一)制备。
某小组设计如下装置制备氯化铁已知:易升华,遇水蒸气易发生水解反应。
(1)装置B中试剂是___________(填名称)。
(2)写出装置A中发生反应的离子方程式:_________________________。
(3)尾气处理宜选择___________(填序号)。
(4)写出装置D中发生反应的化学方程式:________________________________。
(5)实验完毕后,取少量装置D中固体溶于水,滴加溶液,产生蓝色沉淀,有同学认为装置D中氯气与铁反应生成了,请你评价(指出正误并分析理由):__________________。
实验(二)测定样品的纯度。
已知:(无色,很稳定),易溶于水且完全电离。
(6)实验步骤如下:
步骤1:准确称取样品配成溶液,准确量取配制好的溶液于锥形瓶中;
步骤2:向锥形瓶中加入适量溶液(恰好与铁离子完全反应),用力振荡,再加入溶液(过量)使完全沉淀;
步骤3:向其中加入硝基苯,用力振荡,使沉淀表面被有机物覆盖;
步骤4:加入3滴溶液,用溶液滴定过量的至终点,消耗溶液的体积为。已知:常温下,,。
①加入的目的是________________________________。滴定终点时溶液颜色变为_____________。
②测得样品中的质量分数为___________(用含、c、m的代数式表示)。
③下列操作会使所测结果偏低的是___________(填字母)。
A.滴定前仰视读数,滴定终点俯视读数 B.锥形瓶没有干燥
C.滴定管没有用溶液润洗 D.省略了步骤3
18. = 1 \* ROMAN \* MERGEFORMAT I. 氯及其化合物在生产生活中有广泛应用。回答下列问题:
(1)常用于硫化橡胶工业。
已知:①;
②;
③。
则__________________(用含的式子表示)。
(2)光气在有机合成中常作氯化剂。工业上,可用和氯气混合合成光气。已知:合成时放出热量,写出该反应的热化学方程式:________________________________。
= 2 \* ROMAN \* MERGEFORMAT II.金属及其化合物在生活、生产和科技中有着广泛的应用。回答下列问题:
(1)因能与反应可作潜水艇的供氧剂,涉及反应的化学方程式为_____________________;的电子式为_______。
(2)利用铁及其氧化物能循环制氢,原理如图所示。向反应器Ⅰ充入2x ml CO和x ml ,通过该方法制氢,理论上反应器Ⅱ中可获得_______ml (用含x代数式表示)。
(3)钴的氧化物常用作磁性材料,通过热分解可获得钴的氧化物(钴的常见化合价有+2、+3)。
①取47.6 g 样品在空气中加热,充分反应冷却后,获得31.28 g固体氧化物X,通过计算可知X的化学式为_______。
②以钴的氧化物()为电极、KOH溶液为电解液,通电时钴的氧化物转化为CO(OH),写出生成CO(OH)的电极反应式:___________________________________(用含x、y的反应式表示)。
19. 化合物J是一种具有生物活性的苯并呋喃衍生物,其合成路线如下。已知BnBr代表。
(1)A的化学名称为_______。
(2)D生成F的反应类型为_______。
(3)G中含氧官能团的名称为_______。
(4)G生成H的化学方程式为__________________________________________。
(5)符合下列条件的B的含苯环同分异构体共有_______种。
①与溶液发生显色反应;②含有“”结构;③苯环上只有两个取代基.
其中能与溶液反应生成气体且核磁共振氢谱显示为五组峰、峰面积比为2∶2∶2∶1∶1的同分异构体的结构简式为______________。
(6)上述合成路线用BnBr保护酚羟基,某同学用乙酸酐()代替BnBr,设计了更简短的合成路线如下。由M推出N的结构简式为_______,该合成路线中B→J的设计_______(填“合理”或“不合理”),理由是_____________________。
选项
实验
玻璃仪器
A
利用制备纯净的
试管、分液漏斗、导管
B
鉴别氨水和溶液
试管和胶头滴管
C
粗盐提纯
烧杯、玻璃棒、酒精灯
D
配制的溶液
烧杯、玻璃棒、胶头滴管、量筒
相关试卷
这是一份黑龙江省哈尔滨市第九中学校2024-2025学年高三上学期期中考试 化学试卷,共18页。试卷主要包含了 O-16等内容,欢迎下载使用。
这是一份黑龙江省哈尔滨市双城区兆麟中学2024-2025学年高三上学期8月模拟考试化学试卷,共9页。
这是一份黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期4月月考化学试题,共8页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。








