

高中化学整理与提升背景图课件ppt
展开
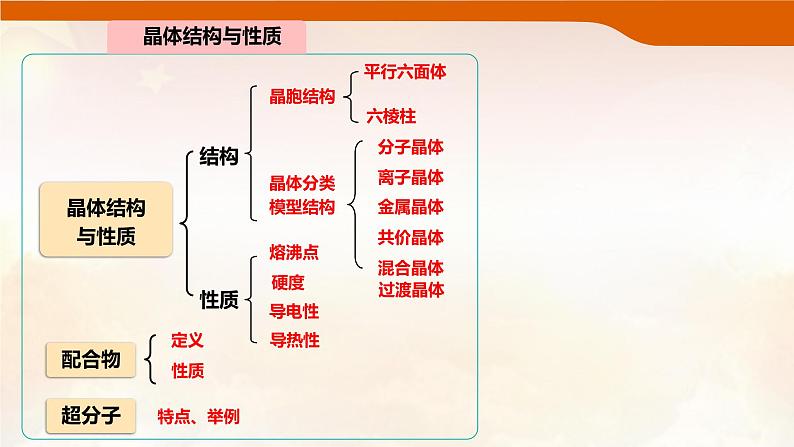
这是一份高中化学整理与提升背景图课件ppt,共17页。PPT课件主要包含了晶体结构与性质,晶体分类模型结构,平行六面体,六棱柱,分子晶体,离子晶体,金属晶体,混合晶体,熔沸点,导电性等内容,欢迎下载使用。
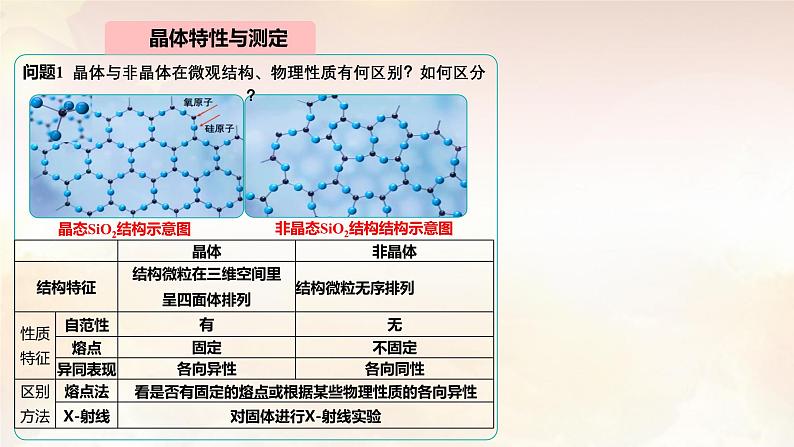
问题1 晶体与非晶体在微观结构、物理性质有何区别?如何区分?
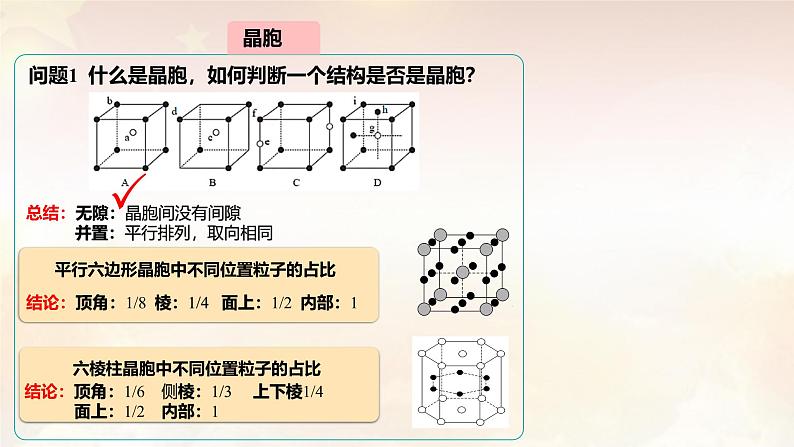
问题1 什么是晶胞,如何判断一个结构是否是晶胞?
总结:无隙:晶胞间没有间隙 并置:平行排列,取向相同
平行六边形晶胞中不同位置粒子的占比
结论:顶角:1/8 棱:1/4 面上:1/2 内部:1
六棱柱晶胞中不同位置粒子的占比
结论:顶角:1/6 侧棱:1/3 上下棱1/4 面上:1/2 内部:1
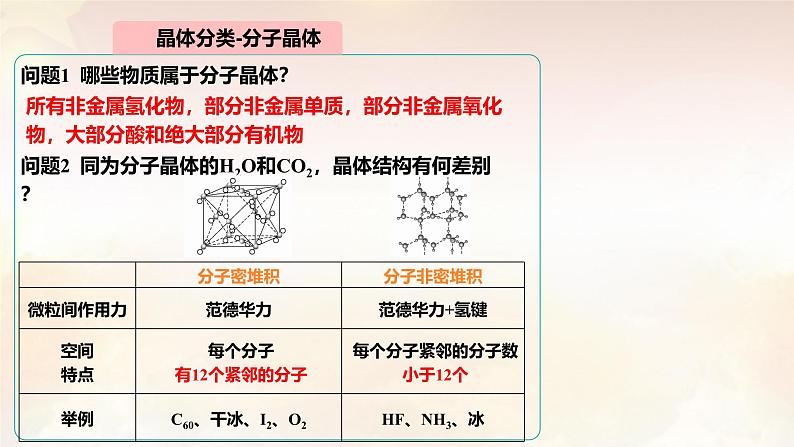
问题1 哪些物质属于分子晶体?
问题2 同为分子晶体的H2O和CO2,晶体结构有何差别?
所有非金属氢化物,部分非金属单质,部分非金属氧化物,大部分酸和绝大部分有机物
问题3 判断下列分子晶体的熔沸点高低
① I2 Br2 Cl2 F2
②H2O H2Te H2Se H2S
③CH3—CH2—CH2—CH2—CH3
④CO N2
总结——分子晶体熔、沸点高低的判断分子间作用力(氢键、范德华力)越大,熔沸点越高1、分子结构相似,只有范德华力时,分子量越大熔沸点越高2、结构相似,有氢键的分子熔沸点高3、同分异构体之间,支链越多,熔沸点越低4、分子量相近,极性越大的分子熔沸点高
答案:从左往右均依次降低
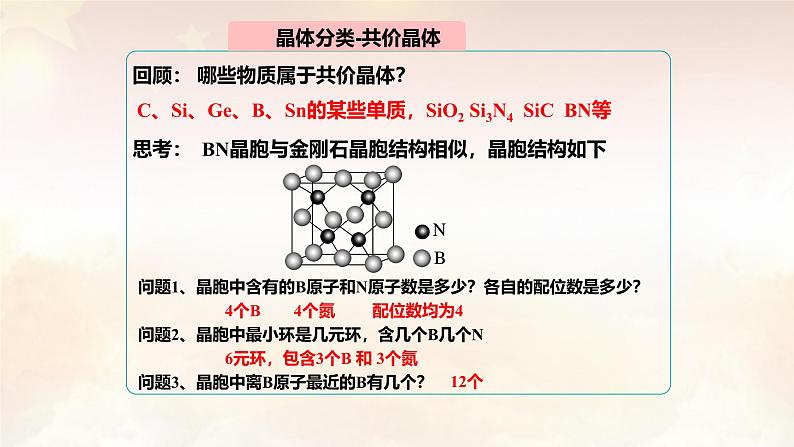
回顾: 哪些物质属于共价晶体?
思考: BN晶胞与金刚石晶胞结构相似,晶胞结构如下
C、Si、Ge、B、Sn的某些单质,SiO2 Si3N4 SiC BN等
问题1、晶胞中含有的B原子和N原子数是多少?各自的配位数是多少? 4个B 4个氮 配位数均为4问题2、晶胞中最小环是几元环,含几个B几个N 6元环,包含3个B 和 3个氮 问题3、晶胞中离B原子最近的B有几个?
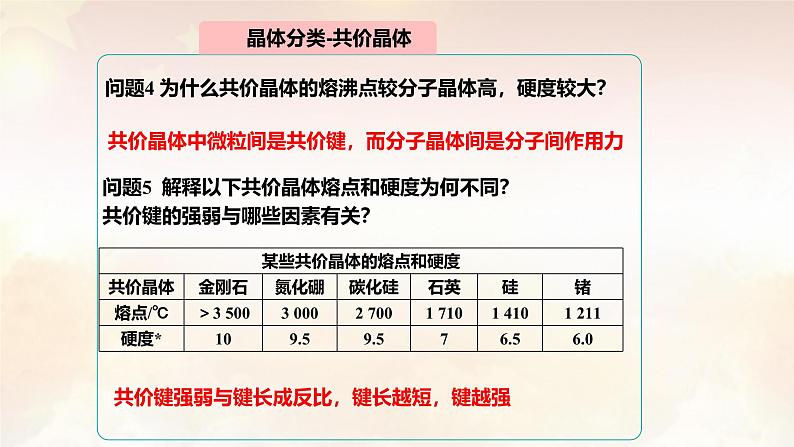
问题4 为什么共价晶体的熔沸点较分子晶体高,硬度较大?
共价晶体中微粒间是共价键,而分子晶体间是分子间作用力
问题5 解释以下共价晶体熔点和硬度为何不同?共价键的强弱与哪些因素有关?
共价键强弱与键长成反比,键长越短,键越强
问题1 金属晶体的堆积方式?
堆积方式不同,空间利用率不同,性质也有所差异
问题2 金属晶体有哪些物理通性?原因是?
良好的导电、导热和延展性
问题3 决定不同金属熔点高低的因素?
结论1:金属阳离子半径越小,所带电荷越多,自由电子越多,金属键越强,熔点越高,硬度也越大。
问题4 总结同周期、同主族金属元素金属键变化规律
结论2:同主族从上到下,离子半径依次增大,金属键依次减弱。
结论3:同周期从左到右,价电子数增多,离子半径减小,金属键依次增强。
问题1 请计算以上离子晶体晶胞中的阴阳离子个数,阴阳离子配位数是多少?
(2)离子晶体不导电,熔化或溶于水后能导电
(3)大多数离子晶体易溶于极性溶剂(H2O),难溶于非极性溶剂(苯等)
(1)熔点较高,硬而脆,熔化状态下导电。
一般阴阳离子的电荷数越大,半径越小,晶格能大,离子键强,晶体的熔沸点越高。如:熔点MgO>NaCl KCl>KBr
问题3 离子晶体的性质有哪些?
问题2 常见的离子晶体包含哪几类物质?
强碱、活泼金属氧化物、大部分盐
元素电负性差值越大,离子键百分数越高
Na2O、MgO离子晶体→Al2O3、SiO2共价晶体→P2O5、SO3、Cl2O7分子晶体随着共价键百分数不断增大,共价键不再贯穿整个晶体,而转变为分子。
问题1、配位键与配合物的形成条件
①.中心原子或离子能提供空轨道;如Al3+、B及过渡金属原子或离子;
②.配体可以提供孤电子对的分子或离子如H2O、NH3、CO、醇、胺、醚等,如X-、OH-、C2O42-、CN-、SCN-等
③.价键理论:配体上的孤电子对,进入中心原子或离子的杂化轨道形成配位键;
问题2、指出[Ag(NH3)2]OH的内外界、中心原子、配位数、配位原子、配体
用相同浓度的FeCl3和K3[Fe(CN)6]溶液进行实验,下列说法不正确的是( )A.相同浓度的FeCl3和K3[Fe(CN)6]溶液中,Fe3+的浓度不同B.Fe3+提供空轨道,CN-提供孤电子对,两者以配位键结合成[Fe(CN)6]3- C.溶液2不显红色,说明Fe3+与CN-的结合力强于与SCN-的结合力D.由对比实验可知,用KCN溶液检验FeCl3溶液中的Fe3+比用KSCN溶液更好
问题1 超分子定义,特点,并举例。
【定义】两种或两种以上的分子通过分子间相互作用形成的分子聚集体;超分子定义中的分子是广义的,也包括离子
超分子的特性①分子间相互作用:通过非共价键结合,包括氢键、静电作用、疏水作用以及分子与金属离子形成的弱配位键等。②分子聚集体大小:分子聚集体有的是有限的,有的是无限伸展的。
利用范德华力及空腔大小
(2)冠醚识别碱金属阳离子
(3)DNA双螺旋结构
DNA碱基配对是通过氢键识别结合
细胞和细胞器的双分子膜
【总结】超分子特性—分子识别与自组装
直径合适的空腔冠醚与金属阳离子通过配位键及相结合形成超分子
相关课件
这是一份人教版 (新课标)选修3 物质结构与性质第一节 晶体的常识图片课件ppt,共17页。PPT课件主要包含了目标导航,预习导引,知识精要,典题例解,迁移应用等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)选修3 物质结构与性质第三节 金属晶体图片ppt课件,共23页。
这是一份人教版 (新课标)选修3 物质结构与性质第四节 离子晶体课堂教学课件ppt,共17页。










