人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教案设计
展开课程基本信息
学科
化学
年级
高二
学期
秋季
课题
水的电离和溶液的pH
教科书
书 名:《化学选择性必修1:化学反应原理》
教学目标
1.认识水的电离平衡,了解水的离子积常数;能运用弱电解质的电离模型分析水的电离,发展应用模型解决问题的能力。
2.认识溶液的酸碱性与pH的关系,会计算溶液的pH,了解溶液pH的调控在工农业生产和科学研究中的应用。
3.能正确测定溶液的pH;能通过酸碱中和滴定的方法测定酸或碱的浓度;掌握数据分析与处理的方法,培养定胁研究的意识。
教学内容
教学重点:
水的离子积常数,水电离平衡的影响因素。
教学难点:
水的离子积和溶液pH的计算。
教学过程
【知识回顾】电离平衡及其影响因素
答:(1) 内因;(2) 外因;
【实验】水的导电性实验
现象:电流计发生偏转,但是灯泡不亮。
结论:水是极弱电解质,能发生微弱电离。
一. 水的电离
1.电离方程式:H2OH+ +OH-
【问题1】如何衡量水的电离的限度?
答:化学平衡常数推导出水的离子积 KW=c(H+)·c(OH-),
2.水的离子积
【问题2】水的离子积受那些因素影响呢?
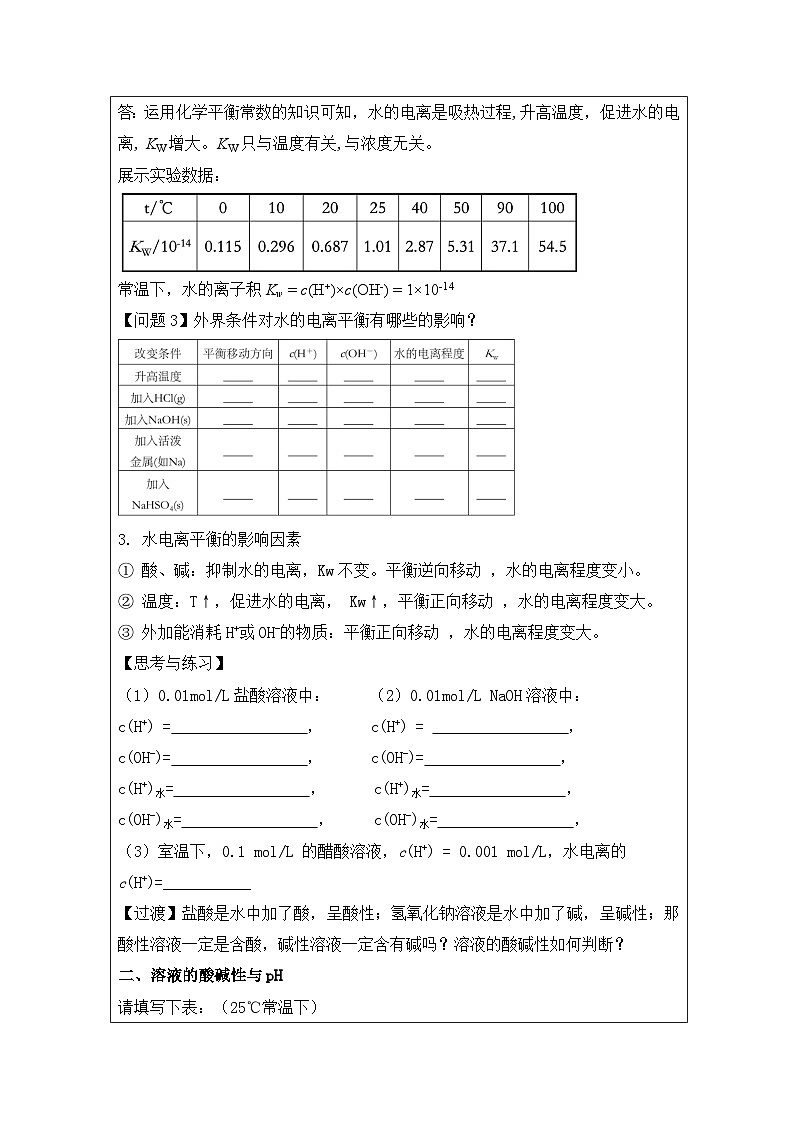
答:运用化学平衡常数的知识可知,水的电离是吸热过程,升高温度,促进水的电离, KW增大。KW只与温度有关,与浓度无关。
展示实验数据:
常温下,水的离子积Kw = c(H+)×c(OH-) = 1×10-14
【问题3】外界条件对水的电离平衡有哪些的影响?
3. 水电离平衡的影响因素
① 酸、碱:抑制水的电离,Kw不变。平衡逆向移动 ,水的电离程度变小。
② 温度:T↑,促进水的电离, Kw↑,平衡正向移动 ,水的电离程度变大。
③ 外加能消耗H+或OH-的物质:平衡正向移动 ,水的电离程度变大。
【思考与练习】
(1)0.01ml/L盐酸溶液中: (2)0.01ml/L NaOH溶液中:
c(H+) = , c(H+) = ,
c(OH-)= , c(OH-)= ,
c(H+)水= , c(H+)水= ,
c(OH-)水= , c(OH-)水= ,
(3)室温下,0.1 ml/L 的醋酸溶液,c(H+) = 0.001 ml/L,水电离的c(H+)=___________
【过渡】盐酸是水中加了酸,呈酸性;氢氧化钠溶液是水中加了碱,呈碱性;那酸性溶液一定是含酸,碱性溶液一定含有碱吗?溶液的酸碱性如何判断?
二、溶液的酸碱性与pH
请填写下表:(25℃常温下)
1.溶液的酸碱性与pH
酸碱性判断的最根本依据是溶液中c(H+) 和c(OH-) 相对大小,c(H+)>c(OH-),酸性;c(H+)=c(OH-),中性;c(H+)
pH=-lgc(H+),它的引入是为了方便表示溶液中的c(H+)。
【思考与交流】pH=7的溶液一定呈中性吗?
答:在25℃时,pH=7的溶液呈中性;温度高于25 ℃时,水的电离程度增大,KW >1.0×10-14,中性溶液的pH<7,而pH=7时溶液呈碱性。
3.pH的测定
(1)酸碱指示剂法(定性测定)
(2)pH试纸法(定量测定)
pH试纸使用方法:用玻璃棒直接蘸取待测液滴在干燥的pH试纸上,试纸变色后马上跟标准比色卡对比。
【思考】误将试纸湿润后,再测pH,会产生怎样的误差?
答:不一定。湿润后相当于稀释了溶液,中性溶液无误差;酸性或碱性溶液更靠近中性。
(3)利用pH计测定(精确测定溶液的pH)
4. pH的应用
(1)土壤的pH值与土壤有效养分含量有关。
(2)工农业生产和科学实验中常常涉及溶液的酸碱性。
(3)人们的生活和健康与溶液的酸碱性有密切关系。
【课堂小结】课件展示
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教学设计: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002427_t8/?tag_id=27" target="_blank">第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教学设计</a>,共4页。教案主要包含了情境创设,课堂小结等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教学设计: 这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教学设计,共4页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。
化学第二节 水的电离和溶液的pH教案设计: 这是一份化学第二节 水的电离和溶液的pH教案设计,共3页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。













