








高中人教版 (2019)第三节 物质的量教学课件ppt
展开宏观辨识与微观探析:理解物质的是浓度的概念,运用物质的量浓度的概念进行简单的计算,学会配制物质的量浓度溶液的方法和技能。证据推理与模型认知: 从概念的应用中,培养学生实验能力和思维能力,培养学生发现问题和解决问题的能力。科学探究与创新意识:通过概念的学习和溶液的配制,培养学生理论联系实际的学习自然科学的思想,学习自然科学的学习兴趣以及严谨求实的学习态度。
1.理解物质的量浓度的概念。2.会运用物质的量浓度的概念进行简单的计算。3.理解物质的量浓度是浓度的概念,运用物质的量浓度的概念进行简单的计算,学会配制物质的量浓度溶液的方法和技能。重点:物质的量浓度概念,溶液稀释与混合及相关的计算,一定物质的量浓度的溶液的配制方法。难点:溶液配制的实验操作及误差分析。
酒精度:3%VOL,56度
联系日常生活你能说出几种浓度的表示方法?
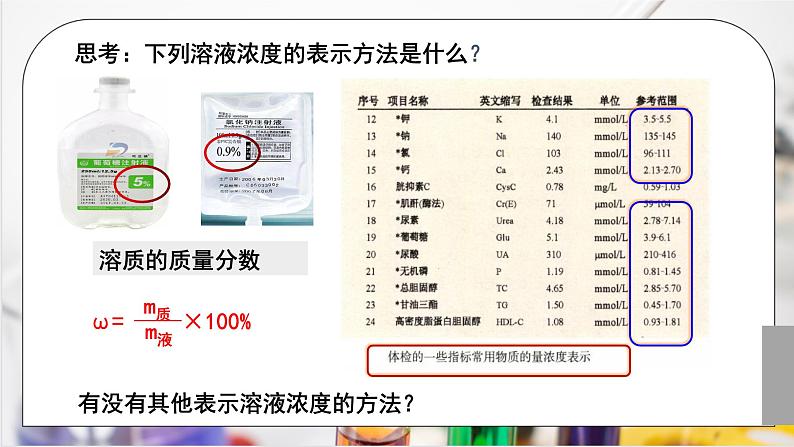
有没有其他表示溶液浓度的方法?
思考:下列溶液浓度的表示方法是什么?
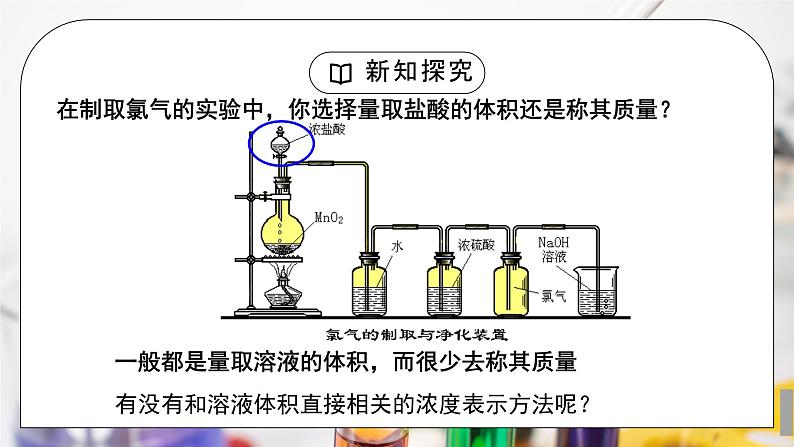
一般都是量取溶液的体积,而很少去称其质量
有没有和溶液体积直接相关的浓度表示方法呢?
在制取氯气的实验中,你选择量取盐酸的体积还是称其质量?
1.定义:单位体积的溶液里所含溶质B的物质的量称为溶质B的物质的量浓度,符号为cB。
nB=cB×V V=nB/cB
3.单位: ml/L或(ml·L-1)
4.注意:①B表示各种溶质,B的组成可以是分子,也可以是离子,还可以是阴阳离子组成的结构单元②其中V是溶液的体积,不是溶剂的体积③溶液的c与所取溶液的多少,体积大小无关,从同一溶液中分割出来的不同体积的溶液,它们的溶液c、w﹪、密度相等,溶液V、溶液m、溶质m、溶剂m、n不同④不同物质(尤其是不同状态的物质)体积无加和性
【例1】判断下列说法是否正确
(1)10 g NaCl溶于100 g水中,所得溶液的溶质质量分数为10%。( )(2)1 ml Na2CO3溶于1 L水中,所得溶液的物质的量浓度为1 ml/L( )(3)1 ml Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 ml/L( )(4)0.5 L 0.5 ml/L的NaCl溶液中溶质的物质的量为0.25 ml。( ) (5)1 ml NaCl溶于1 L水所得溶液中溶质的物质的量浓度是1 ml·L-1 ( ) (6)98 g H2SO4溶于1 L水中配成溶液即得到1 ml·L-1的H2SO4溶液( )
二、物质的量浓度的计算
1.计算的基本公式:c=n/v
2.计算的基本类型和方法:
②已知溶液中某种粒子的数目
【例2】500 mL 0.1 ml·L-1的NaOH溶液中溶质的物质的量是多少?溶质的质量是多少?
n(NaOH)=c(NaOH)•V(NaOH)
=0.1ml/L×0.5L=0.05ml
m(NaOH)=n(NaOH)•M(NaOH)
=0.05ml×40g/ml=2g
③标准状况下,气体溶质的物质的量浓度的计算
【例3】将标准状况下体积为V L的HCl气体溶于1 L水中,所得溶液的密度为ρ g·cm-3,试计算该溶液的物质的量浓度。(书写计算过程)
④物质的量浓度与溶质的质量分数的换算
M:溶质B的摩尔质量 ρ:溶液密度(g·mL-1)。
【例4】市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。则该浓硫酸中的物质的量浓度是多少?
【例5】 质量分数为 36.5% 、密度为 1.18 g/cm3 的浓盐酸的物质的量浓度是多少?
3.溶液的稀释与混合:
将浓溶液加水稀释,稀释前后溶质的物质的量和质量都保持不变。
公式:c(浓)·V(浓)=c(稀)·V(稀)
【例6】将5 ml·L-1 的盐酸10 mL稀释到200 mL,其物质的量浓度为多少?
5ml/L ×10mL= c2 ×200mL
c2 = 0.25 ml·L-1
m1×A﹪= m2×B﹪
同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)。
公式:c1·V1+c2·V2=c(混)·V(混)
【例7】取100 mL 0.3 ml·L-1 H2SO4溶液和300 mL 0.25 ml·L-1 H2SO4溶液一起注入500 mL的容量瓶中,加水稀释至刻度线,则所得溶液中c(H+)为( )A.0.21 ml·L-1 B.0.56 ml·L-1C.0.42 ml·L-1 D.0.26 ml·L-1
体积分数为75%的酒精溶液可用于杀菌消毒
质量分数0.9%的氯化钠溶液可作生理盐水
思考:如何配制1.00ml ·L-1 NaCl溶液
在日常生活生产中,很多物质具有的特殊作用,在浓度上都是有要求的
三、配制一定物质的量浓度的溶液
①结构:细颈、梨形、平底玻璃瓶,瓶口配有磨口塞或塑料塞②标志:温度、容量和刻度线③规格:10mL ﹑25mL﹑50mL﹑ 100mL﹑250mL﹑500mL﹑1000mL④用途:容量瓶是一种容积精密的仪器,常用于配制一定物质的量浓度的溶液
(2)容量瓶的选择与注意事项
①容量瓶是配制物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
如配制480mL溶液,需选用500mL容量瓶
②使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
(3)容量瓶使用之前要检查是否漏水
[实验2-10]配制100 mL 1.00 ml/LNaCl溶液。(1)计算需要NaCl固体的质量:_______g。(2)根据计算结果,称量NaCl固体。(3)将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。(4)将烧杯中的溶液沿玻璃棒注入100mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~-3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。(5)将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠例,摇匀。(6)将配制好的溶液倒入试剂瓶中,并贴好标签。
配制100 ml 1.0 ml/L的NaCl溶液,计算所需无水氯化钠的质量
=1.0ml/L×0.1L×58.5g/ml=5.85g
m(NaCl)=n(NaCl)•M(NaCl)
若配制80mL1.00ml/L的NaCl溶液,需要多少克NaCl固体?
没有80mL的容量瓶,应选择100mL容量瓶,溶液体积以100mL计算。配好100mL的溶液再取出80mL。
2.实验关键: 准确称量(量取)溶质的量 准确计量所得溶液的体积
【托盘天平使用注意事项】
能否用托盘天平称取5.85gNaCl固体?
不能,托盘天平精确度为0.1g,故应称取5.9gNaCl固体。
【拓展】电子天平:精确度0.01g
③垫上称量纸称量,腐蚀性药品(NaOH)放在烧杯中称量。
将称好的NaCI固体放入烧杯,加入适量 蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。
溶解固体,如氢氧化钠,或者稀释浓溶液,如浓硫酸时,要冷却到室温才能转入到容量瓶中。
原因:某些物质在溶解放出大量的热,会容量瓶体积不准。
(4)转移(5)洗涤-摇动
将烧杯中的溶液沿玻璃棒 注入 100mL容量瓶(如图),并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
①玻璃棒作用:引流,避免溶液洒在外面。
②洗涤烧杯内壁和玻璃棒沾有少量溶液,保证溶质完全转移至容量瓶,减少误差。
将蒸馏水注入容量瓶,当液面离容量瓶颈部刻度线1~2cm的时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。
①容量瓶中溶液接近瓶颈刻度时,为什么要改用胶头滴管加水?
易于控制,防止加水超过刻度线
②如果不小心加水超过刻度线怎么办,能不能拿胶头滴管把多余的水吸出?
盖好瓶塞,反复上下 颠倒,摇匀。
如果摇匀后发现液面低于刻度线,能不能继续加水?
将配制好的溶液倒入试剂瓶中,并贴好标签。
容量瓶不能长期储存溶液
[实验2-10]配制100 mL 1.00 ml/LNaCl溶液。(1)计算需要NaCl固体的质量:_______g。(2)根据计算结果,称量NaCl固体。(3)将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。(4)将烧杯中的溶液沿玻璃棒注入100mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~-3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。(5)将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠例,摇匀。(6)将配制好的溶液倒入试剂瓶中,并贴好标签。
4.转移5.洗涤6.摇动
思考与讨论(1)为什么要用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也都注入容量瓶?(2)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?(3)如果在读数时,仰视或者俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
溶液配制操作不当会产生怎样的误差?
4.溶液配制的误差分析的方法
m、V(aq)的变化会引起cB的变化
V不变,凡是使mB或nB增大(或减小)的操作均使cB偏大(或偏小)。
nB或mB不变,凡是使V增大(或减小)的操作均使cB偏小(或偏大)。
①称量时NaCl固体放在右盘,而砝码放在左盘
②NaOH放在滤纸上称量(易潮解)
③量浓硫酸(溶质)时俯视
若俯视刻度线,则实际量取的液体体积偏小,所配溶液浓度偏低。
若仰视刻度线,则实际量取的液体体积偏大,所配溶液浓度偏高。
(2)溶解、转移、洗涤产生误差
⑤未洗涤或洗涤液未注入容量瓶
①溶解过程中有少量液体溅出烧杯
②溶解后未冷却直接转移
③转移液体前容量瓶中有水
(3)定容、摇匀产生误差
②定容时加水不慎超过刻度线,用滴管吸出少量溶液
③摇匀后发现液面低于刻度线再加水
定容时俯视刻度线,溶液体积偏小,所配制溶液的浓度偏高。
定容时仰视刻度线,溶液体积偏大,所配制溶液的浓度偏低。
【例8】某同学帮助水质检测站配制480 mL 0.5 ml·L-1 NaOH溶液以备使用。(1)该同学应选择________ mL的容量瓶。
(2)其操作步骤如上图所示,则该图操作应在下图中的_____(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)下列操作对所配溶液的浓度高低有何影响?①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏高”“偏低”或“无影响”,下同)。②容量瓶中原来有少量蒸馏水,浓度会________。
ml/L或(ml·L-1)
物质的量浓度概相关计算
物质的量浓度的基本计算
有关物质的量浓度与质量分数(及溶解度)的换算
溶液稀释过程中物质的量浓度的计算
有关气体溶质溶液的物质的量浓度的计算
物质的量浓度溶液的混合
配制一定物质的量浓度溶液
高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第二章 海水中的重要元素——钠和氯第三节 物质的量教学ppt课件</a>,文件包含核心素养人教版高中化学必修一《物质的量》第二课时课件pptx、核心素养人教版高中化学必修一《物质的量》第二课时教学设计含教学反思docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第三节 物质的量教学课件ppt</a>,文件包含核心素养人教版高中化学必修一《物质的量》第一课时课件pptx、核心素养人教版高中化学必修一《物质的量》第一课时教学设计含教学反思docx等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161981_t3/?tag_id=26" target="_blank">第二节 氯及其化合物教学ppt课件</a>,文件包含核心素养人教版高中化学必修一《氯及其化合物》第二课时课件pptx、核心素养人教版高中化学必修一《氯及其化合物》第二课时教学设计含教学反思docx等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。














