






2025年高考化学一轮复习课件(新高考版)大单元1 第1章 第3讲 氧化还原反应的概念和规律
展开1.了解氧化还原反应的概念。2.会用“单、双线桥”分析电子转移的方向和数目。3.掌握氧化性、还原性强弱的比较及价态规律的应用。
考点一 氧化还原反应及相关概念
考点二 氧化性、还原性的强弱及影响因素
氧化还原反应及相关概念
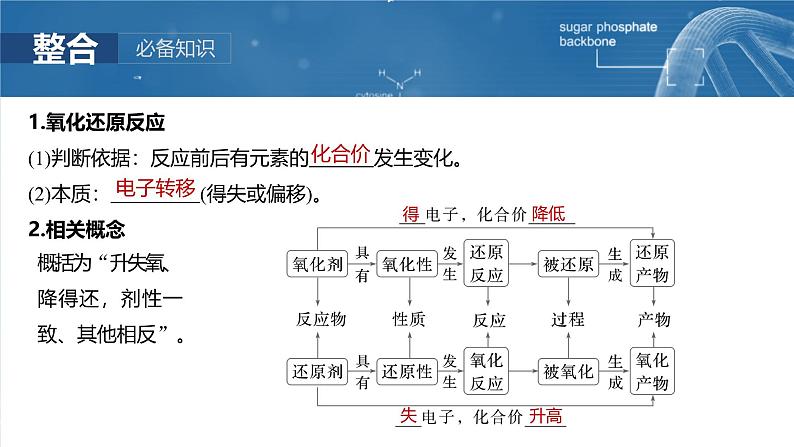
1.氧化还原反应(1)判断依据:反应前后有元素的 发生变化。(2)本质: (得失或偏移)。2.相关概念
概括为“升失氧、降得还,剂性一致、其他相反”。
3.氧化还原反应电子转移的表示方法(1)双线桥法表示反应前后 由反应物转化为反应产物时电子转移的情况。
(2)单线桥法表示反应过程中 原子间的电子转移情况。
(1)分别用双线桥法、单线桥法标出MnO2与浓盐酸在加热条件下反应的电子转移的方向和数目,并指出氧化剂、还原剂、氧化产物、还原产物。
(2)上述反应若产生1 ml Cl2时,转移电子数目为__________________,被氧化的HCl的物质的量是__ ml。
2NA(或1.204×1024)
分析氧化还原反应,走好关键第一步——正确标出元素的化合价。请标出下列陌生物质中指定元素的化合价:Li2NH:N-3,LiNH2:N-3,N2H4:N-2,
4.常见的氧化剂和还原剂(1)常见的氧化剂常见的氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
(2)常见的还原剂常见的还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
金属氢化物(如NaH等)、NaBH4也是重要的还原剂。
(3)元素化合价处于中间价态的物质既可以作氧化剂,又可以作还原剂。如:
其中:Fe2+、 主要表现 性,H2O2主要表现 性。
5.氧化还原反应与四种基本反应类型的关系
分析下列四个化学反应:A.2Na+2H2O===2NaOH+H2↑
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3其中属于区域“1”的是____(填字母,下同),属于区域“2”的是____,属于区域“3”的是___,属于区域“4”的是___。
1.某元素从游离态变为化合态,则该元素一定被还原( )2.有单质参加或生成的化学反应不一定是氧化还原反应( )3.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )4.向0.01 ml·L-1硫酸酸化的KMnO4溶液中滴加0.1 ml·L-1 H2O2溶液,溶液褪色,则H2O2具有氧化性( )5.反应2Na2O2+2H2O===4NaOH+O2↑与反应Cl2+H2O HCl+HClO均为水作还原剂的氧化还原反应( )
6. ( )
1.(2022·浙江6月选考,10)关于反应Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,下列说法正确的是A.H2SO4发生还原反应B.Na2S2O3既是氧化剂又是还原剂C.氧化产物与还原产物的物质的量之比为2∶1D.1 ml Na2S2O3发生反应,转移4 ml电子
该反应的本质是硫代硫酸根离子在酸性条件下发生歧化反应生成硫和二氧化硫,化合价发生变化的只有S元素,硫酸的作用是提供酸性环境。H2SO4中所含元素的化合价均未发生变化,A说法不正确;Na2S2O3中S元素的平均化合价为+2,其发生歧化反应生成S(0价)和SO2(+4价),故其既是氧化剂又是还原剂,B说法正确;该反应的氧化产物是SO2,还原产物为S,氧化产物与还原产物的物质的量之比为1∶1,C说法不正确;根据Na2S2O3中S元素的化合价变化情况可知,1 ml Na2S2O3发生反应,转移2 ml电子,D说法不正确。
2.已知过二硫酸分子中含有一个过氧键(—O—O—),过二硫酸钾(K2S2O8)与MnSO4反应的化学方程式为5K2S2O8+2MnSO4+8H2O===2KMnO4+8H2SO4+4K2SO4。(1)被还原的元素是____。(2)氧化产物是_______。(3)氧化剂和还原剂的物质的量之比是_____。(4)若反应消耗3.6 g H2O时,反应中转移电子数为_______(用NA表示阿伏加德罗常数的值)。
3.已知NaBH4与水反应的化学方程式为NaBH4+2H2O===NaBO2+4H2↑。(1)氧化剂为_____,还原剂为________。(2)用“单线桥”标出电子转移的方向和数目:_____________________________,其中氧化产物与还原产物的质量比为_____。(3)若生成标准状况下4.48 L H2,则转移电子的物质的量为________。
氧化性、还原性的强弱及影响因素
1.氧化性是指 的性质(或能力);还原性是指 的性质(或能力)。2.氧化性、还原性的强弱取决于得、失电子的 程度,与得、失电子数目的____无关。如:Na-e-===Na+,Al-3e-===Al3+,根据金属活动性顺序可知,Na比Al活泼,更易失去电子,所以Na的还原性比Al强。3.物质的还原性、氧化性强弱还与反应环境的许多因素有关,如温度、浓度、酸性。一般浓度越大,物质的氧化性或还原性越强;酸性增强时,氧化剂的氧化性增强。
一、比较物质氧化性或还原性的强弱1.试比较下列单质或离子的氧化性。①Cl2、Br2、I2、S;②H+、Cu2+、Zn2+、Na+。
答案 Cl2>Br2>I2>S
答案 Na+
答案 Mg>Fe>Cu>Ag
答案 Br-
4.下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液⑤Cl2与NaOH溶液 ⑥Fe与HNO3溶液 ⑦Fe与H2SO4溶液 ⑧Na与O2(1)由于浓度不同而发生不同氧化还原反应的是_________(填序号,下同)。(2)由于温度不同而发生不同氧化还原反应的是_________。(3)氧化还原反应不受浓度、温度影响的是_____。
⑥Fe和浓HNO3常温下钝化,加热继续反应;Fe和稀HNO3反应,HNO3被还原成NO。⑦Fe和浓H2SO4常温下钝化,加热继续反应;Fe和稀H2SO4反应生成FeSO4和H2。
5.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+===3Fe2+。则Fe2+、Ag+、Tl3+的氧化性由强到弱的顺序是_______________。
Tl3+>Ag+>Fe2+
二、实验探究物质氧化性或还原性的强弱6.验证氧化性强弱:Cl2>Br2>I2,设计如下实验(已知:稀溴水呈黄色,浓溴水呈红棕色,碘水呈棕黄色;忽略氧气的影响)。下列说法不正确的是
A.实验①设计目的:排除实验②③④水稀释的影响B.实验②发生反应为2Br-+Cl2===Br2+2Cl-C.实验③的现象可以证明氧化性:Cl2>I2D.实验④能证明氧化性:Br2>I2
实验①是将氯水加入蒸馏水将其稀释,后续实验都是在溶液中进行的,这样可以排除实验②③④水稀释的影响,故A正确;溶液变为黄色是因为产生溴单质,说明氯气可以将溴单质置换出来,发生的反应为2Br-+Cl2===Br2+2Cl-,故B正确;溶液变为棕黄色是因为产生碘单质,说明氯气可以将碘单质置换出来,发生的反应为2I-+Cl2===I2+2Cl-,可以证明氧化性:Cl2>I2,故C正确;②反应后的黄色溶液是含有溴单质的溶液,但是不能排除含有氯单质,加入淀粉碘化钾溶液会变蓝,证明产生了碘单质,可能是氯气或是溴单质置换出了碘单质,不能证明氧化性:Br2>I2,故D错误。
(1)利用化学反应比较物质氧化性或还原性的强弱,关键是分析出氧化剂、还原剂以及对应的还原产物和氧化产物。氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。(2)利用某些实验手段,证明物质具有氧化性或还原性时,①选择的化学反应有明显的实验现象;②要注意控制单一变量。
1.(2023·全国乙卷,7)下列应用中涉及到氧化还原反应的是A.使用明矾对水进行净化B.雪天道路上撒盐融雪C.暖贴中的铁粉遇空气放热D.荧光指示牌被照发光
明矾水解生成氢氧化铝胶体,能吸附水中的悬浮颗粒并沉降使水变得澄清,没有涉及到氧化还原反应,A不符合题意;雪遇到盐而熔点降低并熔化,未发生化学反应,B不符合题意;使用暖贴时,铁粉与空气中的O2发生氧化还原反应,C符合题意;荧光指示牌被照发光,是因为光被指示牌反射,D不符合题意。
2.(2023·浙江1月选考,6)关于反应2NH2OH+4Fe3+===N2O↑+4Fe2++4H++H2O,下列说法正确的是A.生成1 ml N2O,转移4 ml电子B.H2O是还原产物C.NH2OH既是氧化剂又是还原剂D.若设计成原电池,Fe2+为负极产物
由方程式可知,反应生成1 ml一氧化二氮,转移4 ml电子,故A正确;该反应中H、O元素化合价不变,H2O既不是氧化产物,也不是还原产物,还原产物为Fe2+,故B错误;由方程式可知,反应中氮元素的化合价升高被氧化,NH2OH是反应的还原剂,铁元素的化合价降低被还原,铁离子是反应的氧化剂,故C错误;由方程式可知,反应中铁元素的化合价降低被还原,铁离子是反应的氧化剂,若设计成原电池,铁离子在正极得到电子发生还原反应生成亚铁离子,亚铁离子为正极产物,故D错误。
3.下列判断不正确的是____(填字母)。A.Na-的还原性比Na的强(2021·湖北,13B)B.硫代碳酸钠(Na2CS3)常用于处理废水中的重金属离子,不能被氧化(2022·湖北,8A)C.在稀H2SO4中加入少量Cu2O(s),溶液由无色变为蓝色并有红色固体生成,反应中 Cu2O既作氧化剂又作还原剂(2021·海南,14D)D.浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性更强 (2021·河北,10D)
A正确,Na-的半径比Na的大,Na-中原子核对最外层电子的吸引力小,失电子能力增强;B错误,Na2CS3中硫元素为-2价,还原性比较强,能被氧化;C正确,发生歧化反应:Cu2O+2H+===Cu2++Cu+H2O;D错误,铜与浓硝酸反应比与稀硝酸反应剧烈,故浓硝酸的氧化性大于稀硝酸。
4.[2020·天津,13(3)节选]Fe、C、Ni能与Cl2反应,其中C和Ni均生成二氯化物,由此推断FeCl3、CCl3和Cl2的氧化性由强到弱的顺序为_________________。
CCl3>Cl2>FeCl3
由Fe与Cl2反应生成FeCl3可知,氧化性:Cl2>Fe3+;由C和Cl2反应只生成CCl2可知,氧化性:C3+>Cl2。综上分析,FeCl3、CCl3和Cl2三者氧化性由强到弱的顺序为CCl3>Cl2>FeCl3。
1.(2023·烟台模拟)中华传统文化中富含化学知识,下列叙述与氧化还原反应无关的是A.熬胆矾铁釡,久之亦化为铜B.千锤万凿出深山,烈火焚烧若等闲C.落红不是无情物,化作春泥更护花D.有舶上铁丝日久起销
“熬胆矾铁釜,久之亦化为铜”是指Fe与CuSO4溶液的置换反应,涉及氧化还原反应,A项不符合题意;“千锤万凿出深山,烈火焚烧若等闲”是指石灰石的煅烧,不涉及氧化还原反应,B项符合题意;“落红不是无情物,化作春泥更护花”是指有机物的腐败过程,涉及氧化还原反应,C项不符合题意;“有舶上铁丝日久起销”是指铁的吸氧腐蚀,涉及氧化还原反应,D不符合题意。
2.(2022·山东,1)古医典富载化学知识,下述之物见其氧化性者为A.金(Au):“虽被火亦未熟”B.石灰(CaO):“以水沃之,即热蒸而解”C.石硫黄(S):“能化……银、铜、铁,奇物”D.石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”
金(Au):“虽被火亦未熟”是指金单质在空气中被火灼烧也不反应,体现金的稳定性,与其氧化性无关,A不符合题意;石灰(CaO):“以水沃之,即热蒸而解”是指CaO+H2O===Ca(OH)2,反应放热,产生大量的水汽,而CaO由块状变为粉末状,未发生氧化还原反应,与其氧化性无关,B不符合题意;
石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”是指CaCO3+2CH3COOH===(CH3COO)2Ca+H2O+CO2↑,未发生氧化还原反应,与其氧化性无关,D不符合题意。
3.(2023·广州调研)陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是
用FeCl3溶液刻蚀铜质电路板过程中发生反应:2Fe3++Cu===Cu2++2Fe2+,氧化剂的氧化性强于氧化产物,即氧化性:Fe3+>Cu2+,A项正确;用Na2O2作呼吸面具的氧气来源时,Na2O2自身发生歧化反应,未氧化CO2,B项错误;用Na2S除去废水中的Cu2+和Hg2+是发生复分解反应的过程,与Na2S的还原性无关,C项错误;用石灰乳脱除烟气中的SO2过程中,先生成CaSO3,后被O2氧化为CaSO4,与SO2的氧化性无关,D项错误。
4.(2022·辽宁,6)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是A.褪色原因为I2被Fe还原B.液体分层后,上层呈紫红色C.镀锌铁钉比镀锡铁钉更易生锈D.溶液恢复棕色的原因为I-被氧化
Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,A项错误;液体分层后,I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,B项错误;若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,C项错误;漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,D项正确。
5.关于反应K2H3IO6+9HI===2KI+4I2+6H2O,下列说法正确的是A. K2H3IO6发生氧化反应B.KI是还原产物C.生成12.7 g I2时,转移0.1 ml电子D.还原剂与氧化剂的物质的量之比为7∶1
反应中K2H3IO6中I元素的化合价降低,发生得电子的还原反应,A错误;KI中的I-由HI变化而来,化合价没有发生变化,KI既不是氧化产物也不是还原产物,B错误;12.7 g I2的物质的量为0.05 ml,根据反应方程式,每生成4 ml I2转移7 ml电子,则生成0.05 ml I2时转移电子的物质的量为0.087 5 ml,C错误;反应中HI为还原剂,K2H3IO6为氧化剂,在反应中每消耗1 ml K2H3IO6就有7 ml HI失电子,则还原剂与氧化剂的物质的量之比为7∶1,D正确。
6.(2023·德州模拟)工业上以铜阳极泥(主要成分是Cu2Te)为原料提取碲,涉及反应:①Cu2Te+2O2+2H2SO4===2CuSO4+TeO2+2H2O,②TeO2+2SO2+2H2O===2H2SO4+Te。以下说法正确的是A.Cu2Te中Cu元素的化合价是+2价B.反应①中氧化剂是O2,氧化产物是TeO2C.每制备1 ml Te理论上共转移12 ml e-D.氧化性强弱顺序为O2>SO2>TeO2
Te为第ⅥA族元素,与Cu形成化合物时显-2价,则Cu2Te中Cu为+1价,A项错误;反应①中,Cu和Te元素化合价均升高,则氧化产物为CuSO4和TeO2,B项错误;反应②中每生成1 ml Te,转移4 ml电子,反应①中每生成1 ml TeO2,转移8 ml电子,则每制备1 ml Te,理论上共转移12 ml电子,C项正确;根据反应①判断,氧化剂的氧化性强于氧化产物,则O2氧化性强于TeO2,根据反应②判断,TeO2为氧化剂,SO2为还原剂,则TeO2氧化性强于SO2,D项错误。
7.(2021·湖南,8)KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为6I2+11KClO3+3H2O 6KH(IO3)2+5KCl+3Cl2↑。下列说法错误的是A.产生22.4 L(标准状况)Cl2时,反应中转移10 ml e-B.反应中氧化剂和还原剂的物质的量之比为11∶6C.可用石灰乳吸收反应产生的Cl2制备漂白粉D.可用酸化的淀粉碘化钾溶液检验食盐中 的存在
该反应中只有碘元素的价态升高,由0价升高至KH(IO3)2中的+5价,每个碘原子升高5价,即6I2~60e-,又因化学方程式中6I2~3Cl2,故3Cl2~60e-,即Cl2~20e-,所以产生22.4 L (标准状况) Cl2即1 ml Cl2时,反应中应转移20 ml e-,A错误;该反应中KClO3中氯元素价态降低,KClO3作氧化剂,I2中碘元素价态升高,I2作还原剂,由该化学方程式的计量数可知,11KClO3~6I2,故该反应的氧化剂和还原剂的物质的量之比为11∶6,B正确;漂白粉的有效成分是次氯酸钙,工业制漂白粉可用石灰乳与氯气反应,C正确;
8.(2023·青岛模拟)工业上以软锰矿(主要成分为MnO2)为主要原料制备高锰酸钾(KMnO4)的方法如图:已知:①焙烧时有K2MnO4和KCl生成。②CO2歧化法:调溶液pH至弱碱性,歧化生成KMnO4和MnO2。下列说法正确的是A.焙烧时所用坩埚的材质可以选用Al2O3B.焙烧时理论上每生成1 ml K2MnO4转移3NA个电子C.电解法与CO2歧化法的理论产率之比为3∶2D.采用CO2歧化法时,可将滤液蒸发结晶得到KMnO4固体
软锰矿中加入KOH和KClO3焙烧,生成K2MnO4和KCl,电解K2MnO4生成KMnO4,或者采用二氧化碳歧化法生成KMnO4。Al2O3可与KOH反应,因此焙烧时坩埚的材质不能选用Al2O3,A错误;
高锰酸钾受热易分解,应该采用蒸发浓缩、冷却结晶的方式得到KMnO4固体,D错误。
9.(2023·成都高三检测)科学家正在研究一种用乙烯(C2H4,沸点为-104 ℃)脱硫(SO2)的方法,其机理如图所示。下列关于该脱硫方法的说法正确的是A.氧化性:O2>SO3>CO2B.乙烯在该过程中作氧化剂C.该脱硫过程需要及时补充Cu+D.步骤ⅰ中,每消耗44.8 L C2H4,有2NA个S生成
步骤ⅲ是氧气和二氧化硫反应生成三氧化硫,则氧化性:O2>SO3,步骤ⅰ是三氧化硫和乙烯反应生成硫、二氧化碳和水,则氧化性:SO3>CO2,因此氧化性:O2>SO3>CO2,故A正确;乙烯和三氧化硫反应生成硫、二氧化碳和水,碳元素的化合价升高,说明乙烯在该过程中作还原剂,故B错误;Cu+在反应中作催化剂,Cu+质量不变,因此该脱硫过程不需要补充Cu+,故C错误;未标明是否为标准状况,无法计算物质的量,故D错误。
10.(2021·山东,13改编)实验室中利用固体KMnO4进行如图实验,下列说法错误的是A.G与H均为氧化产物B.实验中KMnO4既是氧化剂又是还原剂C.Mn元素至少参与了3个氧化还原反应D.G与H的物质的量之和可能为0.25 ml
加热KMnO4固体的反应中,O元素化合价由-2升高至0,被氧化,加热K2MnO4、MnO2与浓盐酸的反应中,Cl元素化合价由-1升高至0,被氧化,因此O2和Cl2均为氧化产物,故A正确;KMnO4固体受热分解过程中,Mn元素化合价降低被还原,部分O元素化合价升高被氧化,因此KMnO4既是氧化剂也是还原剂,故B正确;
Mn元素在反应过程中物质及化合价变化为 ,Mn元素至少参加了3个氧化还原反应,故C正确;
每生成1 ml O2转移4 ml电子,每生成1 ml Cl2转移2 ml电子,若KMnO4转化为MnCl2过程中得到的电子全部是Cl-生成Cl2所失去的,则气体的物质的量最大,由2KMnO4~5Cl2可知,n(气体)max=0.25 ml,但该气体中一定含有O2,因此最终所得气体的物质的量小于0.25 ml,故D错误。
11.氧化还原反应是一类重要的化学反应。(1)已知反应:Cu+2Fe3+===Cu2++2Fe2+,反应中还原剂是____,氧化性:Fe3+___(填“<”或“>”)Cu2+。(2)在2Na2O2+2CO2===2Na2CO3+O2反应中,若转移3 ml电子,则所产生的氧气在标准状况下的体积为____ L。(3)在xR2++yH++O2===mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是___(填字母)。A.m=y,R3+是还原剂B.m=2y,R2+被氧化C.m=2,R3+是氧化剂D.m=4,R2+是还原剂
根据氧原子守恒则n=2,根据氢原子守恒则y=4,根据R原子守恒则x=m,根据电荷守恒则2x+y=3m,所以x=y=m=4;在反应中,R的化合价升高,R2+是还原剂,则R3+是氧化产物,氧元素化合价降低,所以H2O是还原产物。
(4)用双线桥标出反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目。
12.(2023·济南高三模拟)CuI是难溶于水的白色固体。已知:氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+。(1)根据物质氧化性和还原性的强弱推测,在溶液中Cu2+和I-反应的产物是____、___。
氧化性:Cu2+>I2>Cu+,还原性:Cu>I->Cu+,所以Cu2+和I-反应,Cu2+被还原为Cu+、I-被氧化为I2,Cu+和I-结合生成难溶于水的CuI沉淀,所以反应的产物是CuI、I2。
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为_______________。
久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质,加入金属铜,金属铜可以和碘单质反应生成CuI,反应的化学方程式为2Cu+I2===2CuI。
2Cu+I2===2CuI
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性:H2S__(填“>”“<”或“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度___(填“高”“低”或“相等”)。
欲消除HI溶液的黄色,也可向其中通入少量H2S,碘单质可以和硫化氢反应生成单质硫和碘化氢,还原性:H2S>I-。
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg===Cu2HgI4(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是____(填字母)。A.该反应中被氧化的元素是铜元素和汞元素B.该反应的氧化剂为CuIC.Cu2HgI4既是氧化产物又是还原产物D.反应中每生成1 ml Cu2HgI4转移2 ml电子
该反应中Cu元素化合价由+1降低为0,被氧化的元素是汞元素,氧化剂为CuI,Cu2HgI4是氧化产物,反应中每生成1 ml Cu2HgI4转移2 ml电子。
13.某化学探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:Ⅰ.先向B中的FeCl2溶液(约10 mL)中通入Cl2,当B中溶液变黄时,停止通气。Ⅱ.打开活塞k,使约2 mL的溶液流入试管A中,检验取出溶液中的离子。Ⅲ.接着再向B中通入一定量的SO2气体。Ⅳ.更新试管A,重复过程Ⅱ,检验取出溶液中的离子。(1)棉花中浸润的溶液为__________,目的是_________________。
向B中的FeCl2溶液中通入氯气和二氧化硫,为防止多余的氯气和二氧化硫污染空气,需要将其除去,所以棉花中浸润的溶液为NaOH溶液。
(2)实验室制备氯气的化学方程式为_________________________________________。
实验室制备氯气用的是二氧化锰和浓盐酸在加热的条件下反应,化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
(3)过程Ⅲ中一定发生反应的离子方程式为_______________________________________;过程Ⅳ中检验取出溶液中是否含有硫酸根离子的操作是____________________________________________________________________________________________________________。
取少许溶液于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有
2Fe3++SO2+2H2O===
先向B中的FeCl2溶液中通入Cl2,B中的亚铁离子被氯气氧化为铁离子,再向B中通入一定量的SO2气体,铁离子被二氧化硫还原为亚铁离子,离子方程式为2Fe3++SO2+2H2O===2Fe2++ +4H+。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较得到的结论是_______________。(5)甲、乙、丙三位同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是_______。
SO2>Fe2+>Cl-
新高考化学一轮复习课件第1章 第4讲 氧化还原反应的概念和规律(含解析): 这是一份新高考化学一轮复习课件第1章 第4讲 氧化还原反应的概念和规律(含解析),共60页。PPT课件主要包含了应用举例,真题演练明确考向,课时精练等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第1章第3讲 氧化还原反应的概念和规律(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第1章第3讲 氧化还原反应的概念和规律(含解析),共60页。PPT课件主要包含了练真题明考向,课时精练等内容,欢迎下载使用。
大单元一 第一章 第3讲 氧化还原反应的概念和规律-2025年高考化学大一轮复习(人教版)【配套PPT课件】: 这是一份大单元一 第一章 第3讲 氧化还原反应的概念和规律-2025年高考化学大一轮复习(人教版)【配套PPT课件】,共60页。PPT课件主要包含了练真题明考向,课时精练等内容,欢迎下载使用。












