



所属成套资源:备战2025年高考化学工艺流程考点剖析与对点精练专题(全国通用)
剖析11 工艺流程中的热重曲线分析-备战2025年高考【化学工艺流程】考点剖析与对点精练(全国通用)
展开
这是一份剖析11 工艺流程中的热重曲线分析-备战2025年高考【化学工艺流程】考点剖析与对点精练(全国通用),文件包含剖析11工艺流程中的热重曲线分析-备战2025年高考化学工艺流程考点剖析与对点精练全国通用原卷版docx、剖析11工艺流程中的热重曲线分析-备战2025年高考化学工艺流程考点剖析与对点精练全国通用解析版docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
(1)分析方法
热重法是在控制温度的条件下,测量物质的质量与温度关系的方法,通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、热分解情况及生成产物等与质量相联系的信息。金属化合物的热重分析研究对象一般为各种金属含氧酸盐、金属氢氧化物、金属氧化物的热分解过程,一般为先失水、再分解、后氧化。
例如CC2O4·2H2O在空气中加热时,受热分解过程分为三个阶段:
第一阶段,失去结晶水生成盐:CC2O4·2H2O→CC2O4。
第二阶段,盐受热分解生成氧化物:CC2O4→CO。
第三阶段,低价态氧化物与空气中的氧气反应生成高价态氧化物:CO→C2O3(或C3O4)。
注意:
①每个阶段有可能还分为不同步骤,如第一阶段中可能分步失去不同的结晶水,而不是一步失去所有的结晶水。
②如果是变价金属元素,则在空气中加热产物可能为多种价态的金属氧化物。
(2)基本方法和思路
①设晶体(金属化合物)为1 ml,其质量为m。
②失重一般是先失水,再失非金属氧化物。
③计算每步固体剩余的质量m(余),eq \f(m剩余,m1 ml晶体质量)×100%=固体残留率。
④晶体中金属质量不再减少,仍在m(余)中。
⑤失重最后一般为金属氧化物,由质量守恒得m(氧元素),由n(金属)∶n(氧元素),即可求出失重后物质的化学式。
例如:“煅烧”NiSO4·6H2O晶体时剩余固体质量与温度变化曲线如图,该曲线中 B 段所表示氧化物的名称为______。
解题思路:n(NiSO4·6H2O)==0.1 ml,含有m(H2O)=0.1 ml×6×18 g·ml-1=10.8 g,根据26.3g-15.5g=10.8g,恰好说明280 ℃以前失去的结晶水;所以A段对应的物质就是0.1 ml的NiSO4;温度到600 ℃,固体的质量再次下降,得到最终的镍的氧化物;根据原子守恒,8.3 g氧化物中Ni的质量为5.9 g,那么O的质量为2.4 g即0.15 ml,所以固体氧化物中n(Ni)∶n(O)=2∶3,所以固体氧化物即三氧化二镍。
(3)热重分析曲线基本图示
一般以横坐标为温度,纵坐标为固体质量(或质量分数等)建立平面直角坐标。如固体物质A受热分解:A(s)B(s)+C(g),固体A热分解反应的热重曲线如图所示:
试样初始质量为m0,失重后试样质量为m1,由T1升高到T2过程,失重质量为Δm=m0-m1,失重质量百分数为eq \f(m0-m1,m0)×100%。
①识图。识图的关键是三看:一看轴即横、纵坐标所表示的化学含义(自变量x轴和函数y轴表示的意义),寻找x、y轴之间的关系,因为这是理解题意和进行正确思维的前提;二看点即曲线中的特殊点(顶点、始点、终点、拐点、交叉点);三看线即曲线的走势(变化趋势是上升、下降、波动、正态、偏态等变化)。
②析图。分析图中为什么会出现这些特殊点,曲线为什么有这样的变化趋势和走向,分析曲线变化的因果关系,通过联想,把课本内的有关化学概念、原理、规律等与图像曲线中的图形与相关点建立联系。
③用图。将相关的化学知识与图像曲线紧密结合,在头脑中构建新的曲线——知识体系,然后运用新的曲线——知识体系揭示问题的实质,解决实际问题。
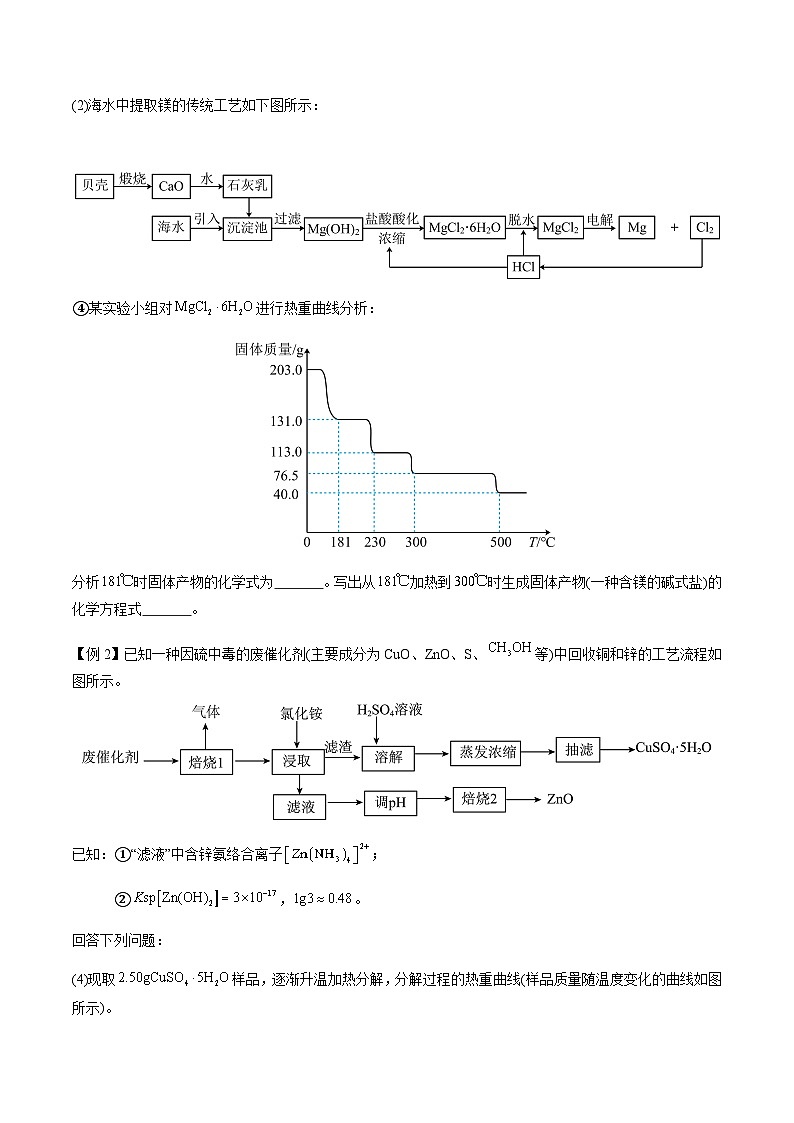
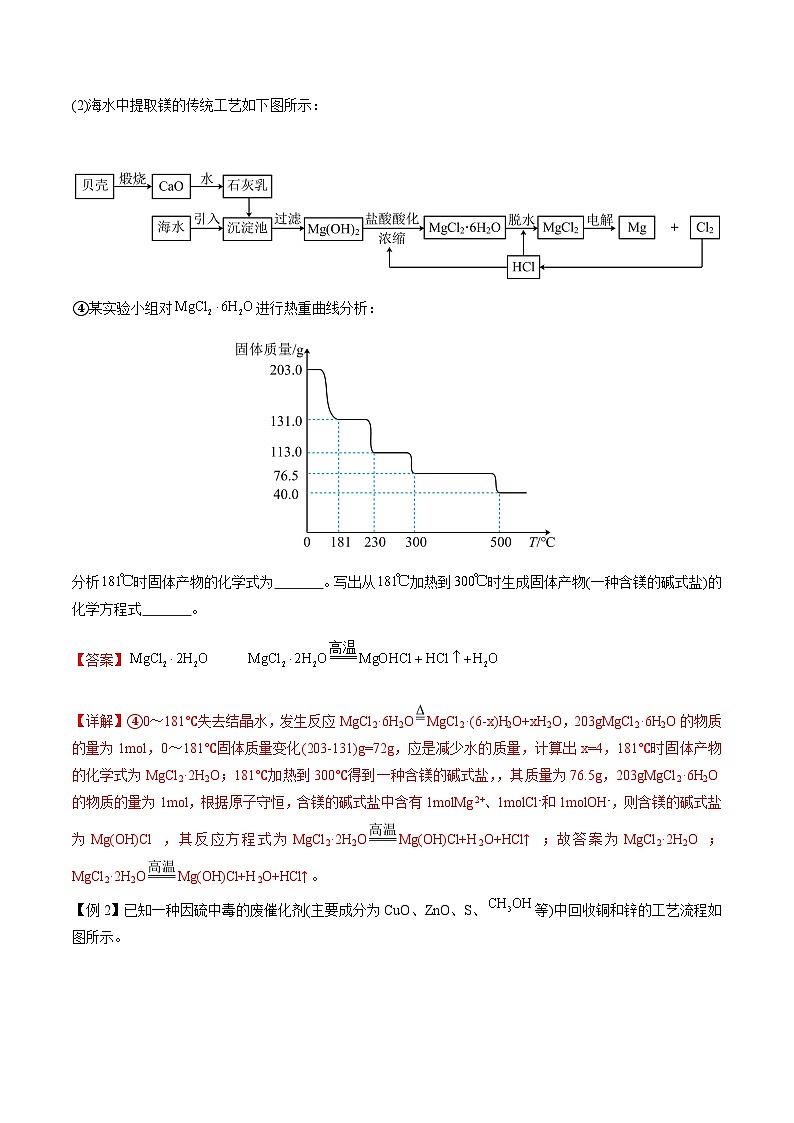
【例1】海水中蕴含着丰富的资源,氯碱工业、海水提镁、海水提溴为人类提供了大量的工业原料。
(2)海水中提取镁的传统工艺如下图所示:
④某实验小组对进行热重曲线分析:
分析时固体产物的化学式为 。写出从加热到时生成固体产物(一种含镁的碱式盐)的化学方程式 。
【答案】
【详解】④0~181℃失去结晶水,发生反应MgCl2·6H2OMgCl2·(6-x)H2O+xH2O,203gMgCl2·6H2O的物质的量为1ml,0~181℃固体质量变化(203-131)g=72g,应是减少水的质量,计算出x=4,181℃时固体产物的化学式为MgCl2·2H2O;181℃加热到300℃得到一种含镁的碱式盐,,其质量为76.5g,203gMgCl2·6H2O的物质的量为1ml,根据原子守恒,含镁的碱式盐中含有1mlMg2+、1mlCl-和1mlOH-,则含镁的碱式盐为Mg(OH)Cl,其反应方程式为MgCl2·2H2OMg(OH)Cl+H2O+HCl↑;故答案为MgCl2·2H2O;MgCl2·2H2OMg(OH)Cl+H2O+HCl↑。
【例2】已知一种因硫中毒的废催化剂(主要成分为CuO、ZnO、S、等)中回收铜和锌的工艺流程如图所示。
已知:①“滤液”中含锌氨络合离子;
②,。
回答下列问题:
(4)现取样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线如图所示)。
生成CuO的温度范围为 ,1000℃时发生反应的化学方程式为 。
【答案】(4)680~1000℃
【详解】(4),根据铜原子守恒,当固体为CuO时,n(CuO)=0.01ml,其质量为0.01ml×80g/ml=0.80g,根据图像可知,焙烧生成CuO的温度范围是680~1000℃;1000℃时得到产物中m(Cu)=0.64g,m(O)=(0.72-0.64)g=0.08g,n(O)=0.005ml,则所得物质的化学式为Cu2O,反应方程式:;
【例3】在生物制药、废水处理、电极材料中有重要应用。一种以软锰矿(主要成分为,含有少量铁、铝、镁和硅的氧化物)、硫铁矿(主要成分为为原料制备,的工艺流程如图。
已知:①相关金属离子(浓度为)形成氢氧化物沉淀的pH范围:
②一些难溶电解质的溶度积常数:
③在酸性条件下比较稳定,高于5.5时易被氧化
请回答:
(5)在空气中加热转化为不同价态锰的氧化物,热重曲线如图,图中点对应固体的成分为 (填化学式)。
【答案】(5)MnO
【详解】(5)设MnCO3的物质的量为1ml,即质量为115g,C点剩余固体的质量为,根据锰元素守恒可知,m(Mn)=55g,m(O)=71g-55g=16g,则,故C点固体的成分为MnO。
1.利用铝锂钴废料(主要成分为,还含有少量铝箔、等杂质)制备的工艺流程如图所示。
已知:具有较强氧化性,均难溶于水。
回答下列问题:
(5)在空气中热分解的热重曲线(剩余固体质量分数随温度变化情况)如图,则时剩余的固体为钴的氧化物,则该钴的氧化物的化学式为 。
`
【答案】(5)
【详解】(5)设起始投入(即)参与反应,则时剩余的固体的质量为,由此可推知剩余固体中,钴元素的物质的量为(即),氧元素的质量为(约为),故剩余固体的化学式为。
2.从石油废催化剂(主要含有Al2O3、V2O5、Ni、M、Fe等)中回收钒、钼,是提取这些紧缺金属的重要方法。国内采用的一种工业流程如下:
回答下列问题:
(4)钼酸铵溶液可以结晶出二钼酸铵[(NH4)2M2O7,相对分子质量为340],取少量晶体,一定条件下受热分解的热重曲线如图所示:
则597℃时,二钼酸铵热分解的化学方程式为 。
【答案】
【详解】(4)设有1 ml (NH4)2M2O7,则其质量为340g,在597℃时,固体损失340 g×(1-84.7%)=52 g,因为铵盐受热易分解,结合分解前后固体质量变化分析可知,固体损失的质量为2 ml NH3与1 ml H2O的质量,所以余下固体应为MO3,发生反应的化学方程式为:。
3.五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂中(含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等)回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:
已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO和VO2+。
②有机萃取剂萃取VO2+的能力比萃取VO的能力强。
③溶液中VO与VO可相互转化:VO+H2OVO+2H+且NH4VO3为沉淀
(6)25.35gMnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
①300℃时,所得固体的化学式为 ,850℃时,所得固体的化学式为 。
②1150℃时,反应的化学方程式为 。
【答案】(6)MnSO4 MnO2 3MnO2Mn3O4+O2↑
【详解】(6)25.35gMnSO4•H2O的物质的量为=0.15ml,其中结晶水的质量为0.15ml×18g/ml=2.7g,若晶体全部失去结晶水,固体的质量应为25.35g-2.7g=22.65g,由此可知在加热到280℃~850℃之前,晶体失去结晶水,故第一个失重台阶减少的是结晶水,生成硫酸锰;温度为850℃时,固体质量为13.05g,若得到的固体为MnO2,由Mn元素守恒可知,MnO2的物质的量为0.15ml,则MnO2的质量为0.15ml×87g/ml=13.05g,与实际相符,则850℃是MnSO4分解生成MnO2与SO2;1150℃时,则Mn的物质的量为0.15ml,则剩余的O的物质的量为: =0.2ml,则n(Mn):n(O)=0.15:0.20=3:4,即此时固体的化学式为Mn3O4,据此分析解题:
①结合分析可知,加热到850℃之前,晶体失去结晶水,生成硫酸锰,850℃发生反应的化学方程式为:MnSO4MnO2+SO2↑,故答案为:MnSO4;MnO2;
②由上述分析可知,1150℃时,则Mn的物质的量为0.15ml,则剩余的O的物质的量为: =0.2ml,则n(Mn):n(O)=0.15:0.20=3:4,即此时固体的化学式为Mn3O4,根据氧化还原反应配平可知,此时发生的反应方程式为:3MnO2Mn3O4+O2↑,故答案为:3MnO2Mn3O4+O2↑。
4.某废镍催化剂的主要成分是合金,还含有少量及不溶于酸碱的有机物。采用如下工艺流程回收其中的镍制备镍的氧化物:
回答下列问题:
(5)在空气中煅烧,其热重曲线如图所示。转化为,反应的化学方程式为 ;生成产物的化学式为 。
【答案】(5)
【详解】(5)转化为,反应的化学方程式为;设1ml 在下分解为,1ml 的质量为,由图可知,在下分解固体残留率为67.5%,则分解后的质量为,根据Ni原子守恒可知,生成的物质的量为,=80.3g,得到,故生成产物的化学式为;
5.以锌渣(主要成分是,含少量等)为原料提取和,其流程如图。回答下列问题:
(6)的热重曲线如图所示(已知:a点时未分解)。
d点对应的固体化学式为_______(填标号)。
A.B.C.ZnOD.
【答案】(6)B
【详解】(6)28.7g的物质的量为0.1ml,随着温度升高,开始分解,分解过程中,Zn元素的质量保持不变,最终全部转化为ZnO,质量应为,即e点,可见C点既有氧化锌也有硫酸锌,故选B。
6.工业上可用红土镍矿(主贾成分为NiO、FeO、Fe2O3)制备镍并回收副产物黄铵铁矾 [化学式可表示为(NH4)xFey(SO4)z(OH)w,摩尔质量为480 g·ml-1]的上艺流程如下。
(6)Min Ristic等曾对黄铵铁矾进行热分解实验。其结果可用下图热重曲线表示(已知:黄铵铁矾在300℃前分解释放的物质为H2O,300-575℃之间只有NH3和H2O放出,此时残留固体只存在Fe、O、S三种元素,670℃以上得到的是纯净的红棕色粉末)。
根据以上实验及图中数据确定黄铵铁矾的化学式为 。
【答案】NH4Fe3(SO4)2(OH)6
【详解】(6)设有480g物质分解。670℃以上为红棕色纯净物,则其物质的量为,即y=3;在固体质量时,分析可知,该产物为和,则,即z=2;化合物中各元素化合价代数和为0,则,解得,所以该物质的化学式为:NH4Fe3(SO4)2(OH)6,故答案为:NH4Fe3(SO4)2(OH)6。
7.一种新型的“水浸一分步沉淀法”实现了以不锈钢酸洗污泥(主要含有、等组分)为原料,高效回收金属镍铁铬。其流程示意图如图所示。
已知:Ⅰ.时溶度积:;
Ⅱ.性质与类似。
回答下列问题:
(7)将草酸亚铁晶体在空气中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示。其中B点时,固体只含有一种铁的氧化物,则B点的固体物质为 。
【答案】(7)
【详解】(7),故草酸亚铁晶体为点时,固体只有一种铁的氧化物,由于铁元素守恒,则B中铁的物质的量仍为,即,则,,则该含铁氧化物的化学式为,则晶体时受热分解的化学方程式为。
8.是一种重要催化剂。某科研小组以废弃催化剂(主要成分为,还含有等)为原料制备晶体的工艺流程如图所示。
一些难溶电解质的溶度积常数()如下表:
回答下列问题:
(5)“沉镍”过程生成碱式碳酸镍。为测定该沉淀的组成,称取纯净干燥沉淀样品,隔绝空气加热,该化合物的热重曲线如图所示,以上固体质量不再变化。通过计算确定该沉淀的化学式为 。
【答案】(5)
【详解】(5)由图可知第一阶段失去的成分为结晶水,,第二阶段失去的成分为和,最后残留物是NiO,故。
设样品中的物质的量为a,的物质的量为b
根据Ni元素守恒,Ni的总物质的量为:①
第二阶段失去的成分为和总质量为②
联立①②,解得,故。
9.碱式硫酸镁晶须是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含等)为原料制备碱式硫酸镁晶须的流程如图:
回答下列问题:
(5)将碱式硫酸镁晶须进行热重分析测定其化学式,热重曲线[样品的固体残留率()随温度变化](微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为 ;第二次失重发生反应的化学方程式为 。
②图2中的晶胞参数为为阿伏加德罗常数的值,则晶胞中白球的配位数为 ,该晶体的密度为 。
【答案】(5) 6
【详解】
(5)①氢氧化镁受热易分解生成氧化镁和水,而硫酸镁性质稳定,受热不易分解,则碱式硫酸镁晶须受热三次失重发生的反应分别为碱式硫酸镁晶须受热失去结晶水、氢氧化镁受热分解生成氧化镁和水、硫酸镁受热分解生成氧化镁和三氧化硫,设碱式硫酸镁晶须的质量为100g,由图可知,结晶水的质量为100g×8.07%=8.07g,氢氧化镁分解生成水的质量为100g×20.18%=20.18g,硫酸镁分解生成三氧化硫的质量为100g×17.94%=17.94g,由原子个数守恒可知,x:y:z=::≈1:5:2,则碱式硫酸镁晶须的化学式为,所以第二次失重发生反应的化学方程式为,故答案为:;
②由晶胞结构可知,晶胞中位于体心的黑球与位于面心的白球的距离最近,则黑球的配位数为6,由氧化镁的化学式为MgO可知,白球的配位数也为6;晶胞中位于顶点和面心的白球个数为8×+6×=4,位于棱上和体心的黑球个数为12×+1=4,设晶体的密度为dg/cm3,由晶胞的质量公式可得:=(10—7 a)3d,解得d=,故答案为:6;。
10.一种利用废脱硝催化剂(含、、等成分)提取钛、钒的工艺流程如下图所示:
已知:①钛酸钠难溶于水;
②溶液的酸性较强时,价钒主要以的形式存在。
③溶液中某离子浓度,认为该离子沉淀完全。
回答下列问题:
(6)焙烧过程发生反应:
(ⅰ)
(ⅱ)
现对样品进行焙烧,根据上述原理在如图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值 。
【答案】(6)
【详解】(6)由方程式可知,150~200℃时偏钒酸铵受热分解生成氨气和偏钒酸,则234g偏钒酸铵完全分解生成偏钒酸时固体减少质量为×17g/ml=34g,250~300℃时偏钒酸受热分解生成水和五氧化二钒,则偏钒酸完全分解生成五氧化二钒时固体减少质量为××18g/ml=18g,固体共减少52g,所以焙烧过程大致的热重变化曲线为。
11.废旧铅蓄电池会导致铅污染,国内外对废蓄电池的湿法处理进行了广泛研究,RSR工艺回收铅是其成果之一。具体化工流程如下:
已知:Ⅰ.铅膏主要成分是、;
Ⅱ.是强酸;
Ⅲ.。
回答下列问题:
(6)已知焙烧可制得铅的氧化物,为了研究其产物成分取进行焙烧,其热重曲线如图所示,请写出500℃时所得铅的氧化物的化学式 。
【答案】
【详解】(6)由题给图示可知,500℃时,焙烧后得到固体的质量为4.46g,5.34g碳酸铅的物质的量为=0.02ml,由铅原子个数守恒可知固体中铅的质量为0.02ml ×207g/ml=4.14g<4.46g,则含氧化物中铅原子和氧原子的物质的量比为0.02ml:=1:1,铅的氧化物的化学式PbO,故答案为:PbO。
12.钕铁硼废料中主要成分为、铁、硼、铝等,还有少量的硅酸盐。在实验室中回收钕铁硼废料中的稀土等元素的工艺流程如图所示:
已知:
①硼在非氧化性酸中难溶,的主要化合价为难溶于水和稀酸。
②该工艺条件下,金属离子形成氢氧化物沉淀的范围如下:
(6)热重法是测量物质的质量与温度关系的方法。草酸钕晶体(相对分子质量为732)的热重曲线如图所示,加热到时,只剩余一种物质,该物质的化学式为 。
【答案】(6)
【详解】(6)结合受热分解的质量变化计算,的相对分子质量为,当加热到,剩余固体的相对分子质量为,减少的相对分子质量为,说明该温度下,结晶水已经全部丢失;再升高温度,将开始分解,此时固体物质的相对分子质量。加热到时,剩余固体质量的占比为,由于此时已经没有了结晶水,根据的相对原子质量为,所以可以推出剩余固体的化学式为:。答案为:。金属离子
开始沉淀的
8.1
6.3
1.8
8.9
3.0
沉淀完全的
10.1
8.3
3.2
10.9
4.7
难溶电解质
(室温)
难溶电解质
金属离子
开始沉淀时
6.3
1.5
3.4
完全沉淀时(离子浓度:)
8.3
2.8
4.7
相关试卷
这是一份剖析10 工艺流程中的计算-备战2025年高考【化学工艺流程】考点剖析与对点精练(全国通用),文件包含剖析10工艺流程中的计算-备战2025年高考化学工艺流程考点剖析与对点精练全国通用原卷版docx、剖析10工艺流程中的计算-备战2025年高考化学工艺流程考点剖析与对点精练全国通用解析版docx等2份试卷配套教学资源,其中试卷共49页, 欢迎下载使用。
这是一份剖析09 化学工艺流程的评价-备战2025年高考【化学工艺流程】考点剖析与对点精练(全国通用),文件包含剖析09化学工艺流程的评价-备战2025年高考化学工艺流程考点剖析与对点精练全国通用原卷版docx、剖析09化学工艺流程的评价-备战2025年高考化学工艺流程考点剖析与对点精练全国通用解析版docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
这是一份剖析07 工艺流程中循环物质的确定-备战2025年高考【化学工艺流程】考点剖析与对点精练(全国通用),文件包含剖析07工艺流程中循环物质的确定-备战2025年高考化学工艺流程考点剖析与对点精练全国通用原卷版docx、剖析07工艺流程中循环物质的确定-备战2025年高考化学工艺流程考点剖析与对点精练全国通用解析版docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。









