




河北省石家庄市第一中学2024-2025学年高二上学期开学考试化学试题(Word版附解析)
展开
这是一份河北省石家庄市第一中学2024-2025学年高二上学期开学考试化学试题(Word版附解析),文件包含河北省石家庄市第一中学2024-2025学年高二上学期开学考试化学试题Word版含解析docx、河北省石家庄市第一中学2024-2025学年高二上学期开学考试化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Cu-64 Zn-65 Fe-56
1. 化学与社会、科学、技术、环境密切相关。下列说法正确的是
A. 水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品
B. 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中
C. 利用高纯二氧化硅的半导体性能,可以制成光电池,将光能(比如太阳光能)直接转化为电能
D. 透明氧化铝陶瓷具有良好的光学性能且耐高温耐腐蚀,可用于制造高压钠灯发光管
2. 下列说法或表示方法正确的是
A. 80mL10ml/L浓盐酸与过量MnO2加热反应,生成Cl2的分子数为
B. 0.1mlH2和0.1mlI2于密闭容器中充分反应后,HI分子总数为
C. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为
D. 在稀溶液中,,若将含0.5mlH2SO4的浓硫酸与含1mlNaOH的溶液混合,放出的热量大于57.3kJ
3. 探究铜和浓硫酸的反应,下列装置或操作错误的是
A. 上下移动装置甲中的铜丝体现绿色化学的思想
B. 装置乙可用于收集SO2气体
C. 将试管中的液体倒入装置丙中稀释,观察颜色可确定CuSO4的生成
D. 利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4∙5H2O
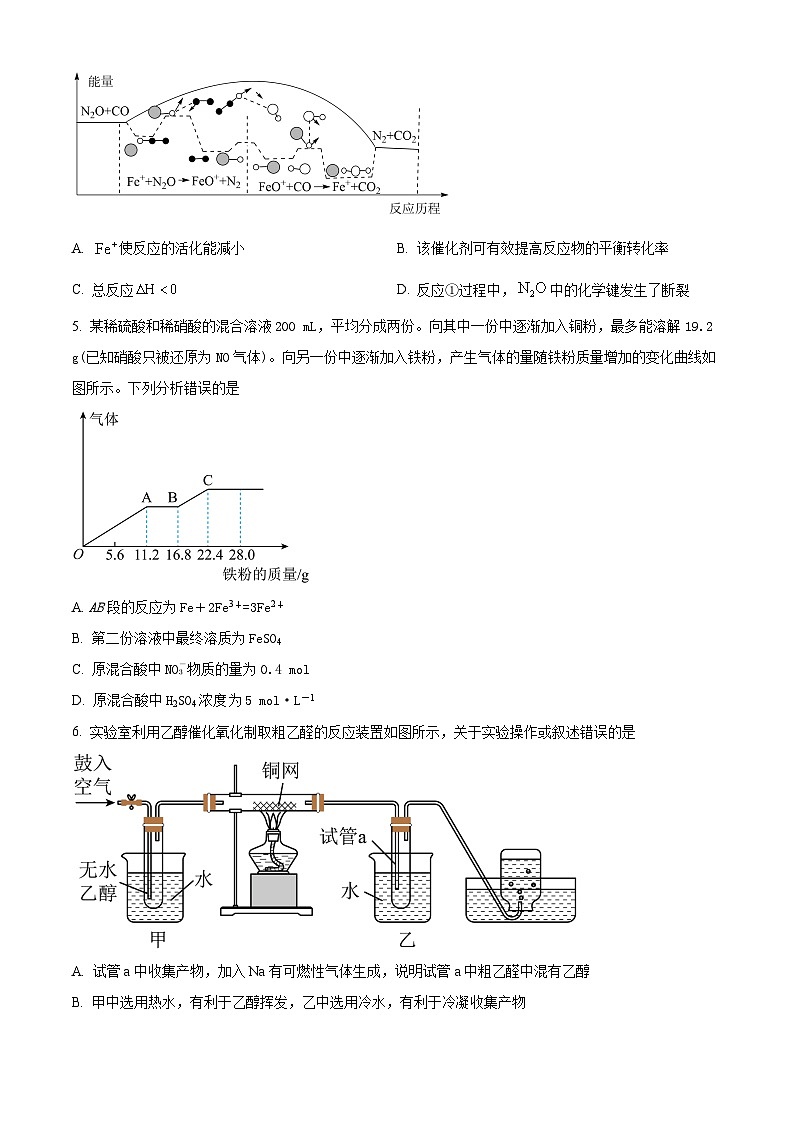
4. 研究表明与CO在的作用下会发生反应①、②其能量变化示意图如图所示。下列说法错误的是
A. 使反应的活化能减小B. 该催化剂可有效提高反应物的平衡转化率
C. 总反应D. 反应①过程中,中的化学键发生了断裂
5. 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。下列分析错误的是
A. AB段的反应为Fe+2Fe3+=3Fe2+
B. 第二份溶液中最终溶质为FeSO4
C. 原混合酸中NO物质的量为0.4 ml
D. 原混合酸中H2SO4浓度5 ml·L-1
6. 实验室利用乙醇催化氧化制取粗乙醛的反应装置如图所示,关于实验操作或叙述错误的是
A. 试管a中收集产物,加入Na有可燃性气体生成,说明试管a中粗乙醛中混有乙醇
B. 甲中选用热水,有利于乙醇挥发,乙中选用冷水,有利于冷凝收集产物
C. 该反应中铜为催化剂,硬质玻璃管中铜网出现红黑交替现象
D. 本实验中,可以利用蒸馏的分离方法除去试管a内乙醛中的杂质
7. 一定温度下,在某密闭容器中发生反应:,若0~15s内c(HI)由0.1ml/L降到0.07ml/L,则下列说法正确的是
A. 0~15s内用I2表示平均反应速率为
B. c(HI)由0.07ml/L降到0.05ml/L所需的反应时间小于10s
C. 升高温度,正反应速率加快,逆反应速率减慢
D. 减小反应体系的容积,化学反应速率加快
8. 已如反应N2O4(g)2NO2(g)ΔH>0的平衡体系中,物质的总质量(m总)与总物质的量(n总)之比M(M=)在不同温度下随压强的变化曲线如图所示。下列说法正确的是
A. 温度:T1>T2
B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:vb<va
D. 当M=69g·ml-1时,nNO2):n(N2O4)=1:1
9. 25℃下列四种溶液:①c(H+)=1ml·L-1的醋酸②0.1ml·L-1的盐酸③0.01ml·L-1的NaOH溶液 ④c(OH-)=10-3ml·L-1氨水溶液。由水电离出的氢离子浓度之比为
A. 1∶10∶100∶1000B. 0∶1∶12∶11
C. 14∶13∶12∶11D. 14∶13∶2∶3
10. 已知反应,在某温度下的平衡常数为400。此温度下,在密闭容器中加入,反应进行到某时刻测得各组分的浓度如下:
下列叙述中正确的是
A. 该反应的平衡常数表达式为
B. 该时刻正、逆反应速率的大小:
C. 平衡时
D. 若加入后,经反应达到平衡,该时间内反应速率
11. 25℃时,下列说法不正确的是
A. 稀释醋酸溶液,溶液中和数目都增大
B. 在醋酸溶液中加入至溶液为中性,此时
C. pH相等的和溶液,水的电离程度相同
D. 已知溶液显中性。常温下等浓度的和,若前者的,后者的,则
12. 已知0.1ml/L的NaHSO3溶液的pH=4,则溶液中各粒子的浓度关系不正确的是
A. c()>c(H2SO3)
B. c(Na+)>c()>c(H+)>c()>c(OH-)
C. c(H+)+c(Na+)=c(OH-)+2c()+c()
D. c(Na+)= c()+c(H2SO3)+ 2c()
13. 下列说法正确的是
A. 25℃时,pH=9的Na2CO3溶液和pH=5的FeCl3溶液中,水的电离程度相同
B. 在盐的水解过程中,水的电离程度不一定增大
C. 在含Al3+总数为的AlCl3溶液中,Cl-总数为
D. 等物质的量浓度的下列物质的溶液:①NH4Cl、②NH4HSO4、③Na2S、④NaNO3,pH由大到小的顺序为③>①>④>②
14. 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是
A. 图甲:锌铜水果电池工作时,电子由锌经导线流向铜
B. 图乙:正极的电极反应式为
C. 图丙:锌筒作负极,发生氧化反应,锌筒会变薄,且外电路每转移1ml电子消耗锌32.5g
D. 图丁:铅蓄电池为二次电池,电池放电过程中,负极的电极反应式为
15. 以酚酞为指示剂,用0.1000 ml·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:]
下列叙述正确的是
A. 曲线①代表,曲线②代表
B. H2A溶液的浓度为0.2000 ml·L−1
C. HA−的电离常数Ka=1.0×10−2
D. 滴定终点时,溶液中
16. 硫代硫酸钠(Na2S2O3)常用作分析试剂及还原剂,易溶于水。某实验小组用如图装置(夹持、加热仪器已略去)制备硫代硫酸钠并测定其纯度。
回答下列问题:
(1)仪器组装完成后,关闭两端活塞,向装置B中长颈漏斗内注入液体至形成一段液柱,若_______,则整个装置气密性良好。
(2)仪器a的名称是_______;装置D的作用是_______。
(3)装置A中发生反应的化学方程式为_______。
(4)装置C中的反应分两步:第一步通入SO2后溶液中浓度明显增大,则第一步反应的离子方程式为_______;第二步反应为。已知第二步反应相对较慢,则装置C中反应达到终点的现象是_______。
(5)将制得的样品溶于水,加入碘水溶液时,二者恰好完全反应(),则样品的纯度为_______。
17. 自然资源的开发是利用化学服务社会的重要努力方向。以铝土矿(主要成分为,含少量和等杂质)为原料制备铝的一种工艺流程如下:
(1)“碱溶”时生成四羟基合铝酸钠的离子方程式为_______,“滤渣”的成分主要是_______(填化学式)。
(2)向“过滤I”所得滤液中加入溶液发生反应的化学方程式为_______。
(3)用化学方程式表示“电解I”发生的变化_______。
(4)以金红石(主要成分为为原料生产金属钛的步骤主要为:高温下,向金红石和焦炭的混合物中通入,得到,和一种可燃性气体,在稀有气体(如氩)氛围和加热的条件下。用和,反应可得到单质钛。请写出上述生产步骤中发生反应的化学方程式_______,_______,稀有气体氛围的作用是_______。
18. 完成下列各题:
(1)一定温度下,在2L的密闭容器中,X、Y、Z (均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:
①该反应的化学方程式为_______,0到2min时,用物质X表示的反应速率为_______。
②不能说明反应已达到平衡状态的是_______(填序号)。
A.
B.X物质的量不变
C.混合气体的平均相对分子质量不变
D.X、Y的物质的量之比不变
E.容器内压强保持不变
F.单位时间内消耗3mlX,同时生成2mlZ
(2)对于反应,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
①343K时反应的平衡转化率α=_______%。
②比较a、b处反应速率大小:_______(填“大于”“小于”或“等于”);反应速率,分别为正、逆向反应速率常数,x为物质的量分数,计算a处的_______(保留1位小数)。
(3)利用反应构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
A电极的电极反应式为_______。
19. A~I是常见有机物,A是烃,E的分子式为C4H8O2,H为有香味的油状物质。
已知:
(1)0.2mlA完全燃烧生成17.6gCO2和7.2gH2O,则A的结构简式为_______。
(2)B分子中含有官能团的名称为_______。
(3)①的反应类型为_______。
(4)G可能具有的性质为_______ (填字母)。
a.与钠反应 b.与NaOH溶液反应 c.易溶于水
(5)请写出②和⑦的化学方程式:
反应②:_______。
反应⑦:_______。物质
浓度
相关试卷
这是一份四川省南充高级中学2024-2025学年高二上学期开学考试化学试题(Word版附解析),文件包含四川省南充高级中学2024-2025学年高二上学期开学考试化学试题Word版含解析docx、四川省南充高级中学2024-2025学年高二上学期开学考试化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
这是一份江西省宜春市2024-2025学年高二上学期开学考试化学试题(Word版附答案),共9页。试卷主要包含了下列有关化学用语使用正确的是,常温下,取铝土矿,下列说法正确的是,5mlN2和1,下列有关实验原理或操作正确的是等内容,欢迎下载使用。
这是一份浙江省杭州市周边重点中学2024-2025学年高二上学期开学考试化学试题(Word版附解析),文件包含浙江省杭州市周边重点中学2024-2025学年高二上学期开学考试化学试题Word版含解析docx、浙江省杭州市周边重点中学2024-2025学年高二上学期开学考试化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。








