

四川省成都外国语学校2024-2025学年高二上学期10月月考化学试题(Word版附答案)
展开注意事项:
1、本试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分。
2、本堂考试 75 分钟,满分 100 分。
3、答题前,考生务必先将自己的姓名、学号填写在答卷上,并使用 2B 铅笔填涂。
4、考试结束后,将答题卡交回。
可能用到的相对原子质量: H-1 C-12 N- 14
第Ⅰ卷(选择题,共 42分)
选择题(每小题 3 分,共 42分。每小题只有一个选项符合题意)
1.下列推论正确的是( )
A.S(g)+O2(g)=SO2(g) △H1,S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2
B.石墨燃烧热为393.5kJ·ml-1,则有C(s)+O2(g)=CO(g) △H=-393.5kJ·ml-1
C.中和热为57.3kJ/ml,则有Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) △H<-114.6kJ/ml
D.CaCO3(s)=CaO(s)+CO2(g) △H>0,则:该反应任何温度下都能自发进行
2.在密闭容器中进行反应2SO2(g)+O2(g) 2SO3(g),下列是在不同条件下测得的反应速率,其中反应速率最慢的是( )
A.B.
C. D.
3.下列有关碰撞理论的说法正确的是( )
A.增大压强(体积减小)或升高温度,均能增大活化分子百分数,从而加快化学反应速率
B.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成
C.人们把能够发生有效碰撞的分子叫做活化分子,把活化分子具有的能量叫活化能
D.增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多
4.下列事实不能用平衡移动原理解释的是( )
A.石灰岩经过千百万年的积聚形成钟乳石、石笋
B.实验室用饱和食盐水除去氯气中混有的少量氯化氢
C.工业生产硫酸的过程中使用过量空气以提高的转化率
D.反应CO(g)+NO2(g)CO2(g)+NO(g)达平衡后,加压使混合气体颜色变深
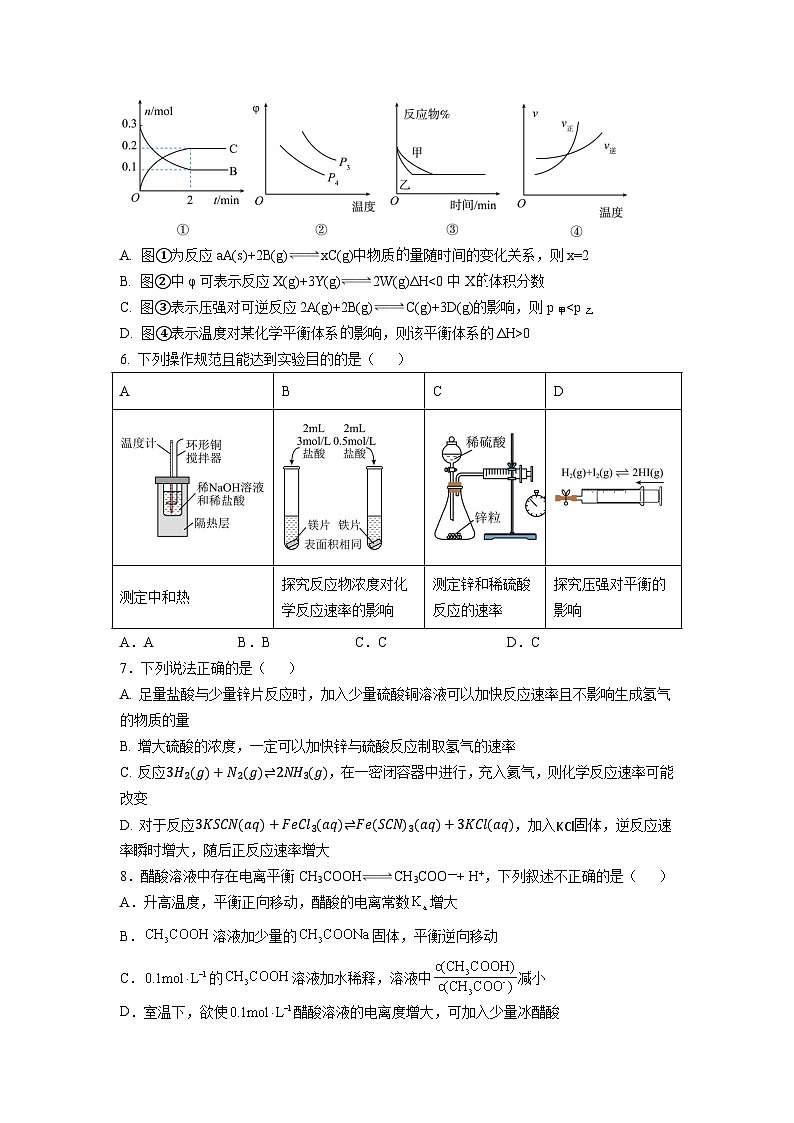
5.下列关于化学反应速率或化学平衡图象的说法不正确的是( )
A. 图①为反应aA(s)+2B(g)xC(g)中物质量随时间的变化关系,则x=2
B. 图②中φ可表示反应X(g)+3Y(g)2W(g)ΔH<0中X体积分数
C. 图③表示压强对可逆反应2A(g)+2B(g)C(g)+3D(g)的影响,则p甲
6. 下列操作规范且能达到实验目的的是( )
A.A B.B C.C D.C
7.下列说法正确的是( )
A. 足量盐酸与少量锌片反应时,加入少量硫酸铜溶液可以加快反应速率且不影响生成氢气的物质的量
B. 增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
C. 反应3H2(g)+N2(g)⇌2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率可能改变
D. 对于反应3KSCN(aq)+FeCl3(aq)⇌Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
8.醋酸溶液中存在电离平衡CH3COOHCH3COO—+ H+,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数增大
B.溶液加少量的固体,平衡逆向移动
C.的溶液加水稀释,溶液中减小
D.室温下,欲使醋酸溶液的电离度增大,可加入少量冰醋酸
9.在恒压、H2和CO2的起始浓度一定的条件下,用不同Mg含量的催化剂Ni/xMg(x值越大表示Mg含量越大)催化反应相同时间,测得不同温度下反应:4H2(g)+CO2(g)CH4(g)+2H2O(g)的CO2转化率如图所示。下列说法正确的是( )
A.反应4H2(g)+CO2(g)CH4(g)+2H2O(g)的ΔH>0
B.延长W点的反应时间也无法提高CO2的转化率
C.相同条件下催化剂中Mg的含量越高催化效率越高
D.当反应温度低于350 ℃,该反应的平衡常数随温度升高而增大。
10.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
下列说法正确的是( )
上述生成Ni(CO)4(g)的反应为吸热反应
B. 25℃时反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为0.5
C. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5ml/L,则此时v(正)>v(逆)
D. 80℃达到平衡时,测得n(CO)=0.3ml,则Ni(CO)4的平衡浓度为2ml/L
11.用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如图所示,已知下列过程中钯(Pd)以正二价形式存在。下列有关说法正确的是( )
A.H2O2的电子式为
B.反应①②③均为氧化还原反应
C.反应②中有1mlO2参与反应时转移电子的物质的量为2ml
D.反应过程中[PbCl2O2]2−、HCl均为该反应的催化剂
12.一定条件下在密闭烧瓶内发生反应:2NO2(g)N2O4(g) △H<0。下列说法正确的是( )
A.测定NO2的相对分子质量时,选择高温、高压条件时误差较小
B.将烧瓶放入热水中,正逆反应速率均加快,烧瓶内气体颜色加深
C.恒温,恒容,若平衡后再向烧瓶内充入NO2,平衡向右移动,烧瓶内气体颜色比原来浅
D.恒温,恒容,若向烧瓶内充入N2,烧瓶内压强增大,反应速率加快
13.Burns和Daintn研究发现Cl2与CO合成COCl2的反应机理如下:
① Cl2(g)2Cl•(g) 快
② CO(g)+Cl•(g) COCl•(g) 快
③ COCl•(g)+Cl2(g)COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是( )
A.反应①的活化能小于反应③的活化能
B.反应②的平衡常数K=
C.要提高合成COCl2的速率,关键是提高反应③的速率
D.选择合适的催化剂并不能提高单位时间内COCl2的产率
14.二氧化碳加氢制甲醇涉及的反应可表示为:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=−49kJ⋅ml−1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41kJ⋅ml−1
一体积固定的密闭容器中,在5MPa下,按照n(CO2):n(H2)=1:3投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如题图所示.下列说法正确的是( )
A. H2的平衡转化率始终不高于CO2
B. n曲线代表的物质为CH3OH,温度越高,越有利于CH3OH的生成
C. 270~400℃时,平衡移动的程度:反应Ⅰ>反应Ⅱ
D. 加入选择性高的催化剂,可提高CH3OH的平衡转化率
第Ⅱ卷(非选择题,共 58分)
二、填空题
15.(14分)生产生活中的化学反应都伴随能量的变化,请根据有关知识回答下列问题:
(1)制作有降温、保鲜和镇痛的冷敷袋可以利用 ______(填“放热”或“吸热”)的化学变化或物理变化.
(2)“即热饭盒”可利用下面 ______(填字母序号)反应释放的热量加热食物.
A.生石灰和水 B.浓硫酸和水 C.钠和水
(3)丙烷(C3H8)常用作运动会火炬燃料。一定量丙烷气体完全燃烧生成CO2g和1mlH2Ol过程中放出了553.75kJ能量。请写出丙烷燃烧的热化学方程式:_____,
(4)在发射“神舟”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) ΔH=-641.6 kJ·ml-1;H2O(l)==H2O(g) ΔH=+44.0 kJ·ml-1,若用6.4 g液态肼与足量过氧化氢反应生成氮气和液态水,则整个过程中放出的热量为 。
(5)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C2H8N2)作推进剂。N2O4与偏二甲肼燃烧产物只有CO2(g)、H2O(g)、N2(g),并放出大量热,已知10.0 g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为 。
(6)火箭和导弹表面的薄层是耐高温物质.制得该物质的热化学方程式为4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s)ΔH=−1176kJ/ml.该反应中每转移1ml电子放出的热量为 ______kJ.
(7)键能是指气态分子中1ml化学键解离成气态原子所吸收的能量,相关化学键键能如下。
已知:;则a = 。
16.(16分) 下表是不同条件下合成氨反应达平衡时反应混合物中氨的体积分数(%)。
(1)目前,我国合成氨工业生产中采用的压强一般不高于30MPa,主要原因是 。
(2)250℃时,在体积为2.0L的恒容密闭容器中加入6mlH2、2mlCO2和催化剂,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),10min时反应达到平衡,测得c(CH3OH)=0.75ml/L。
①下列描述中能说明上述反应已达平衡的是 (填编号)。
A.3ν正(H2)=ν逆(CH3OH)
B.容器中气体压强不随时间而变化
C.c(H2) ∶c(CO2)的值不变
D.容器中气体平均相对分子质量不随时间而变化
②250℃时,该反应的化学平衡常数K= 。
③若其他条件不变,将上述反应改在初始体积为2.0L的恒压容器中进行,则平衡时相较于恒容容器,CO2的转化率 (填“更高”,“更低”或“不变”,下同),平衡常数K 。
(3)合成总反应在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为,在恒温℃下的、在恒压下的如图所示。
①图中对应等压过程的曲线是 ,判断的理由是 ;
②当时,的平衡转化率 (保留三位有效数字)
(14分)环成二烯(C5H6)是一种重要的有机化工原料。
Ⅰ.环戊二烯容易反应生成双环戊二烯(C10H12):2C5H6(g)C10H12(g)。不同温度下,溶液中环戊二烯(C5H6)浓度(初始浓度为1.5ml·L-1 )与反应时间的关系如图所示。
反应开始至b点时,用双环戊二烯(C10H12)表示的平均速率为 。
(2) (填“大于”、“小于”或“等于”)
(3)a点的正反应速率 b点的逆反应速率(填“大于”、“小于”或“等于”)
Ⅱ.可用环戊烯(C5H8)制备环戊二烯(C5H6)。有如下反应:
反应i:C5H8(g)C5H6(g)+ H2(g) ∆H1=+100.3kJ·ml-1
反应ii:2HI(g) H2 (g) + I2(g) ∆H2=+11.0 kJ·ml-1
反应iii:C5H8(g) + I2(g) C5H6(g) + 2HI(g) ∆H3
(4)反应iii的焓变∆H3= kJ·ml-1
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应iii,起始总压为P0,平衡时总压为1.2 P0。
①平衡时环戊烯(C5H8)的体积分数为 %。
②用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算压强平衡常数Kp = 。
③达到平衡后,欲增加环戊烯(C5H8)的平衡转化率,可采取的措施有 。
A.加入催化剂 B. 适当升高温度 C.增大环戊烯C5H8的浓度 D.适当降低压强
18.(14分)(1)现有物质①硫酸铜溶液 ②碳酸钙固体 ③冰醋酸 ④浓硫酸 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧熔融苛性钾 ⑨氨水 ⑩HCl ,按下列要求填空。
属于强电解质的是 (填序号,下同);能导电的是 。
(2)在一定温度下,向CH3COONa溶液中逐渐通入少量HCl气体,下列图形最接近实验过程中电流(I)随所加HCl的量变化的是 。
(3)常温下,部分酸的电离常数如表所示:
①c(H+)相同的三种酸,其酸的浓度由大到小的顺序为_______________________。
②中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为a L、b L,则a________b(填“大于”“小于”或“等于”,下同)。中和等物质的量浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1________n2。
③向NaCN溶液中通入少量的CO2,发生反应的离子方程式为__________________。A
B
C
D
测定中和热
探究反应物浓度对化学反应速率的影响
测定锌和稀硫酸反应的速率
探究压强对平衡的影响
温度℃
25
80
230
平衡常数
5×104
2
1.9×10−5
化学键
CO(CO)
O=O
C=O
键能(KJ/ml)
a
500
1075
0.1MPa
10MPa
20MPa
30MPa
60MPa
500℃
0.10
10.6
19.1
26.4
42.2
600℃
0.05
4.50
9.10
13.8
23.1
化学式
HF
HCN
H2CO3
电离
常数
Ka=3.5×10-4
Ka=5.0×10-10
Ka1=4.4×10-7
Ka2=4.7×10-11
高二上期一月月考化学参考答案
一、选择题(14*3=42分)
二、填空题(共58分,每空2分)
15.(1)吸热 (2)A (3)C3H8(g)+5O2(g) = 3CO2(g)+4H2O(l) △H= -2215kJ/ml
(4)163.52kJ (5)C2H8N2(l)+2N2O4(l) = 2CO2(g)+3N2(g)+4H2O(g) △H= -2550kJ/ml
(6)98 (7)1617
(1)压强过大,对设备的要求更高,压缩过程中的能耗也更大,使得综合成本过高。
(2)①BD ② ③更高 不变 (3)①b ; 等温条件下, 增大压强,平衡正向移动,x(CH3OH) 会变大,故a为等温线,所以b为等压过程的曲线。 ②33.3%
17. (1)0.45ml·L-1·h-1 (2)小于 (3)大于 (4)+89.3
(5)①25 ② ③BD
18.(1)②⑧⑩ ; ①⑥⑦⑧⑨
(2)C
(3)①c(HCN)>c(H2CO3)>c(HF) ②小于 小于
③CO2+CN-+H2O=HCN+HCO3-1
2
3
4
5
6
7
C
A
B
D
B
C
C
8
9
10
11
12
13
14
D
B
D
C
B
D
A
四川省成都外国语学校2024-2025学年高三上学期10月月考化学试题(PDF版附答案): 这是一份四川省成都外国语学校2024-2025学年高三上学期10月月考化学试题(PDF版附答案),共9页。
吉林省长春外国语学校2024-2025学年高二上学期9月月考化学试题(Word版附解析): 这是一份吉林省长春外国语学校2024-2025学年高二上学期9月月考化学试题(Word版附解析),文件包含吉林省长春市长春外国语学校2024-2025学年高二上学期9月月考化学试题Word版含解析docx、吉林省长春市长春外国语学校2024-2025学年高二上学期9月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
四川省成都外国语学校2023-2024学年高一下学期7月月考化学试题(Word版附答案): 这是一份四川省成都外国语学校2023-2024学年高一下学期7月月考化学试题(Word版附答案),共13页。试卷主要包含了本试卷分Ⅰ卷两部分,本堂考试75分钟,满分100分,考试结束后,将答题卡交回等内容,欢迎下载使用。












