

四川省绵阳市2023_2024学年高二化学上学期10月月考试题含解析
展开满分100分,考试时间75分钟
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卡共2页。
注意事项:
1.答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。
2.选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3.考试结束后将答题卡收回。
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Cu 64 Fe 56 Ag 108 Al 27 Pb 207
第Ⅰ卷 (选择题,共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1. 港珠澳大桥设计使用寿命为120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是
A. 防腐原理主要是避免发生反应:2Fe+O2+2H2O=2Fe(OH)2
B. 采用外加电流的阴极保护法时需外接镁、锌等作辅助阳极
C. 钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
D. 钢构件可采用不锈钢材料以减缓电化学腐蚀
【答案】B
【解析】
【详解】A.钢在潮湿的空气中容易发生吸氧腐蚀,发生的主要反应有2Fe+O2+2H2O=2Fe(OH)2、等,故A说法正确;
B.外接镁、锌等作辅助阳极属于牺牲阳极的阴极保护法,采用外加电流的阴极保护时需外接电源,故B说法错误;
C.钢构件表面喷涂环氧树脂涂层,可以隔绝空气、水等防止形成原电池,防止铁发生电化学腐蚀,故C说法正确;
D.不锈钢具有较强的抗腐蚀性,采用不锈钢材料做钢构件可以防止或减缓电化学腐蚀,故D说法正确;
答案选B。
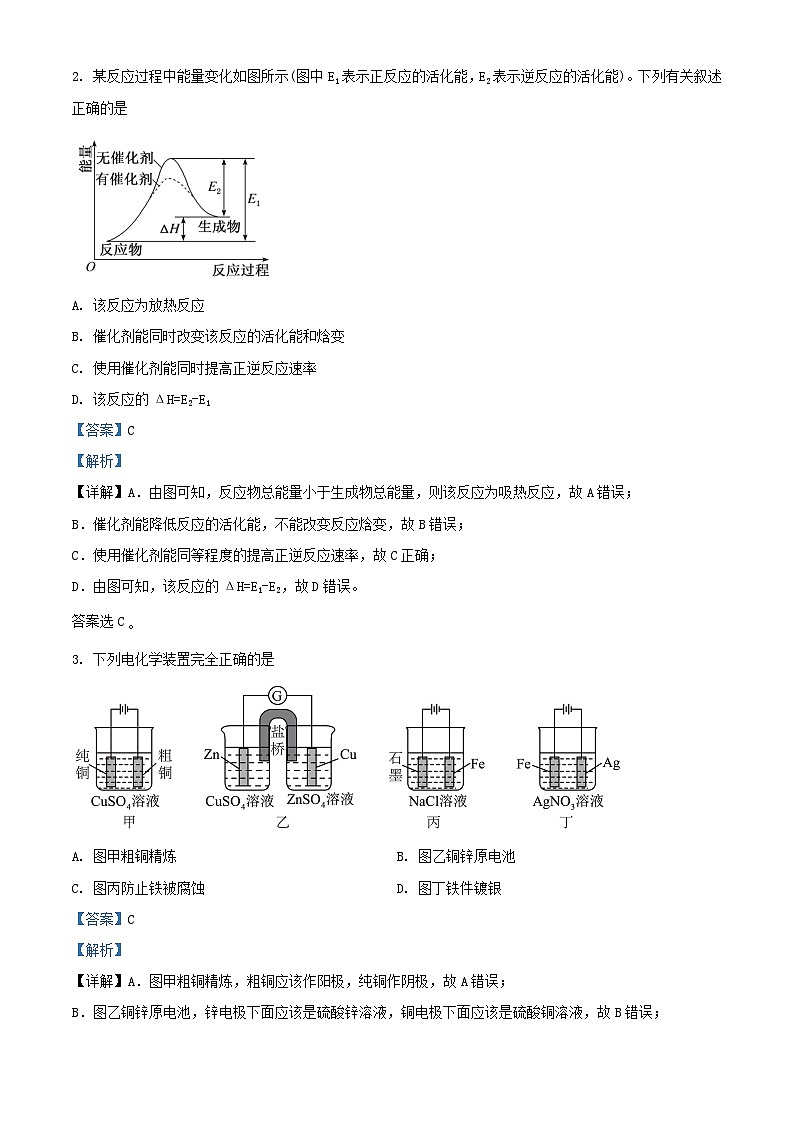
2. 某反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
A. 该反应为放热反应
B. 催化剂能同时改变该反应的活化能和焓变
C. 使用催化剂能同时提高正逆反应速率
D. 该反应的ΔH=E2-E1
【答案】C
【解析】
【详解】A.由图可知,反应物总能量小于生成物总能量,则该反应为吸热反应,故A错误;
B.催化剂能降低反应的活化能,不能改变反应焓变,故B错误;
C.使用催化剂能同等程度的提高正逆反应速率,故C正确;
D.由图可知,该反应的ΔH=E1-E2,故D错误。
答案选C
3. 下列电化学装置完全正确的是
A. 图甲粗铜精炼B. 图乙铜锌原电池
C. 图丙防止铁被腐蚀D. 图丁铁件镀银
【答案】C
【解析】
【详解】A.图甲粗铜精炼,粗铜应该作阳极,纯铜作阴极,故A错误;
B.图乙铜锌原电池,锌电极下面应该是硫酸锌溶液,铜电极下面应该是硫酸铜溶液,故B错误;
C.图丙防止铁被腐蚀,该方法是外加电流的阴极保护法,要保护的金属作电解池的阴极,故C正确;
D.图丁铁件镀银,镀件(Fe)作阴极,镀层金属(Ag)做阳极,故D错误。
综上所述,答案为C。
4. 青铜器在潮湿环境中发生电化学腐蚀的原理如图所示,下列说法错误的是
A. 该腐蚀过程属于吸氧腐蚀
B. 腐蚀过程可用原电池原理解释
C. 若为潮湿酸性环境,Cu可能同时发生析氢腐蚀
D. 正极电极电极反应为
【答案】C
【解析】
【分析】由图可知,青铜器在潮湿环境中发生的电化学腐蚀为吸氧腐蚀,铜是原电池的负极,失去电子发生氧化反应生成多孔粉状锈,比铜活泼性弱的杂质做正极,水分子作用下氧气做正极得到电子发生还原反应生成氢氧根离子。
【详解】A.由分析可知,青铜器在潮湿环境中发生的电化学腐蚀为吸氧腐蚀,故A正确;
B.青铜器在潮湿环境中发生的电化学腐蚀为吸氧腐蚀,铜是原电池的负极,比铜活泼性弱的杂质做正极,则腐蚀过程可用原电池原理解释,故B正确;
C.铜是不活泼金属,不能与酸反应生成氢气,所以在潮湿酸性环境中,铜也不能发生析氢腐蚀,故C错误;
D.由分析可知,比铜活泼性弱的杂质做正极,水分子作用下氧气做正极得到电子发生还原反应生成氢氧根离子,电极反应式为,故D正确;
故选C。
5. 下列关于热化学反应的描述正确的是
A. 已知H+(aq)+OH—(aq)=H2O(l)ΔH=—57.3 kJ·ml-1,用含20.0 g NaOH的稀溶液与稀盐酸反应测出的中和反应的反应热ΔH=—28.65 kJ·ml-1
B. CO(g)的燃烧热ΔH=—283.0 kJ·ml-1,则反应2CO2(g)=2CO(g)+O2(g)的ΔH=+566.0 kJ·ml-1
C. 已知2H2(g)+O2(g)=2H2O(l) ΔH=—571.6 kJ·ml-1,则氢气的燃烧热为571.6 kJ·ml-1
D. 已知N2(g)+3H2(g) 2NH3(g) ΔH=—92 kJ·ml-1,现将2mlN2和6mlH2充入密闭容器中充分反应后,放出的热量为184 kJ
【答案】B
【解析】
【详解】A.中和热为稀的强酸和强碱生成1ml水放出的热量,则用含20.0 g NaOH的稀溶液与稀盐酸反应测出的中和反应的反应热ΔH=—57.3 kJ·ml-1,故A错误;
B.一氧化碳的燃烧热为1ml一氧化碳完全燃烧生成二氧化碳放出的热量,则反应2CO2(g)=2CO(g)+O2(g)的ΔH=+566.0 kJ·ml-1,故B正确;
C.氢气的燃烧热为1ml氢气完全燃烧生成液态水放出的热量,则由热化学方程式可知,氢气的燃烧热为285.8kJ·ml-1,故C错误;
D.合成氨反应为可逆反应,可逆反应不可能完全反应,所以将2ml氮气和6ml氢气充入密闭容器中充分反应后,放出的热量小于184 kJ,故D错误;
故选B。
6. 如图所示的电解池I和II中,a、b、c、d均为石墨电极。在电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重情况为b
【答案】B
【解析】
【分析】电极b、d均为阴极,在它们上面均没有气体逸出,但质量均增大,且增重b
B.两池中的电极上转移的电子是相等的,设转移2ml电子,b增重64g,d增重216g,所以质量增加b<d,故B正确;
C.在金属活动性顺序表中,Fe、Al都在H之前,电解亚铁盐、铝溶液溶液时阴极上都不能得到金属单质,故C错误;
D.由阳离子得电子能力顺序表可以看出,盐溶液中Ag+和Pb2+的得电子能力均大于H+,因此电解硝酸银溶液时阴极b电极上生成Ag、电解硝酸铅溶液阴极d上生成Pb,两池中的电极上转移的电子是相等的,设转移2ml电子,b增重216g,d增重207g,所以质量增加b>d,故D错误;
答案选B。
7. 下列离子方程式或电极反应式书写错误的是
A. 用铁作电极电解饱和NaCl溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑
B. 碱性锌锰电池正极的电极反应:MnO2+H2O+e-= MnO(OH)+OH-
C. 用K3[Fe(CN)6]检验Fe2+的离子方程式:K++[Fe(CN)6]3-+Fe2+=KFe[Fe(CN)6]↓
D. 铅蓄电池充电时阴极的电极反应:PbSO4(s)+2e-=Pb(s)+SO(aq)
【答案】A
【解析】
【详解】A.用铁电极电解饱和食盐水,阳极上铁失电子,结合氢氧根离子生成氢氧化亚铁,阴极上水得电子生成氢气和氢氧根离子,总反应为Fe+2H2OFe(OH)2+H2,A错误;
B.碱性锌锰电池正极上MnO2得电子结合水生成MnO(OH)和氢氧根离子,电极反应方程式正确,B正确;
C.用K3[Fe(CN)6]检验Fe2+,两者反应生成KFe[Fe(CN)6]沉淀,离子方程式正确,C正确;
D.铅蓄电池充电时,阴极上PbSO4得电子生成Pb和硫酸根离子,电极反应式正确,D正确;
故答案选A。
8. 如下图所示,ΔH1=-393.5 kJ·ml-1,ΔH2=-395.4 kJ·ml-1,下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. 金刚石的稳定性强于石墨
C. C(s,石墨)=C(s,金刚石) ΔH=-1.9 kJ·ml-1
D. 1 ml 石墨的总键能比1 ml 金刚石的总键能大1.9 kJ
【答案】D
【解析】
【分析】由题给信息可得出:
①C(s,石墨)+O2(g)=CO2(g) ΔH2=-393.5 kJ·ml-1;
②C(s,金刚石)+O2(g)=CO2(g) ΔH2=-395.4 kJ·ml-1。
【详解】A.石墨和金刚石互为同素异形体,二者的结构不同,二者的转化是化学变化,A不正确;
B.从图中可以看出,金刚石具有的能量比石墨高,则金刚石的稳定性弱于石墨,B不正确;
C.依据盖斯定律,将反应①-②得,C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·ml-1,C不正确;
D.C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·ml-1,ΔH=E(石墨)-E(金刚石)=+1.9 kJ·ml-1,则1 ml 石墨的总键能比1 ml 金刚石的总键能大1.9 kJ,D正确;
故选D。
9. NA为阿伏加德罗常数的值,下列说法正确的是
A. 氯碱工业,当阴极产生2.24L(标况)氯气,则外电路转移0.2 ml电子
B. 铅酸蓄电池工作过程中,每通过2 ml电子,负极质量减轻207 g
C. 在电解精炼粗铜的过程中,当阴极质量增重32 g时转移的电子数为NA
D. 氢氧燃料电池正极消耗22.4 L气体时,负极消耗气体的分子数为2NA
【答案】C
【解析】
【详解】A.氯碱工业,氯气是阳极产物,不是阴极产物,故A错误;
B.铅酸蓄电池工作过程中,负极的电极方程式为,每通过2 ml电子,电极质量增加96g,故B错误;
C.在电解精炼粗铜的过程中,阴极的电极方程式为Cu2++2e-=Cu,当质量增重32 g时,即生成0.1ml铜,转移的电子数为NA,故C正确;
D.未指明状况,无法确定22.4L气体的物质的量,故D错误;
故选C。
10. 下列实验中,对应的实验以及结论都正确且二者具有因果关系的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.氨水是混合物,不是电解质,氨水中一水合氨是电解质,故A错误;
B.2支试管中溶液种类和浓度都保持一致,其中一支试管加入少量MnO2,对比实验现象可证明催化剂能加快反应速率,故B正确;
C.应先加入淀粉溶液,最后加入硫酸,否则可能会先发生反应,观察不到蓝色变化,故C错误;
D.该反应无明显现象,无法清晰分辨反应速率快慢,故D错误;
答案选B。
11. 某温度下,在容积为2 L的密闭容器中投入一定量的A、B发生反应3A(g)+bB(g)cC(g) ΔH=-Q kJ·ml-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 ml,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
A. 前12 s内,A的平均反应速率为0.025 ml·L-1·s-1
B. 12 s后,A的消耗速率等于B的生成速率
C. 化学计量数之比b∶c=2∶1
D. 12 s内,A和B反应放出的热量为0.4Q kJ
【答案】D
【解析】
【详解】A.图象分析可知A的浓度变化=0.8ml/L-0.2ml/L=0.6ml/L,反应速率v==0.05ml/(L•s),故A错误;
B.由图像可知,12s内B的浓度该变量为0.2ml/L,C的浓度变化量为0.8 ml=0.4ml/L,根据计量数之比等于改变量之比,有3:b:c=0.6:0.2:0.4=3:1:2,A和B的计量数不相等,故A的消耗速率不等于B的生成速率,故B错误;
C.由B项的计算可知,b∶c=1∶2,故C错误;
D.12s内反应3mlA放热QkJ,反应A的物质的量=(0.8ml/L-0.2ml/L)×2L=1.2ml,结合化学方程式定量关系计算,3A(g)+B (g)⇌2C(g) △H=-Q kJ•ml-1,1.2mlA反应放出热量0.4QkJ,故D正确。
12. 中科院福建物构所YabingWang团队首次构建了一种可逆水性Zn—CO2电池,实现了CO2和HCOOH之间的高效可逆转换,其反应原理如图所示:
已知双极膜可将水解离为和,并实现其定向通过。下列说法中错误的是
A. 放电时,负极电极反应式为
B. CO2转化为HCOOH过程中,Zn电极的电势低于多孔Pd电极的
C. 充电过程中,甲酸在多孔Pd电极表面转化为CO2
D. 当外电路通过2ml电子时,双极膜中离解水的物质的量为1ml
【答案】D
【解析】
【分析】由图中可知,Zn发生失去电子的反应,为电池的负极;CO2得电子生成HCOOH,多孔Pd为电池的正极。
【详解】A.根据图中知,Zn发生失去电子的反应,电极反应式为,A项正确;
B.CO2转化为HCOOH时为放电过程,Zn电极为负极,多孔Pd电极为正极,负极电势较低,B项正确;
C.充电过程中,HCOOH转化为CO2,C项正确;
D.根据溶液呈电中性,可知外电路通过2ml电子时,双极膜中离解的水的物质的量为2ml,D项错误。
故选D。
13. 一定条件下,0.3 ml X(g)与0.3 ml Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)2Z(g) ΔH=-a kJ·ml-1(a>0),下列说法正确的是
A. 反应一段时间后,X与Y的物质的量之比仍为1∶1
B. 达到平衡时,反应放出0.1a kJ的热量
C. 向平衡体系中充入稀有气体,Z的正逆反应速率均不变
D. 该反应为放热反应,升高温度正反应速率增大,逆反应速率减小。
【答案】C
【解析】
【详解】A.根据方程式可知消耗的X和Y的物质的量之比为1:3,初始投料为1:1,所以反应一段时间后X与Y的物质的量之比不可能为1:1,故A错误;
B.根据热化学方程式可知,若0.3mlY完全转化放出0. la kJ的热量,但可逆反应不可能完全转化,所以放出的热量小于0. la kJ,故B错误;
C.恒容容器中充入稀有气体,各物质的浓度均不改变,Z的正逆反应速率均不变,故C正确;
D.升高温度正、逆反应速率均增大,故D错误;
故选:C。
14. 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO)=0.8 ml·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极分别收集到气体2.24 L和1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解后溶液中c(H+)为0.6 ml·L-1
B. 电解得到的Cu的物质的量为0.4 ml
C. 原混合溶液中c(K+)为0.1 ml·L-1
D. 若将溶液复原可向电解后溶液中加入0.075 ml Cu2(OH)2CO3固体
【答案】A
【解析】
【分析】用石墨作为电极电解KNO3和Cu(NO3)2的混合溶液,阳极反应为2H2O-4e-=O2↑+4H+,阴极先后发生两个反应:Cu2++2e-=Cu,2H2O+2e-=2OH-+H2↑。收集到标准状况下2.24 L 气体应该是O2,在阳极上生成,可推知上述电解过程中共转移0.4 ml 电子,而在生成标准状况下1.12 L H2的过程中转移0.1 ml电子,所以Cu2+共得到0.3 ml电子,则电解前Cu2+的物质的量和电解得到的Cu的物质的量都为 0.15 ml,硝酸铜物质的量是0.15ml,浓度为0.3ml/L,硝酸钾浓度为0.8-2×0.3=0.2ml/L。
【详解】A.电解后有c(K+)+c(H+)=c(N)电荷守恒,c(K+)=0.2ml/L, c(N)=0.8ml/L由此计算出c(H+)=0.6 ml·L-1,故A正确;
B.电解得到的Cu的物质的量为0.15 ml,故B错误;
C.原混合溶液中c(K+)为0.2 ml·L-1,故C错误;
D.电解后产生了0.15mlCu,0.1mlO2和0.05mlH2,向电解后的溶液中加入0.075 ml Cu2(OH)2CO3固体会多出H原子和O原子,不能使溶液复原,故D错误;
答案选A。
第Ⅱ卷 (非选择题,共58分)
二、(本题包括2小题,共23分)
15. 完成下列问题
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) CO(g)+H2(g),下列条件的改变对反应速率几乎没有影响的是___________。
①增加 C 的量;②增加 CO 的量;③将容器的体积缩小一半;④保持体积不变,充入He以增大压强;⑤升高反应体系的温度;⑥保持压强不变,充入He以增大体积。
(2)炒菜用的铁锅不用时会因腐蚀而出现红褐色锈斑,请填写下空。
①这时铁锅的锈蚀主要是___________腐蚀。
②铁锅腐蚀的负极电极反应为:___________,总反应为:___________。_
(3)已知15g乙烷(C2H6)完全燃烧生成CO2和液态水时放热780kJ,写出乙烷燃烧热的热化学方程式:___________。
(4)N4分子结构为正四面体形(如图所示)。已知:N4(g)=2N2(g) ΔH=-724 kJ·ml-1断裂N4(g)中1 ml N-N键吸收193kJ能量,则形成N2(g)中1 ml N≡N 放出___________能量。
(5)新型Na-CO2电池工作原理为:4Na+3CO22Na2CO3+C,原电池以熔融的Na2CO3为电解质,放电时正极的电极反应为___________。
【答案】(1)①④(2) ①. 吸氧 ②. ③.
(3) ΔH=-1560kJ·ml-1
(4)941 kJ(5)
【解析】
【小问1详解】
①C为纯固体,固体量的增减不影响反应速率,所以增加C(s)的量,反应速率不变,①正确;②增加CO的量,CO浓度增大,反应速率加快,②错误;③将容器的体积缩小一半,反应体系中物质的浓度增大,容器中压强增大,反应速率加快,③错误;④保持体积不变,充入氦气,氦气不参与反应,反应体系中的各物质的浓度不变,则反应速率不变,④正确;⑤升高反应体系的温度,反应速率加快,⑤错误;⑥保持压强不变,充入氦气,使容器的体积变大,反应体系中各物质的浓度减小,则反应速率减小,⑥错误;符合题意得为①④,答案为:①④;
【小问2详解】
①炒菜的铸铁锅不用时,会因空气中水分与自身的铁和杂质碳构成原电池而发生电化学腐蚀,产物吸收空气中的氧气,经一系列反应最终出现主要为带有结晶水的氧化铁的红褐色锈斑,答案为:吸氧;
②铁锅锈蚀的电极反应为:负极;正极;正、负极反应的产物会继续发生反应,反应的离子方程式为:,答案为:,;
【小问3详解】
已知乙烷是一种优质的能源物质,25℃,101kPa时,15g乙烷完全燃烧,生成二氧化碳和液态水,放出780 kJ热量,则1ml乙烷完全燃烧生成CO2和液体水放出的热量为,则乙烷燃烧热的热化学方程式为:△H=﹣1560 kJ/ml,故答案为:△H=﹣1560 kJ/ml;
【小问4详解】
已知:N4(g)=2N2(g) ΔH=-724 kJ·ml-1断裂N4(g)中1 ml N-N键吸收193kJ能量,所以当1 ml N4(g)参与反应化学键断裂吸收的能量为,最终放出724 kJ的能量,所以生成2 ml N2放出热量为,所以形成N2(g)中1 ml N≡N 放出941 kJ能量,答案为:941 kJ;
【小问5详解】
正极CO2得电子发生还原反应,故电极方程式为,答案为:。
16. 甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/ml
②CO(g)+2H2(g) CH3OH(g) ΔH2=-90.77 kJ/ml
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
(1)反应③的ΔH3=___________
(2)在5MPa下,要提高反应②的反应速率,可采取的措施有___________(答一条)。
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达到平衡的是___________。
A. v正(H2)=v逆(CH3OH)B. 混合气压强不变
C. c(H2)与c(H2O)比值不变D. 混合气密度不变
(4)在一定温度和催化剂存在下,向2L密闭容器中充入5ml CO2和5 ml H2发生反应①5min时达到平衡,测得CO2还剩4ml。
①该时间内用氢气表示的反应速率v(H2)为:___________。
②平衡时H2的平衡转化率为___________。
【答案】(1)+41.19 kJ/ml
(2)升高温度(3)BC
(4) ①. 0.3ml/(L·min) ②. 60%
【解析】
【小问1详解】
根据盖斯定律,反应方程式①-②得反应③,故ΔH3=ΔH1-ΔH2=-49.58 kJ/ml-(-90.77 kJ/ml)= +41.19 kJ/ml;
【小问2详解】
在5MPa下,要提高反应②的速率,可采取的措施有升高温度、增加反应物、增加生成物等;
【小问3详解】
A.不同物质,反应速率需与计量系数成正比,且速率方向不同,才可说明平衡状态,故A不符合题意;
B.由于该反应气体计量系数改变,则压强为变化值,故混合气压强不变可以说明平衡,故B符合题意;
C.反应物与生成物之比为变化值,故c(H2)与c(H2O)比值不变可以说明平衡,故C符合题意;
D.该反应气体质量与体积不变,则气体密度为定值,故混合气密度不变不能说明平衡,故D不符合题意。
故答案为:BC;
小问4详解】
根据数据列出三段式:
5-x=4,x=1,该时间内氢气表示的反应速率v(H2)== 0.3ml/(L·min);平衡时H2的平衡转化率为=60%。
三、(本题包括2小题,共25分)
17. 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。(电解质溶液均足量)。
请回答下列问题:
(1)甲池为___________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为___________。
(2)乙池中A(石墨)电极的名称为___________(填“正极”“负极”“阴极”或“阳极”),总反应离子方程式为:___________。
(3)当乙池中B极质量增加2.16 g时,甲池中理论上消耗O2的体积为___________mL(标准状况下),此时若要将乙池复原需向乙池加一定量的___________(填化学式)。
(4)丙池中电极C的电极反应为:___________,若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,丙中溶液的pH将___________(填“增大”“减小”或“不变”)。
【答案】(1) ①. 原电池 ②.
(2) ①. 阳极 ②.
(3) ①. 112 ②. Ag2O
(4) ①. ②. 增大
【解析】
【分析】由题干图示信息可知,甲池为甲醇燃料电池,通CH3OH的一极为负极,电极反应为:,通O2的一极为正极,电极反应为:;乙池为电解池,石墨电极A为阳极,电极反应为:,Ag电极B为阴极,电极反应为:;丙池为电解池,电极C为阳极,电极反应为:,电极D为阴极,电极反应为:,据此分析解题。
【小问1详解】
由分析可知,甲池为原电池,通入CH3OH 电极的电极反应式为,答案为:原电池,;
【小问2详解】
由分析可知,乙池A(石墨)电极的名称为阳极,电极反应为:,Ag电极B为阴极,电极反应为:,则乙池中总反应式为:,答案为:阳极,;
【小问3详解】
由分析可知,当乙池中B极质量增加2.16g ,即析出2.16g的Ag时,n(Ag)=,则电路中转移的电子的物质的量为0.02ml,根据电极反应,故甲池中理论上消耗 O2的体积为,乙池中总反应式为:,所以若想复原需要加入Ag2O,答案为:112,Ag2O;
【小问4详解】
由分析可知丙池中电极C的电极反应为:,若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,即用惰性电极电解NaCl溶液,丙中D极即阴极,电极反应为:,则阴极的产物为NaOH、H2,由于生成了NaOH,则溶液的 pH 将增大,答案为:,增大。
18. 某学生通过测定反应过程中所放出的热量来计算中和反应反应热。他将50 mL 0.50 ml·L-1的盐酸与50 mL 0.55 ml·L-1的NaOH溶液加入如图甲所示的装置中,进行中和反应。请回答下列问题:
(1)从实验装置上看,图甲中尚缺少的一种玻璃仪器是___________。
(2)实验中改用55 mL 0.50 ml·L-1的盐酸与50 mL 0.55 ml·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”或“不相等”);所求中和反应反应热的数值___________(填“相等”或“不相等”)。
(3)该同学做实验时有些操作不规范,造成测得的中和反应的ΔH偏大,请你分析可能的原因是___________(填字母)。
A. 测量盐酸温度后,温度计没有用水冲洗干净,然后去测NaOH溶液的温度
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C. 做本实验当天室温较高
D. 将50 mL 0.55 ml·L-1氢氧化钠溶液错取成了50 mL 0.55 ml·L-1的氨水
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和反应反应热ΔH=___________(结果保留一位小数)。
(5)将V1mL 1.0 ml·L-1盐酸和V2mL未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如图乙所示(实验中始终保持V1+V2=50 mL),通过分析图像可知,做该实验时环境温度___________(填“高于”“低于”或“等于”)22 ℃,该NaOH溶液的浓度约为___________ ml·L-1。
【答案】(1)玻璃搅拌器
(2) ①. 不相等 ②. 相等(3)ABD
(4)-56.8 kJ·ml-1
(5) ①. 低于 ②. 1.50
【解析】
【小问1详解】
)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;
【小问2详解】
物质的量与热量成正比,物质的量越大,反应放出的热量越多,但中和热对应生成1ml水时的能量变化,则改用60mL 0.50ml•L-1的盐酸跟50mL 0.55ml•L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量不相等,所求生成1ml水时的中和热相等,因为中和热是指强酸与强碱的稀溶液发生反应生成1mlH2O所放出的热量;
【小问3详解】
A.测量盐酸的温度后,温度计没有用水冲洗干净,然后去测NaOH溶液的温度,NaOH溶液的初始温度偏高,测定反应放热偏小,测得中和热的数值偏低,ΔH偏大,故A符合题意;
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,反应中热量损耗偏大,测定反应放热偏小,测得中和热的数值偏低,ΔH偏大,故B符合题意;
C.做本实验的当天室温较高,与中和热测定数值无关,故C不符合题意;
D.一水合氨是弱电解质,电离吸热,则50mL0.55ml⋅L-1氢氧化钠溶液错取成了50mL0.55ml⋅L-1的氨水,反应放热偏小,测得中和热的数值偏低,ΔH偏大,故D符合题意;
故答案为:ABD;
【小问4详解】
由表格数据可知,第一次实验的温度差=;第二次实验的温度差=;第三次实验的温度差=;第三次数据偏差大,应舍去;温度差平均值=3.4℃,盐酸和氢氧化钠溶液的密度都是1 g•cm-3,则盐酸和氢氧化钠溶液质量和为(50mL+50mL)×1g/ml=100g,则生成0.025ml水时放出的热量为4.18 J•g−1•℃-1×10-3kJ/J×100g×3.4℃=1.4212kJ,生成1ml水放出的热量为1.4212kJ×≈56.8kJ,则该实验测得的中和热△H=-56.8kJ/ml;
【小问5详解】
加入盐酸5mL时温度为22℃,酸碱中和为放热反应,则该实验时环境温度低于22℃;由图可知,当HCl的体积为30mL时酸碱恰好反应,n(NaOH)=n(HCl),即c(NaOH)×0.02L=1.0ml/L×0.03L,解得c(NaOH)=1.50ml/L。
四、(本题包括1小题,共10分)
19. 铝的阳极氧化是一种重要的表面处理技术,其原理是用电化学方法处理铝件表面,优化氧化膜结构,增强铝件的抗腐蚀性,同时便于表面着色。取铝片模拟该实验,操作步骤如下:
(1)铝片预处理
铝片表面除去油垢后,用2 ml/L NaOH溶液在60~70 ℃ 下洗涤,除去铝表面薄氧化膜,离子方程式为:___________;再用10%(质量分数)的HNO3溶液对铝片表面进行化学抛光。若取一定体积68%(质量分数)的浓硝酸配制该化学抛光液,需要用到的玻璃仪有___________、___________、玻璃棒和胶头滴管。
(2)电解氧化
取预处理过的铝片和铅做电极,控制电流恒定为0.06 A,用直流电源在5~6 ml/L硫酸中电解。其中铝片接电源___________极,产生氧化膜(Al2O3)的电极反应式为___________。氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙的离子反应方程式为___________。
【答案】(1) ①. Al2O3 + 2OH-+3H2O= 2[Al(OH)4]- ②. 烧杯 ③. 量筒
(2) ①. 正 ②. 2Al-6e- + 3H2O= Al2O3 + 6H+ ③. Al2O3 + 6H+=Al3++ 3H2O
【解析】
【分析】(1)铝表面薄氧化膜即Al2O3,可以和NaOH溶液反应,用浓硝酸配制稀HNO3溶液,需要的玻璃仪器有量筒、烧杯、玻璃棒和胶头滴管;(2)本电解的目的是将铝片电解氧化生成致密的氧化物保护膜,即Al生成Al2O3,失去电子,则铝片接电源正极;氧化膜在酸性条件下可以被腐蚀生成铝离子,随着电解的进行氧化膜覆盖阳极表面厚度加厚,电阻增大,需要保持较大电压。
【小问1详解】
铝片表面除去油垢后,用2ml/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,即Al2O3与NaOH溶液反应的离子方程式为:Al2O3 + 2OH-+3H2O= 2[Al(OH)4]-;用浓硝酸配制一定量的10%(质量分数)的HNO3溶液,需要的实验步骤为:计算、量取、稀释、装瓶,需要用到的玻璃仪器有量筒、烧杯、玻璃棒和胶头滴管;
【小问2详解】
选项
X
Y
A
MgSO4
CuSO4
B
CuSO4
AgNO3
C
FeSO4
Al2(SO4)3
D
AgNO3
Pb(NO3)2
选项
实验操作及现象
结论
A
向盛有氨水的烧杯中插入两个石墨电极,接通电源,电流表指针发生较大偏转
氨水是电解质
B
取2支都装有5mL 10%的H2O2溶液的试管,向其中一支加入少量MnO2,观察实验现象。
催化剂能加快反应速率
C
分别取装有等体积的0.1 ml·L-1和0.2 ml·L-1 KI溶液的试管放入20 ℃和30 ℃ 的水中,再向其中加入0.1 ml·L-1的硫酸和淀粉溶液,发生反应4H++O2+4I-=2I2+2H2O观察实验现象
反应物温度越高,反应速率越快
D
探究浓度对反应速率的影响,向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察实验现象
反应物浓度越大,反应速率越快
实验序号
起始温度t1/℃
终止温度t2/℃
稀盐酸
氢氧化钠溶液
混合溶液
1
20.0
20.2
23.5
2
20.2
20.4
23.7
3
20.3
20.5
25.6
辽宁省沈阳市2023_2024学年高二化学上学期10月月考试题含解析: 这是一份辽宁省沈阳市2023_2024学年高二化学上学期10月月考试题含解析,共18页。试卷主要包含了单选题,主观题等内容,欢迎下载使用。
四川省绵阳市2023_2024学年高二化学上学期期中试题含解析: 这是一份四川省绵阳市2023_2024学年高二化学上学期期中试题含解析,共23页。试卷主要包含了本试卷分第Ⅰ卷和第Ⅱ卷两部分,01ml·L-1·s-1B,3kJ等内容,欢迎下载使用。
四川省绵阳市2023_2024学年高二化学上学期12月月考试题含解析: 这是一份四川省绵阳市2023_2024学年高二化学上学期12月月考试题含解析,共18页。试卷主要包含了考试结束后将答题卡收回, 下列说法正确的是等内容,欢迎下载使用。












