
辽宁省实验中学2023-2024学年高二上学期期中阶段测试化学试题
展开化学试题
考试时间:75分钟 试题满分: 100分
可能用到的相对原子量: H-1 O-16 Na-23
一、单选题(共15小题,每小题3分,共45分。每题只有一个选项符合题意。)
1.下列关于热化学反应的描述中正确的是
A.表示甲烷的燃烧热:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ/ml
B.已知稀盐酸和稀NaOH 溶液反应的中和热ΔH=-57.3 kJ/ml, 则H2SO4溶液和Ba(OH)2溶液反应生成1ml H2O 时放出57.3 kJ的热量
C.已知: N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ/ml; 则0.5mlN2与1.5mlH2在一定条件下充分反应,放出热量为46.2kJ
D.2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
2.25℃时,水的电离达到平衡:H2OH++OH-,下列叙述正确的是
A.将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量Na2CO3固体,c(OH-)增大,Kw不变,影响水的电离平衡
D.向0.1ml•L-1CH3COOH溶液中加入少量水,溶液中减小
3.一定温度下,在固定容积的密闭容器中发生可逆反应mA(g)+nB(g)pC(g)+qD(s), 当m 、n、p、q为任意正整数时,下列状态一定能说明反应已达到平衡状态的是
① 体系的压强不再发生变化
②体系的密度不再发生变化
③ 各组分的物质的量浓度不再改变
④ 各组分的质量分数不再改变
⑤ 物质的量之比n(A):n(B):n(C)=n(D)=m:n:p:q
A.③④⑤B.②③④C.①②③④D.①②③④⑤
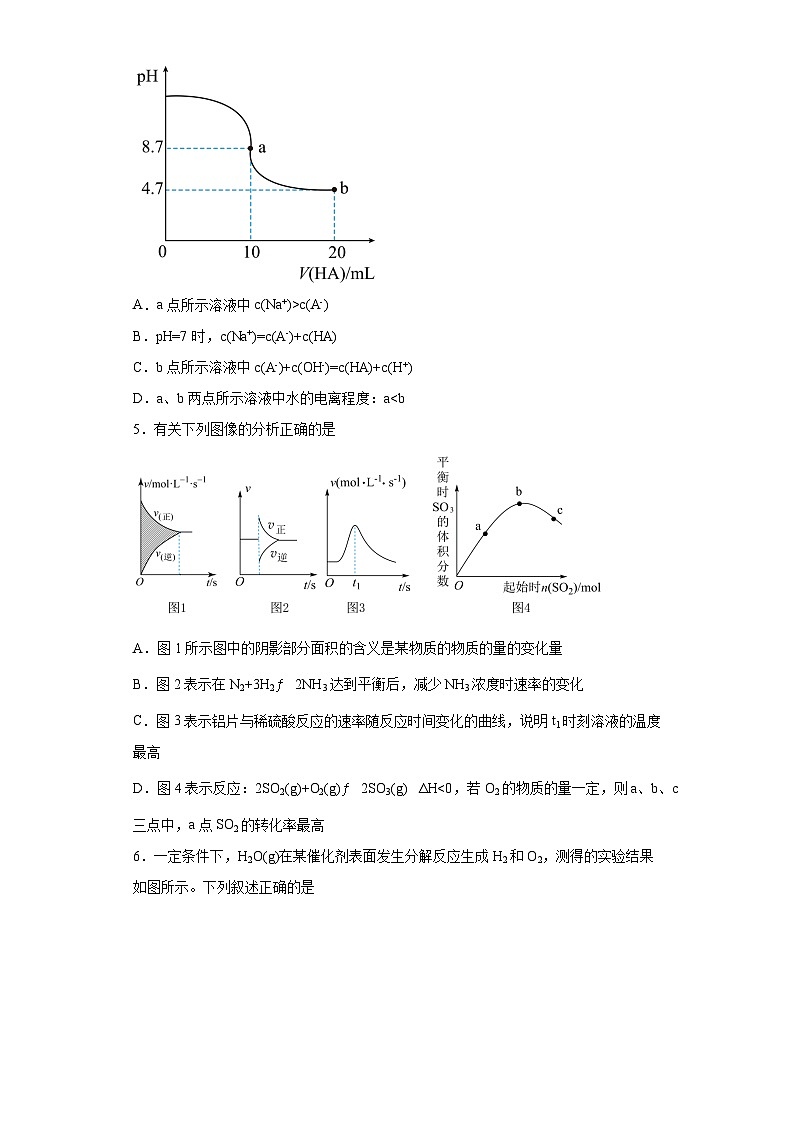
4.室温下,向10mL0.1ml/LNaOH溶液中加入0.1ml/L的一元酸HA 溶液,pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A-)
B.pH=7时,c(Na+)=c(A-)+c(HA)
C.b点所示溶液中c(A-)+c(OH-)=c(HA)+c(H+)
D.a、b两点所示溶液中水的电离程度:a
A.图1所示图中的阴影部分面积的含义是某物质的物质的量的变化量
B.图2表示在N2+3H22NH3达到平衡后,减少NH3浓度时速率的变化
C.图3表示铝片与稀硫酸反应的速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
D.图4表示反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,若O2的物质的量一定,则a、b、c三点中,a点SO2的转化率最高
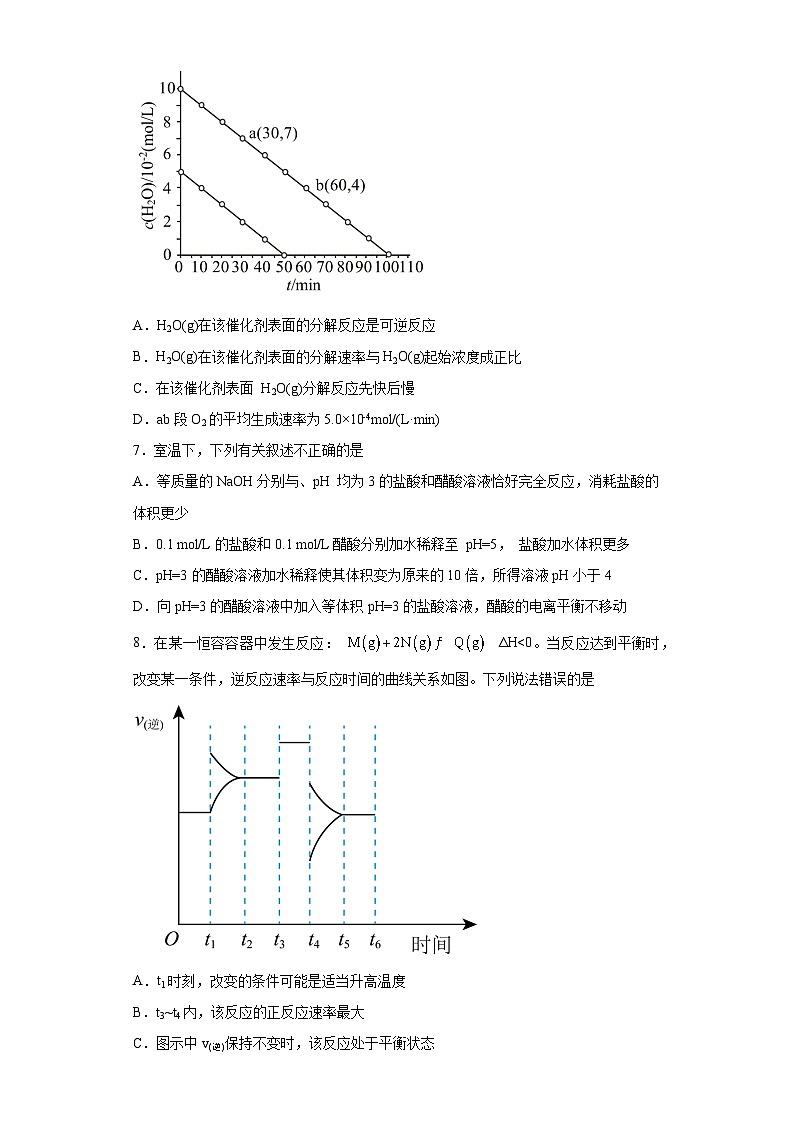
6.一定条件下,H2O(g)在某催化剂表面发生分解反应生成H2和O2,测得的实验结果如图所示。下列叙述正确的是
A.H2O(g)在该催化剂表面的分解反应是可逆反应
B.H2O(g)在该催化剂表面的分解速率与H2O(g)起始浓度成正比
C.在该催化剂表面 H2O(g)分解反应先快后慢
D.ab段O2的平均生成速率为5.0×10-4ml/(L·min)
7.室温下,下列有关叙述不正确的是
A.等质量的NaOH分别与、pH 均为3的盐酸和醋酸溶液恰好完全反应,消耗盐酸的体积更少
B.0.1 ml/L的盐酸和0.1 ml/L醋酸分别加水稀释至 pH=5, 盐酸加水体积更多
C.pH=3的醋酸溶液加水稀释使其体积变为原来的10倍,所得溶液pH小于4
D.向pH=3的醋酸溶液中加入等体积pH=3的盐酸溶液,醋酸的电离平衡不移动
8.在某一恒容容器中发生反应: ΔH<0。当反应达到平衡时,改变某一条件,逆反应速率与反应时间的曲线关系如图。下列说法错误的是
A.t1时刻,改变的条件可能是适当升高温度
B.t3~t4内,该反应的正反应速率最大
C.图示中v(逆)保持不变时,该反应处于平衡状态
D.Q(g)的体积分数最高的时间段是0~t1
9.常温下,用标准溶液滴定三元酸(的第一步电离方程式为),测得溶液的与氢氧化钠溶液体积的关系如图所示,下列说法正确的是
A.滴定过程中可用石蕊作指示剂
B.a点满足:
C.b点满足:
D.随着氢氧化钠溶液的不断加入,水的电离程度不断增大
10.甲、乙、丙三个容器中起始物质及其物质的量如图所示,三个容器最初的容积、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲与丙中放出的热量相同
D.其它条件不变,向平衡后的丙容器中再加入少量N2O4,新平衡后的值变大
11.部分弱电解质的电离平衡常数如表:
下列说法错误的是
A.结合H+的能力:CO>CN->HCO>HCOO-
B.0.1 ml·L-1的HCOONH4溶液中存在以下关系:c(HCOO-)>c(NH)>c(H+)>c(OH-)
C.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)
12.恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为①X=Y;②Y=Z。反应①的速率v1=k1c(X),反应②的速率v2=k2c(Y),式中k1、k2为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的 曲线。下列说法错误的是
A.随c(X)的减小,反应②的速率先增大后减小
B.欲提高 Y 的产率,需控制反应时间
C.温度高于T1时,总反应速率由反应②决定
D.体系中可能存在 v(X)=v(Z)-v(Y)
13.H2在石墨烯负载型Pd单原子催化剂(Pd/SVG)上还原NO生成N2和 NH3的路径机理及活化能(kJ/ml)如图所示。下列说法错误的是
A.H2还原NO生成N2过程中,速率最慢的步骤为⑥
B.Pd/SVG上H2还原NO, 更容易生成NH3
C.根据如图数据可计算的ΔH
D.由图可知,相同催化剂条件下反应可能存在多种反应历程
14.25 °C时,1L 0.1ml·L-1的某二元酸H2RO3溶液中各含R物种的pc-pOH关系如图所示。图中pc表示各含R物种的浓度负对数[pc=-lgc,pOH= -lgc(OH)]。下列说法正确的是
A.曲线③表示pc()随pOH的变化
B.y点的溶液中:c(H2RO3)+2c()=0.1ml·L-1
C.H2RO3的Ka1=1.0×10-6.7
D.2H2RO3+的平衡常数K=1.0×10-5.3
15.室温下,用溶液滴定X(或)的稀溶液,溶液pH与的关系如图所示,已知:,室温下,下列说法错误的是
A.溶液
B.溶液中滴加氨水至溶液呈中性:
C.溶液中滴加至溶液呈中性:
D.溶液中滴加至溶液呈中性:
二、填空题(共4小题,共55分)
16.化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)下列有关化学变化中能量变化的说法中,正确的是___________。
A.需要加热才能发生的反应也可能是放热反应
B.化学键断裂时通常放出能量
C.反应物的总能量高于生成物的总能量表现为吸热反应
D.反应物的总键能高于生成物的总键能表现为吸热反应
(2)甲烷可用于生产合成气,其反应为CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ/ml,已知断裂1 ml相关化学键所需的能量如下表:
则a= ,若加入催化剂改变上述反应历程,上述反应的 ΔH (填“变大”、“变小”或“不变”)
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
① 联氨分子的电子式为 。
② 试写出联氨与过量HCl反应的化学方程式 。
③ 已知:N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/ml
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/ml
H2O(g)=H2O(l) ΔH=-44.0kJ/ml
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH= kJ/ml。
17.金属铍是一种有着“超级金属”之称的新型材料。绿柱石主要成分有BeO、Al2O3、SiO2、Fe2O3和FeO等。采用以下工艺流程可由绿柱石制备单质铍。
已知:i. 铍和铝的化学性质相似。
ii.(NH4)2BeF4易溶于水,且在水中的溶解度随温度升高显著增大。
iii.Be(OH)2在pH>10时会溶解。
(1)提高绿柱石酸浸效率,可适当提高酸液浓度,还可以 (写一条即可)
(2)“氧化”时的离子方程式是 。
(3)滤渣2的主要成分是 (填化学式)。
(4)若在“沉铍”时加入过量的NaOH溶液,则铍的存在形式是 (填离子符号)。
(5)从溶液中得到(NH4)2BeF4晶体需经过 、 、过滤、洗涤、干燥等操作。
(6)下列金属冶炼方法与本工艺流程中加入Mg冶炼Be的方法相似的是___________。
A.高炉炼铁B.电解熔融氯化钠制钠C.铝热反应制锰D.氧化汞分解制汞
18.丙烯是重要的石油化工中间体,工业上常用丙烷催化脱氢和甲醇催化分解等方法制备。回答下列问题:
I.丙烷催化脱氢法制丙烯:C3H8(g)C3H6(g)+H2(g) ΔH1=+123.8kJ/ml。
(1)该反应在 (填“高温”、“低温”或“任意温度”)时可自发进行。
(2)570℃、100kPa,用n(C3H8):n(H2O)=1:9的混合气进行直接脱氢反应,3h后达到平衡,(C3H8的平衡转化率为 80%,脱氢反应的)Kp= kPa。(结果保留3位有效数字,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压-总压×物质的量分数)
Ⅱ. 二氧化碳耦合丙烷脱氢制丙烯:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH2
CO2(g)+C3H8(g)C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/ml
(3)相同温度下的恒压密闭容器中,在丙烷催化脱氢法的基础上充入CO2,即为二氧化碳耦合丙烷脱氢法,该方法的优点为 。
(4)下列能说明该体系在恒温恒压密闭容器中反应达到平衡状态的是___________(填序号)。
A.CO2的物质的量分数保持不变
B.n(H2O):n(CO)保持不变
C.气体密度保持不变
D.速率关系:v(C3H8)=c(C3H6)
Ⅲ. 甲醇催化分解:3CH3OH(g)=C3H6(g)+3H2O(g)
(5)该反应的实验数据遵循 Arhenius 经验公式:(Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得 。(填“越多”或“越少”)。根据如图曲线a计算该反应的活化能E,为 kJ·ml-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是 。
19.I.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取4.1g烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需 。
(2)取10.00mL待测液,用 量取。
(3)用0.2000ml/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是 。
(4)根据表中数据,计算样品烧碱的质量分数为 (结果保留四位有效数字)。
(5)滴定过程,下列情况会使测定结果偏高的是 (填序号)。
① 记录酸式滴定管起始体积时,仰视读数,终点时俯视
② 碱式滴定管水洗后就用来量取待测液
③ 滴定前,酸式滴定管有气泡,滴定后消失
④ 取待测液时滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下
II. 在常温时,几种酸的电离平衡常数(Ka)如下:
(6)向NaClO溶液中通入少量CO2的离子方程式为 。
(7)向10mL0.1 ml·L-1的Na2CO3溶液中滴加5mL0.1ml/LHCl溶液,溶液中离子的浓度由大到小的顺序为 。
(8)室温下pH均为5的CH3COOH、NH4Cl溶液中由水电离产生的c(H+)的比值为 。
弱电解质
HCOOH
HCN
H2CO3
NH3·H2O
电离平衡常数
(25 ℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
Kb=1.8×10-5
化学键
H-H
O-H
C-H
C=O
键能/(kJ·ml-¹)
436
a
415.1
1076
滴定次数
待测液体积(mL)
标准盐酸体积(mL)
滴定前读数(mL)
滴定后读数(mL)
第一次
10.00
0.50
20.40
第二次
10.00
4.00
24.10
第三次
10.00
5.12
28.02
溶质
CH3COOH
H2CO3
HClO
Ka
2×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
3×10-8
【参考答案】
1~5 ACBAD 6~10 DADCB 11~15 CCCDB
16.(1)AD
(2)465 不变
(3) N2H4+2HCl=N2H6Cl2 -1310.4
17.(1)提高浸取温度:将绿柱石粉碎(任答一条,合理即可)
(2)2H++H2O2+2Fe2+=2Fe3++2H2O
(3)Fe(OH)3、Al(OH)3
(4)BeO或Be(OH)
(5)蒸发浓缩 冷却结晶
(6)AC
18.(1)高温
(2)29.6
(3)C3H8转化率提高
(4)AC
(5)越多 31 改用更高效的催化剂
19.(1)250mL容量瓶、胶头流管
(2)碱式滴定管 (或移液管)
(3)滴入最后半滴盐酸,溶液由红色变为无色,且30s内不恢复
(4)97.56%(或0.9756)
(5)③
(6)ClO-+CO2+H2O=HCO+HClO
(7)c(Na+)>c(HCO)>c(Cl-)>c(CO)>c(OH-)>c(H+)
(8)1: 104
辽宁省实验中学2023-2024学年高二下学期期中阶段测试化学试题(含答案): 这是一份辽宁省实验中学2023-2024学年高二下学期期中阶段测试化学试题(含答案),共9页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
辽宁省实验中学2023-2024学年高一下学期期中阶段测试化学试题(PDF版含答案): 这是一份辽宁省实验中学2023-2024学年高一下学期期中阶段测试化学试题(PDF版含答案),文件包含23-24下中高一化学pdf、23-24下中高一化学答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
辽宁省实验中学2023-2024学年高二上学期期中阶段测试化学试卷(含答案): 这是一份辽宁省实验中学2023-2024学年高二上学期期中阶段测试化学试卷(含答案),共18页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。












